名校
1 . 《我在故宫修文物》这部纪录片里关于古代青铜器的修复引起了某研学小组的兴趣。“修旧如旧”是文物保护的主旨。
(1)查阅高中教材得知铜锈为 ,俗称铜绿,可溶于酸。铜绿在一定程度上可以提升青铜器的艺术价值。参与形成铜绿的物质有
,俗称铜绿,可溶于酸。铜绿在一定程度上可以提升青铜器的艺术价值。参与形成铜绿的物质有 和
和_______ ,基态 原子的电子排布式为
原子的电子排布式为_______ 。
(2)继续查阅中国知网,了解到铜锈的成分非常复杂,主要成分有 和
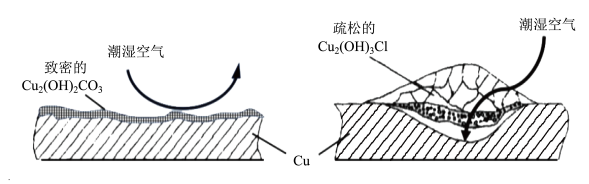
和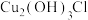 。考古学家将铜锈分为无害锈和有害锈,结构如图所示:
。考古学家将铜锈分为无害锈和有害锈,结构如图所示:
 和
和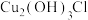 分别属于无害锈和有害锈,请解释原因
分别属于无害锈和有害锈,请解释原因_______ 。
(3)文献显示有害锈的形成过程中会产生 (白色不溶于水的固体),请结合下图回答:
(白色不溶于水的固体),请结合下图回答:
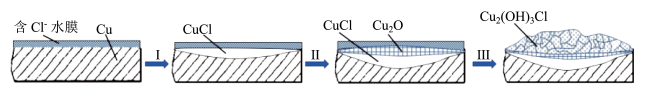
①过程I的正极反应物是_______ 。
②过程I负极的电极反应式是_______ 。
(4)青铜器的修复有以下三种方法:
i.柠檬酸浸法:将腐蚀文物直接放在2%-3%的柠檬酸溶液中浸泡除锈;
ii.碳酸钠法:将腐蚀文物置于含 的缓冲溶液中浸泡,使
的缓冲溶液中浸泡,使 转化为难溶的
转化为难溶的 ;
;
iii. 保护法:
保护法:
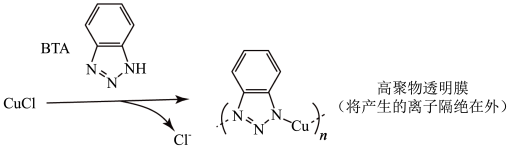
①写出碳酸钠法的离子方程式_______ 。
②三种方法中, 保护法应用最为普遍,分析其可能的优点有
保护法应用最为普遍,分析其可能的优点有_______ 。
A.在青铜器表面形成一层致密的透明保护膜
B.替换出锈层中的 ,能够高效的除去有害锈
,能够高效的除去有害锈
C.和酸浸法相比,不破坏无害锈,可以保护青铜器的艺术价值,做到“修旧如旧”
(1)查阅高中教材得知铜锈为
 ,俗称铜绿,可溶于酸。铜绿在一定程度上可以提升青铜器的艺术价值。参与形成铜绿的物质有
,俗称铜绿,可溶于酸。铜绿在一定程度上可以提升青铜器的艺术价值。参与形成铜绿的物质有 和
和 原子的电子排布式为
原子的电子排布式为(2)继续查阅中国知网,了解到铜锈的成分非常复杂,主要成分有
 和
和 。考古学家将铜锈分为无害锈和有害锈,结构如图所示:
。考古学家将铜锈分为无害锈和有害锈,结构如图所示:
 和
和 分别属于无害锈和有害锈,请解释原因
分别属于无害锈和有害锈,请解释原因(3)文献显示有害锈的形成过程中会产生
 (白色不溶于水的固体),请结合下图回答:
(白色不溶于水的固体),请结合下图回答:
①过程I的正极反应物是
②过程I负极的电极反应式是
(4)青铜器的修复有以下三种方法:
i.柠檬酸浸法:将腐蚀文物直接放在2%-3%的柠檬酸溶液中浸泡除锈;
ii.碳酸钠法:将腐蚀文物置于含
 的缓冲溶液中浸泡,使
的缓冲溶液中浸泡,使 转化为难溶的
转化为难溶的 ;
;iii.
 保护法:
保护法:
①写出碳酸钠法的离子方程式
②三种方法中,
 保护法应用最为普遍,分析其可能的优点有
保护法应用最为普遍,分析其可能的优点有A.在青铜器表面形成一层致密的透明保护膜
B.替换出锈层中的
 ,能够高效的除去有害锈
,能够高效的除去有害锈C.和酸浸法相比,不破坏无害锈,可以保护青铜器的艺术价值,做到“修旧如旧”
您最近一年使用:0次
名校
解题方法
2 . KMnO4是一种高效氧化剂,可用来氧化吸附有机异味物,也可以与水中的杂质如二价铁、锰、硫、氰、酚等反应。实验室常用Na2C2O4标准溶液标定未知浓度的KMnO4溶液,发生反应:5C2O +2MnO
+2MnO +16H++4H2O=2[Mn(H2O)6]2++10CO2↑。根据以上信息,完成下列问题:
+16H++4H2O=2[Mn(H2O)6]2++10CO2↑。根据以上信息,完成下列问题:
(1)基态Mn2+的核外电子排布式可表示为___________ ,上述反应方程式中的各原子的电负性由大到小的关系是___________ 。
(2)1mol[Mn(H2O)6]2+中所含有的共价键数目为___________ 。
(3)CO2的电子式是___________ ,C2O 中碳原子的轨道杂化类型是
中碳原子的轨道杂化类型是___________ 。
(4)同主族元素氧、硫、硒对应最简单氢化物的沸点由高到低顺序是___________ ,原因是___________ 。
(5)β—MnSe的结构中Se为面心立方最密堆积,晶胞结构如图所示。
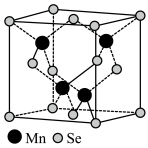
①β—MnSe中Mn的配位数为___________ 。
②若该晶体的晶胞参数为apm,阿伏加德罗常数的值为NA。则距离最近的两个锰原子之间的距离为___________ pm。
 +2MnO
+2MnO +16H++4H2O=2[Mn(H2O)6]2++10CO2↑。根据以上信息,完成下列问题:
+16H++4H2O=2[Mn(H2O)6]2++10CO2↑。根据以上信息,完成下列问题:(1)基态Mn2+的核外电子排布式可表示为
(2)1mol[Mn(H2O)6]2+中所含有的共价键数目为
(3)CO2的电子式是
 中碳原子的轨道杂化类型是
中碳原子的轨道杂化类型是(4)同主族元素氧、硫、硒对应最简单氢化物的沸点由高到低顺序是
(5)β—MnSe的结构中Se为面心立方最密堆积,晶胞结构如图所示。

①β—MnSe中Mn的配位数为
②若该晶体的晶胞参数为apm,阿伏加德罗常数的值为NA。则距离最近的两个锰原子之间的距离为
您最近一年使用:0次
解题方法
3 . 铝和硅在地壳中含量丰富,其单质和化合物具有广泛的应用价值。请回答下列问题:
(1)①基态Si原子的价电子排布式为___________ 。
②写出一种与SiCl4互为等电子体的离子的化学式___________ 。
(2)AlCl3的相对分子质量为133.5,178℃开始升华,易溶于水、四氯化碳等,熔融时生成可挥发的二聚物(Al2Cl6),结构如图所示:
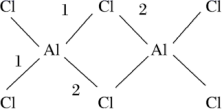
①二聚物中Al原子的杂化轨道类型为___________ 。
②从键的形成角度分析1键和2键的区别:___________ 。
(3)LiAlH4是一种特殊的还原剂,可将羧酸直接还原成醇。
CH3COOH CH3CH2OH
CH3CH2OH
①AlH 的VSEPR模型名称是
的VSEPR模型名称是___________ 。
②CH3COOH分子中π键和σ键的数目之比为___________
(4)铝和氮可形成一种具有四面体结构单元的高温结构陶瓷,其晶胞如图所示:

晶胞中Al的配位数是___________ ,若该晶胞的边长为a pm,则该晶体的密度为___________ g·cm-3.(用NA表示阿伏加德罗常数的值) 相对分子质量 Al-27 N-14
(1)①基态Si原子的价电子排布式为
②写出一种与SiCl4互为等电子体的离子的化学式
(2)AlCl3的相对分子质量为133.5,178℃开始升华,易溶于水、四氯化碳等,熔融时生成可挥发的二聚物(Al2Cl6),结构如图所示:

①二聚物中Al原子的杂化轨道类型为
②从键的形成角度分析1键和2键的区别:
(3)LiAlH4是一种特殊的还原剂,可将羧酸直接还原成醇。
CH3COOH
 CH3CH2OH
CH3CH2OH①AlH
 的VSEPR模型名称是
的VSEPR模型名称是②CH3COOH分子中π键和σ键的数目之比为
(4)铝和氮可形成一种具有四面体结构单元的高温结构陶瓷,其晶胞如图所示:

晶胞中Al的配位数是
您最近一年使用:0次
解题方法
4 . ⅣA族元素及其化合物在材料等方面有重要用途,碳在自然界中存在多种同素异形体,硅、锗(Ge)及其化合物广泛应用于光电材料领域。回答下列问题:
(1)碳的一种单质的晶胞结构如图(a)所示。该单质的晶体类型为___ ,原子间存在的共价键类型为___ (填“σ键”、“π键”),碳原子杂化方式为___ 。

(2)基态Ge原子的核外电子排布式为[Ar]___ ,有___ 个未成对电子。
(3)硅和卤素单质反应可以得到SiX4,SiX4的沸点和二卤化铅PbX2的熔点如图(b)所示。
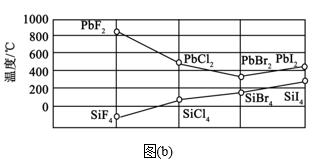
①0℃时,SiF4、SiCl4、SiBr4、SiI4呈液态的是___ (填化学式),沸点依次升高的原因是___ ,气态分子SiX4的空间构型是__ 。
②结合SiX4的沸点和PbX2的熔点的变化规律,可推断:依F、Cl、Br、I的次序,PbX2中的化学键的离子性__ 、共价性__ 。(填“增强”“不变”或“减弱”)
(4)立方氮化硼的结构与图(a)相似,已知晶胞边长为361.5pm,则立方氮化硼的密度是___ g·cm-3。(只要求列算式,不必计算出数值,阿伏加德罗常数用NA表示)
(1)碳的一种单质的晶胞结构如图(a)所示。该单质的晶体类型为

(2)基态Ge原子的核外电子排布式为[Ar]
(3)硅和卤素单质反应可以得到SiX4,SiX4的沸点和二卤化铅PbX2的熔点如图(b)所示。

①0℃时,SiF4、SiCl4、SiBr4、SiI4呈液态的是
②结合SiX4的沸点和PbX2的熔点的变化规律,可推断:依F、Cl、Br、I的次序,PbX2中的化学键的离子性
(4)立方氮化硼的结构与图(a)相似,已知晶胞边长为361.5pm,则立方氮化硼的密度是
您最近一年使用:0次
2021高三·全国·专题练习
5 . 回答下列问题:
(1)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图所示,M原子位于晶胞的棱上与内部。该晶胞中M原子的个数为___________ ,该材料的化学式为___________ 。

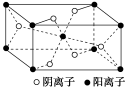
(2)Mg与某元素形成的化合物的晶胞如图所示,晶胞中阴离子与阳离子的个数比是___________ 。
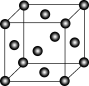
(3)Cu2O在稀硫酸中生成Cu和CuSO4.铜晶胞结构如图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为___________ 。
(1)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图所示,M原子位于晶胞的棱上与内部。该晶胞中M原子的个数为

(2)Mg与某元素形成的化合物的晶胞如图所示,晶胞中阴离子与阳离子的个数比是

(3)Cu2O在稀硫酸中生成Cu和CuSO4.铜晶胞结构如图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为

您最近一年使用:0次
名校
6 . 有机金属化合物的应用研究是目前科学研究的前沿之一、二茂铁[(C5H5)2Fe]的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。二茂铁分子是一种金属有机配合物,熔点173℃,沸点249℃,100℃以上能升华;不溶于水,易溶于苯、乙醚、汽油等有机溶剂。环戊二烯和二茂铁的结构如图所示。回答下列问题。
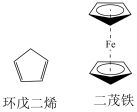
(1)环戊二烯分子中σ键和π键的个数比为___________ 。
(2)下列关于环戊二烯和二茂铁的说法不正确的是___________ (填字母序号)。
A.环戊二烯分子中五个碳原子均发生sp2杂化
B.在一定的条件下,环戊二烯能与氢气发生加成反应生成环戊烷
C.二茂铁晶体是分子晶体
D.环戊二烯的同分异构体可能是含两个碳碳三键的炔烃
(3)环戊二烯能使溴的四氯化碳溶液褪色。写出环戊二烯与足量的溴的四氯化碳溶液反应的化学方程式___________ 。
(4)已知环戊二烯阴离子(C5H )的结构与苯分子相似,具有芳香性。二茂铁[(C5H5)2Fe]晶体中存在的微粒间的作用力有
)的结构与苯分子相似,具有芳香性。二茂铁[(C5H5)2Fe]晶体中存在的微粒间的作用力有___________ (填字母序号)。
a.离子键 b.σ键 c.π键 d.氢键 e.配位键
(5)金刚烷可用于抗病毒、抗肿瘤等特效药物的合成。工业上用环戊二烯合成金刚烷的流程如图所示:

①金刚烷的分子式为___________ ,反应①的反应类型是___________ 。
②金刚烷的二氯代物有___________ 种(不考虑立体异构)。
③二聚环戊二烯有多种同分异构体。写出一种符合下列条件的二聚环戊二烯的同分异构体的结构简式___________ 。
(a)属于芳香烃且能使溴的四氯化碳溶液褪色;
(b)苯环上有三个取代基;
(c)苯环上的一氯代物有2种。

(1)环戊二烯分子中σ键和π键的个数比为
(2)下列关于环戊二烯和二茂铁的说法不正确的是
A.环戊二烯分子中五个碳原子均发生sp2杂化
B.在一定的条件下,环戊二烯能与氢气发生加成反应生成环戊烷
C.二茂铁晶体是分子晶体
D.环戊二烯的同分异构体可能是含两个碳碳三键的炔烃
(3)环戊二烯能使溴的四氯化碳溶液褪色。写出环戊二烯与足量的溴的四氯化碳溶液反应的化学方程式
(4)已知环戊二烯阴离子(C5H
 )的结构与苯分子相似,具有芳香性。二茂铁[(C5H5)2Fe]晶体中存在的微粒间的作用力有
)的结构与苯分子相似,具有芳香性。二茂铁[(C5H5)2Fe]晶体中存在的微粒间的作用力有a.离子键 b.σ键 c.π键 d.氢键 e.配位键
(5)金刚烷可用于抗病毒、抗肿瘤等特效药物的合成。工业上用环戊二烯合成金刚烷的流程如图所示:

①金刚烷的分子式为
②金刚烷的二氯代物有
③二聚环戊二烯有多种同分异构体。写出一种符合下列条件的二聚环戊二烯的同分异构体的结构简式
(a)属于芳香烃且能使溴的四氯化碳溶液褪色;
(b)苯环上有三个取代基;
(c)苯环上的一氯代物有2种。
您最近一年使用:0次
7 . 主族元素N、P、As、Se、Cl等的某些化合物对工农业生产意义重大,回答下列问题:
(1)N、P、As电负性由大到小的顺序为_______ ,As的第一电离能比Se的第一电离能大的原因为_______
(2)阿散酸(如图)是一种饲料添加剂,能溶于NaOH溶液中,常含有H3AsO3、NaCl等杂质,该结构中N的杂化方式为_______ ,AsO 的空间构型为
的空间构型为_______

(3)液氨可作制冷剂,汽化时吸收大量的热的原因是_______
(4)NaCl晶体与Na或Cl2在50~300 GPa的高压下反应,可以形成不同的晶体,其中一种晶体的晶胞如图1所示,该晶体的化学式为_______

(5)CrCl3能与H2O、NH3形成配位数为6的配合物,且相应两种配体的物质的量之比为2:1,1mol该配合物溶于水,加入足量的硝酸银溶液可得430.5g白色沉淀,则该配合物的化学式为_______ 。
(1)N、P、As电负性由大到小的顺序为
(2)阿散酸(如图)是一种饲料添加剂,能溶于NaOH溶液中,常含有H3AsO3、NaCl等杂质,该结构中N的杂化方式为
 的空间构型为
的空间构型为
(3)液氨可作制冷剂,汽化时吸收大量的热的原因是
(4)NaCl晶体与Na或Cl2在50~300 GPa的高压下反应,可以形成不同的晶体,其中一种晶体的晶胞如图1所示,该晶体的化学式为

(5)CrCl3能与H2O、NH3形成配位数为6的配合物,且相应两种配体的物质的量之比为2:1,1mol该配合物溶于水,加入足量的硝酸银溶液可得430.5g白色沉淀,则该配合物的化学式为
您最近一年使用:0次
名校
8 . 根据元素在体内含量不同,可将体内元素分为常量元素和微量元素。其中H、C、O、N、S、P等为常量元素,Fe、Zn等为微量元素。回答下列问题:
(1)锌的氨合离子[Zn(NH3)4]2+中存在的化学键有___ 。
A.离子键 B.共价键 C.配位键 D.氢键 E.σ键 F.π键
(2)数据表明,S的第一电离能小于P的第一电离能,其原因可能有两种:一种原因是S失去的是已经配对的电子,配对电子相互排斥,电离能较低,另一种是原因是___ 。
(3)氧与氮可形成正离子 ,其空间构型为
,其空间构型为___ 。
(4)与 互为等电子体的一种分子为
互为等电子体的一种分子为___ (填化学式)。
(5)H2O分子中的键长比H2S中的键长___ (填“长”或“短”)。H2O分子的键角比H2S的键角大,其原因是___ 。S8与热的浓NaOH溶液反应的产物之一为Na2S3,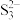 的空间构型为
的空间构型为__ 。
(1)锌的氨合离子[Zn(NH3)4]2+中存在的化学键有
A.离子键 B.共价键 C.配位键 D.氢键 E.σ键 F.π键
(2)数据表明,S的第一电离能小于P的第一电离能,其原因可能有两种:一种原因是S失去的是已经配对的电子,配对电子相互排斥,电离能较低,另一种是原因是
(3)氧与氮可形成正离子
 ,其空间构型为
,其空间构型为(4)与
 互为等电子体的一种分子为
互为等电子体的一种分子为(5)H2O分子中的键长比H2S中的键长
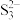 的空间构型为
的空间构型为
您最近一年使用:0次
9 . 硼及其化合物在新材料、工农业生产等方面用途广泛。请回答下列问题:
(1)二溴硼基二茂铁(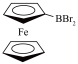 )是硼的有机化合物,写出基态Fe原子的电子排布式
)是硼的有机化合物,写出基态Fe原子的电子排布式 ___________ ;基态溴原子的最外层电子排布图 ___________ 。
(2)立方氮化硼(BN)可利用人工方法在高温高压条件下合成,属于超硬材料,同属原子晶体的氮化硼比晶体硅具有更高的硬度和耐热性的原因是:_____ 。
(3)BF3常被用于制取其他硼的化合物,BF3分子中中心原子的杂化轨道类型是___________ ,SiF4微粒的空间构型是___________ 。
(4)NaBH4被认为是有机化学中的“万能还原剂”,其中三种元素的电负性由大到小的顺序是___________ ;NaBH4的电子式为___________ 。
(5)自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作 ,实际上它的结构单元是由两个
,实际上它的结构单元是由两个 和两个
和两个 缩合而成的双六元环,应该写成
缩合而成的双六元环,应该写成 ,其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是
,其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是___________ (填字母)。
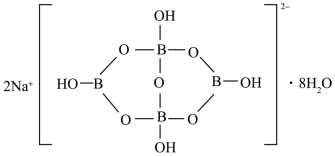
A.离子键 B.共价键 C.氢键 D.金属键
(1)二溴硼基二茂铁(
 )是硼的有机化合物,写出基态Fe原子的电子排布式
)是硼的有机化合物,写出基态Fe原子的电子排布式 (2)立方氮化硼(BN)可利用人工方法在高温高压条件下合成,属于超硬材料,同属原子晶体的氮化硼比晶体硅具有更高的硬度和耐热性的原因是:
(3)BF3常被用于制取其他硼的化合物,BF3分子中中心原子的杂化轨道类型是
(4)NaBH4被认为是有机化学中的“万能还原剂”,其中三种元素的电负性由大到小的顺序是
(5)自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作
 ,实际上它的结构单元是由两个
,实际上它的结构单元是由两个 和两个
和两个 缩合而成的双六元环,应该写成
缩合而成的双六元环,应该写成 ,其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是
,其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是
A.离子键 B.共价键 C.氢键 D.金属键
您最近一年使用:0次
名校
10 . 镍是一种用途广泛的金属,常用于电镀工业和制造电池。镍易形成Ni(CO)4、[Ni(NH3)6]SO4等配合物。
(1)Ni2+的核外电子排布式为_______ 。
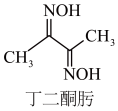
(2)Ni2+可用丁二酮肟检验。丁二酮肟的结构如图所示,其分子中碳原子轨道的杂化类型为_______ 。
(3)与CO互为等电子体的阴离子的化学式为_______ 。
(4)1mol [Ni(NH3)6]SO4中σ键的数目为_______ 。氨的沸点高于膦(PH3),原因是_______ 。
(5)镧镍合金是较好的储氢材料。储氢后所得晶体的化学式为LaNi5H6,晶胞结构如图所示,X、Y、Z表示储氢后的三种微粒,则图中Z表示的微粒为_______ (填化学式)。

(1)Ni2+的核外电子排布式为
(2)Ni2+可用丁二酮肟检验。丁二酮肟的结构如图所示,其分子中碳原子轨道的杂化类型为

(3)与CO互为等电子体的阴离子的化学式为
(4)1mol [Ni(NH3)6]SO4中σ键的数目为
(5)镧镍合金是较好的储氢材料。储氢后所得晶体的化学式为LaNi5H6,晶胞结构如图所示,X、Y、Z表示储氢后的三种微粒,则图中Z表示的微粒为

您最近一年使用:0次



