解题方法
1 . 硫酸亚铁铵是一种蓝绿色的复盐,俗名为摩尔盐,化学式为(NH4)2Fe(SO4)2•6H2O。它在空气中稳定,是重要的化工原料,用途十分广泛。该物质隔绝空气加强热会发生分解,一种分解方式可表示为:(NH4)2Fe(SO4)2•6H2O=2NH3↑+FeO+2SO3↑+7H2O↑。请回答下列问题:
(1)基态铁原子的价电子排布式为___________ ,s电子的电子云形状为___________ 。
(2)摩尔盐中的组成元素N、O的电负性大小顺序是___________ 。
(3)SO2、SO3、SO 是三种常见含硫微粒。
是三种常见含硫微粒。
①SO 微粒的立体构型为
微粒的立体构型为___________ ,SO2中心原子的杂化方式为___________ 。
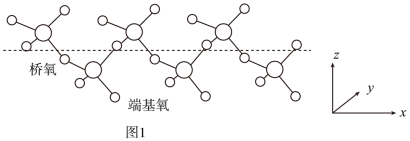
②固态SO3能以无限长链形式存在,结构如图1所示。与硫原子形成化学键更长的是___________ (填“桥氧”或“端基氧”),理由是___________ 。
(4)噻吩( )、吡咯(
)、吡咯(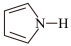 )都可与Fe3+形成配位化合物。在水中的溶解度噻吩
)都可与Fe3+形成配位化合物。在水中的溶解度噻吩___________ 吡咯(填“<”、“>”或“=”),理由是___________ 。
(5)氧化亚铁的一种晶胞与氯化钠晶胞类似,如图2所示。
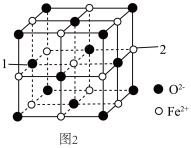
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图2中原子1的坐标为(0, ,
, ),则原子2的坐标为
),则原子2的坐标为___________ 。
②Fe2+处于O2﹣围成的___________ 空隙中。(填“正四面体”或“正八面体”)
③该晶体的密度为ρg•cm﹣3,用N0表示阿伏加德罗常数的值,则该晶胞边长为___________ pm。
(1)基态铁原子的价电子排布式为
(2)摩尔盐中的组成元素N、O的电负性大小顺序是
(3)SO2、SO3、SO
 是三种常见含硫微粒。
是三种常见含硫微粒。①SO
 微粒的立体构型为
微粒的立体构型为②固态SO3能以无限长链形式存在,结构如图1所示。与硫原子形成化学键更长的是

(4)噻吩(
 )、吡咯(
)、吡咯( )都可与Fe3+形成配位化合物。在水中的溶解度噻吩
)都可与Fe3+形成配位化合物。在水中的溶解度噻吩(5)氧化亚铁的一种晶胞与氯化钠晶胞类似,如图2所示。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图2中原子1的坐标为(0,
 ,
, ),则原子2的坐标为
),则原子2的坐标为②Fe2+处于O2﹣围成的
③该晶体的密度为ρg•cm﹣3,用N0表示阿伏加德罗常数的值,则该晶胞边长为
您最近一年使用:0次
2022-04-15更新
|
333次组卷
|
2卷引用:新疆维吾尔自治区乌鲁木齐市2021届高三第二次质量检测理综化学试题
解题方法
2 . KZnF3被认为是良好的光学基质材料,可由K2CO3、ZnF2、NH4HF2制备。回答下列问题:
(1)基态F原子的外围电子轨道表示式_______ 。
(2)K2CO3中阴离子的空间结构为_______ 。
(3)NH4HF2的组成元素的电负性由大到小的顺序为_______ (用元素符号表示);其中N原子的杂化方式为_______ ;HF能形成分子缔合体(HF)n的原因为_______ 。
(4)ZnF2具有金红石型四方结构,KZnF3具有钙钛矿型立方结构,两种晶体的晶胞结构如图所示:

①ZnF2和KZnF3晶体(晶胞顶点为K+ )中,Zn的配位数之比为_______ 。
②若NA表示阿伏加德罗常数的值,则ZnF2晶体的密度为_______ g·cm-3(用含a、c、NA的代数式表示)。
(1)基态F原子的外围电子轨道表示式
(2)K2CO3中阴离子的空间结构为
(3)NH4HF2的组成元素的电负性由大到小的顺序为
(4)ZnF2具有金红石型四方结构,KZnF3具有钙钛矿型立方结构,两种晶体的晶胞结构如图所示:

①ZnF2和KZnF3晶体(晶胞顶点为K+ )中,Zn的配位数之比为
②若NA表示阿伏加德罗常数的值,则ZnF2晶体的密度为
您最近一年使用:0次
名校
解题方法
3 .  五种元素的单质及其化合物在现代工业生产中有着广泛应用。请回答下列问题:
五种元素的单质及其化合物在现代工业生产中有着广泛应用。请回答下列问题:
(1)第一电离能:N_______ (填“>”或“<”,下同)O,电负性:O_______ S。
(2) 极易溶于水的原因是
极易溶于水的原因是_______ ; 属于
属于_______ (填“极性”或“非极性”)分子,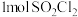 含有
含有 的键为
的键为_______  。
。
(3) 的空间构型是
的空间构型是_______ , 的中心原子的杂化方式为
的中心原子的杂化方式为_______ 。
(4)与 互为等电子体的微粒有
互为等电子体的微粒有_______ (任写两种)。
(5) 与
与 形成化合物的晶胞如图所示。
形成化合物的晶胞如图所示。
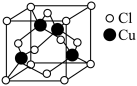
该晶体的化学式为_______ .已知该晶体中 原子和
原子和 原子之间的最短距离为
原子之间的最短距离为 ,且恰好为体对角线的
,且恰好为体对角线的 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶体的密度为
,则该晶体的密度为_______ (只写计算式) 。
。
 五种元素的单质及其化合物在现代工业生产中有着广泛应用。请回答下列问题:
五种元素的单质及其化合物在现代工业生产中有着广泛应用。请回答下列问题:(1)第一电离能:N
(2)
 极易溶于水的原因是
极易溶于水的原因是 属于
属于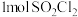 含有
含有 的键为
的键为 。
。(3)
 的空间构型是
的空间构型是 的中心原子的杂化方式为
的中心原子的杂化方式为(4)与
 互为等电子体的微粒有
互为等电子体的微粒有(5)
 与
与 形成化合物的晶胞如图所示。
形成化合物的晶胞如图所示。
该晶体的化学式为
 原子和
原子和 原子之间的最短距离为
原子之间的最短距离为 ,且恰好为体对角线的
,且恰好为体对角线的 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶体的密度为
,则该晶体的密度为 。
。
您最近一年使用:0次
名校
解题方法
4 . 纳米磷化钴常用于制作特种钴玻璃,制备磷化钴的常用流程如图:

(1)基态Co原子的价层电子排布图为___ ,其在元素周期表中位于___ 区。
(2)尿素分子中σ键和π键的个数比为___ ,组成尿素的元素中,属于第二周期元素且第一电离能由大到小的顺序是___ (填元素符号)。
(3)科学研究表明Co(CO3)0.5(OH)•0.11H2O中存在配位键。
①其中提供空轨道的是___ (填化学符号)。
②CO 中心原子的杂化方式为
中心原子的杂化方式为___ 。
③H2O的沸点高于同族元素气态氢化物的原因是___ 。
(4)磷化钴的晶胞结构如图所示。

①基态P原子电子占据最高能级的电子云轮廓图为___ 形。
②与P原子最近等距的Co原子构成的空间结构为___ 。

(1)基态Co原子的价层电子排布图为
(2)尿素分子中σ键和π键的个数比为
(3)科学研究表明Co(CO3)0.5(OH)•0.11H2O中存在配位键。
①其中提供空轨道的是
②CO
 中心原子的杂化方式为
中心原子的杂化方式为③H2O的沸点高于同族元素气态氢化物的原因是
(4)磷化钴的晶胞结构如图所示。

①基态P原子电子占据最高能级的电子云轮廓图为
②与P原子最近等距的Co原子构成的空间结构为
您最近一年使用:0次
5 . 在人类文明的历程中,许多物质发挥过重要作用,如铁、硝酸钾、青霉素、含铬物 质等。
(1)Fe 的基态原子最高能层符号为___________ ;Fe3+在基态时,价电子排布式为___________ 。
(2)KNO3中NO 的立体构型为
的立体构型为___________ ,写出与 NO 互为等电子体的另一种阴离子的化学式:
互为等电子体的另一种阴离子的化学式:___________
(3)6—氨基青霉烷酸的结构如图所示。结构中S原子的杂化方式是___________ ;组成中 C、N、O三种元素的第一电离能由大到小的顺序是___________ ;分子中有___________ 个手性碳原子。

(4)已知配合物CrCl3·6H2O中心离子 Cr3+的配位数为 6,向含 0.1 mol CrCl3·6H2O 的溶液中滴加2 mol·L-1 AgNO3溶液,反应完全后共消耗 AgNO3溶液 50 mL,则该配离子的化学式为___________ 。
(5)如图所示,Fe3O4晶体中,O2-围成正四面体空隙(如:1、3、6、7 围成)和正八面体空隙(如:3、6、7、8、9、12 围成),Fe3O4中有一半的 Fe3+填充在正四面体空隙中,Fe2+和另一半 Fe3+填充 在正八面体空隙中。则没有填充阳离子的正八面体空隙数与没有填充阳离子的正四面体空隙数之比为___________ 。

(1)Fe 的基态原子最高能层符号为
(2)KNO3中NO
 的立体构型为
的立体构型为 互为等电子体的另一种阴离子的化学式:
互为等电子体的另一种阴离子的化学式:(3)6—氨基青霉烷酸的结构如图所示。结构中S原子的杂化方式是

(4)已知配合物CrCl3·6H2O中心离子 Cr3+的配位数为 6,向含 0.1 mol CrCl3·6H2O 的溶液中滴加2 mol·L-1 AgNO3溶液,反应完全后共消耗 AgNO3溶液 50 mL,则该配离子的化学式为
(5)如图所示,Fe3O4晶体中,O2-围成正四面体空隙(如:1、3、6、7 围成)和正八面体空隙(如:3、6、7、8、9、12 围成),Fe3O4中有一半的 Fe3+填充在正四面体空隙中,Fe2+和另一半 Fe3+填充 在正八面体空隙中。则没有填充阳离子的正八面体空隙数与没有填充阳离子的正四面体空隙数之比为

您最近一年使用:0次
名校
解题方法
6 . 锌及锌的化合物应用广泛。测定铜合金中的锌时要利用下列反应:[Zn(CN)4]2-+4HCHO+4H2O = Zn2++4HOCH2CN+4OH- 。回答下列问题:
(1)基态 Zn2+的电子排布式为___________ ,[Zn(CN)4]2-中 Zn2+与 CN-之间的化学键称为___________ ,CN-的电子式为___________ 。
(2)基态 C 原子核外电子占据___________ 个不同原子轨道,C、N、O 三种元素的电负性由大到小的 顺序为___________ 。
(3)HCHO 分子中碳原子轨道的杂化类型是___________ ,HOCH2CN 分子中含有的σ键与π键数目之 比为___________ 。
(4)S 与 Zn 所形成化合物晶体的晶胞如图所示。
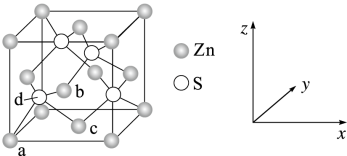
①在该晶胞中,Zn 的配位数为___________ 。
②原子坐标参数可表示晶胞内部各原子的相对位置。上图晶胞中,原子坐标参数 a 为(0,0,0);b为( ,0,
,0, );c为(
);c为( ,
, ,0),则 d 的原子坐标参数为
,0),则 d 的原子坐标参数为___________ 。
③已知该晶胞的密度为ρ g·cm-3,设 NA为阿伏加德罗常数的值,则其中两个 S 之间的最短距离 为___________ pm。(列出计算式即可)
(1)基态 Zn2+的电子排布式为
(2)基态 C 原子核外电子占据
(3)HCHO 分子中碳原子轨道的杂化类型是
(4)S 与 Zn 所形成化合物晶体的晶胞如图所示。

①在该晶胞中,Zn 的配位数为
②原子坐标参数可表示晶胞内部各原子的相对位置。上图晶胞中,原子坐标参数 a 为(0,0,0);b为(
 ,0,
,0, );c为(
);c为( ,
, ,0),则 d 的原子坐标参数为
,0),则 d 的原子坐标参数为③已知该晶胞的密度为ρ g·cm-3,设 NA为阿伏加德罗常数的值,则其中两个 S 之间的最短距离 为
您最近一年使用:0次
解题方法
7 . 第四周期某些过渡元素在工业生产中有着极其重要的作用。
Ⅰ.中国锰矿资源较多,分布广泛。
(1)写出基态锰原子的价电子排布图:___________ 。
(2) 用于
用于 分解制氧气的催化剂,
分解制氧气的催化剂, 中氧原子的杂化轨道类型为
中氧原子的杂化轨道类型为___________ 。
Ⅱ.铁被称为“第一金属”,铁及其化合物在生产、生活中有广泛用途。
(1) 常作净水剂和补铁剂,SO
常作净水剂和补铁剂,SO 的立体构型是
的立体构型是___________ 。
(2)铁氰化钾 是检验
是检验 的重要试剂。
的重要试剂。
①写出一种与铁氰化钾中配体互为等电子体的极性分子的化学式___________ 。
②铁氰化钾中存在的化学键有___________ (填字母标号)。
A.离子键 B.σ键 C.π键 D.氢键 E。金属键
Ⅲ.锌在工业中有重要作用,也是人体必需的微量元素。硫化锌晶体的构型有多种,其中一种硫化锌的晶胞如图所示。
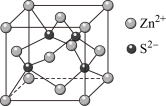
(1)该晶胞中 的配位数为
的配位数为___________ 。
(2)若晶胞参数为 ,则该晶体密度的计算式为
,则该晶体密度的计算式为___________  (用
(用 表示阿伏加德罗常数的值,不用化简)。
表示阿伏加德罗常数的值,不用化简)。
Ⅰ.中国锰矿资源较多,分布广泛。
(1)写出基态锰原子的价电子排布图:
(2)
 用于
用于 分解制氧气的催化剂,
分解制氧气的催化剂, 中氧原子的杂化轨道类型为
中氧原子的杂化轨道类型为Ⅱ.铁被称为“第一金属”,铁及其化合物在生产、生活中有广泛用途。
(1)
 常作净水剂和补铁剂,SO
常作净水剂和补铁剂,SO 的立体构型是
的立体构型是(2)铁氰化钾
 是检验
是检验 的重要试剂。
的重要试剂。①写出一种与铁氰化钾中配体互为等电子体的极性分子的化学式
②铁氰化钾中存在的化学键有
A.离子键 B.σ键 C.π键 D.氢键 E。金属键
Ⅲ.锌在工业中有重要作用,也是人体必需的微量元素。硫化锌晶体的构型有多种,其中一种硫化锌的晶胞如图所示。

(1)该晶胞中
 的配位数为
的配位数为(2)若晶胞参数为
 ,则该晶体密度的计算式为
,则该晶体密度的计算式为 (用
(用 表示阿伏加德罗常数的值,不用化简)。
表示阿伏加德罗常数的值,不用化简)。
您最近一年使用:0次
2021-05-18更新
|
258次组卷
|
2卷引用:新疆新源县第二中学2020-2021学年高二下学期期末联考化学试题
解题方法
8 . (1)CO2和CH3OH分子中C原子的杂化形式分别为__________ 和__________ 。
(2)NH4H2PO4中,P的杂化轨道与O的2p轨道形成_______ 键(填σ或π)。
(3)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是__________ 、__________ 。
(4)H2S的空间构型为________ ;结合等电子体的知识判断离子 的空间构型为
的空间构型为________ 。
(5)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子中心原子的杂化形式为________ 。LiAlH4中,存在______________ (填标号)。
A.离子键 B.σ键 C.π键 D.配位键
(2)NH4H2PO4中,P的杂化轨道与O的2p轨道形成
(3)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是
(4)H2S的空间构型为
 的空间构型为
的空间构型为(5)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子中心原子的杂化形式为
A.离子键 B.σ键 C.π键 D.配位键
您最近一年使用:0次
解题方法
9 . (1)亚铁氰化钾(K4[Fe(CN)6])双称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝)+3KCl,回答问题:
①K4[Fe(CN)6]中的作用力除C、N原子间的共价键外,还有___________ 和_______________ 。
②黄血盐中N原子的杂化方式为____________ ;C、N、O的电负性由大到小的排序为_______________ 。
(2)新型储氢材料是开发利用氢能的研究方向,Ti(BH4)3是一种储氢材料,可由LiBH4和TiCl4反应制得。
①基态Cl原子有_____ 种空间运动状态的电子,属于____ 区(填“s”或“p”或“d”或“f”)
②LiBH4由Li+和 构成,与
构成,与 互为等电子体的分子为
互为等电子体的分子为__________ ,Li、Be、B元素的第一电离能由大到小排列顺序为________ 。
③LiH中,离子半径:Li+_________ H-(填“>”、“=”或“<”)。
④某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
M是_________ (填元素符号)。
①K4[Fe(CN)6]中的作用力除C、N原子间的共价键外,还有
②黄血盐中N原子的杂化方式为
(2)新型储氢材料是开发利用氢能的研究方向,Ti(BH4)3是一种储氢材料,可由LiBH4和TiCl4反应制得。
①基态Cl原子有
②LiBH4由Li+和
 构成,与
构成,与 互为等电子体的分子为
互为等电子体的分子为③LiH中,离子半径:Li+
④某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
| I1/kJ·mol-1 | I2/kJ·mol-1 | I3/kJ·mol-1 | I4/kJ·mol-1 |
| 580 | 1820 | 2750 | 11600 |
M是
您最近一年使用:0次
解题方法
10 . 碳族元素的单质及其化合物在生产、生活中是一类重要物质。请回答下列问题:
(1)硅原子核外有_______ 种不同运动状态的电子,第一电离能介于铝和硅之间的元素的名称为______ 。碳族元素最外层电子排布的通式为_______ 。
(2)下列说法不正确的是___________
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点SiO2>CO2
B.N2与CO互为等电子体,结构相似,化学性质相似
C.稳定性:H2O>H2S,原因是水分子间存在氢键
(3)青蒿素(C15H22O5)的结构如图所示,图中数字标识的五个碳原子的杂化轨道类型为sp2的是___________ ( 填碳原子的标号),组成青蒿素的三种元素的电负性由大到小排序是___________ 。

(4)青蒿素分子中,从成键方式分析氧元素形成的共价键类型有___________ ;从青蒿中提取青蒿素的最佳溶剂是___________ 。
a.乙醇 b.乙醚 c.水
(5)SnO2是一种重要的半导体传感器材料,用来制备灵敏度高的气敏传感器,SnO2与熔融NaOH反应生成Na2SnO3,Na2SnO3中阴离子空间构型为___________ 。
(6)由碳族元素形成的单质和化合物在电池领域非常重要,某含碳元素晶体AMX3(相对分子质量为Mr)是半导体,常用作吸光材料,有钙钛矿的立方结构,其晶胞如图所示。AMX3晶胞中与阳离于(M)距离最近的阴离子(X)形成正八面体结构,则X处于___________ 位置。晶体的晶胞参数为a nm,其晶体密度为 g •cm-3,则阿伏加德罗常数NA的计算表达式为
g •cm-3,则阿伏加德罗常数NA的计算表达式为___________ 。

(1)硅原子核外有
(2)下列说法不正确的是
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点SiO2>CO2
B.N2与CO互为等电子体,结构相似,化学性质相似
C.稳定性:H2O>H2S,原因是水分子间存在氢键
(3)青蒿素(C15H22O5)的结构如图所示,图中数字标识的五个碳原子的杂化轨道类型为sp2的是

(4)青蒿素分子中,从成键方式分析氧元素形成的共价键类型有
a.乙醇 b.乙醚 c.水
(5)SnO2是一种重要的半导体传感器材料,用来制备灵敏度高的气敏传感器,SnO2与熔融NaOH反应生成Na2SnO3,Na2SnO3中阴离子空间构型为
(6)由碳族元素形成的单质和化合物在电池领域非常重要,某含碳元素晶体AMX3(相对分子质量为Mr)是半导体,常用作吸光材料,有钙钛矿的立方结构,其晶胞如图所示。AMX3晶胞中与阳离于(M)距离最近的阴离子(X)形成正八面体结构,则X处于
 g •cm-3,则阿伏加德罗常数NA的计算表达式为
g •cm-3,则阿伏加德罗常数NA的计算表达式为
您最近一年使用:0次



