名校
解题方法
1 . 以物质的量之比3:1的Fe和Al共熔后结晶得Fe3Al晶体,晶胞结构如图一所示,该晶胞为立方晶胞,晶胞参数为a pm。血红素(如图二)是血红蛋白的活性部位,其中心元素是Fe( II)。二者是常见的含铁物质,请回答下列问题。
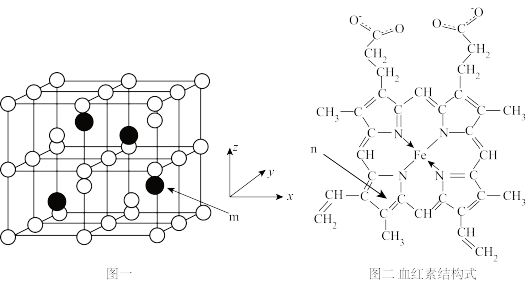
(1)Fe2+的价电子排布式为:_______ 。
(2)血红素分子中非金属元素电负性由大到小的顺序是_______ (用元素符号表示);这些元素形成的简单氢化物中沸点由高到低的顺序是_______ (用化学式表示);C、N、O三种元素形成一种阴离子CNO-,其结构中有_______ 个σ键,_______ 个π键。
(3)有机分子中的闭环平面结构中,成环原子的π电子数等于4n+2(n=1,2,3 )时,该环具有芳香性。n环为血红素中含N最小环,且为平面结构,则N杂化类型为
)时,该环具有芳香性。n环为血红素中含N最小环,且为平面结构,则N杂化类型为_______ ;该环_______ (填“有”、“无”)芳香性。
(4)Fe3Al晶胞中,rA1=b pm, rFe=c pm,则该晶胞的空间利用率为_______ (以含π的代数式表示)。
(5)m原子的原子分数坐标为_______ . ;晶胞内任意两个A1原子之间的距离为_______ pm。
(6)Fe3Al晶体的密度为_______ g·cm-3。

(1)Fe2+的价电子排布式为:
(2)血红素分子中非金属元素电负性由大到小的顺序是
(3)有机分子中的闭环平面结构中,成环原子的π电子数等于4n+2(n=1,2,3
 )时,该环具有芳香性。n环为血红素中含N最小环,且为平面结构,则N杂化类型为
)时,该环具有芳香性。n环为血红素中含N最小环,且为平面结构,则N杂化类型为(4)Fe3Al晶胞中,rA1=b pm, rFe=c pm,则该晶胞的空间利用率为
(5)m原子的原子分数坐标为
(6)Fe3Al晶体的密度为
您最近一年使用:0次
2022-04-29更新
|
631次组卷
|
3卷引用:江西省九江市2021届高三三模考试化学试题
解题方法
2 . 氨、磷、砷、铁、钛等元素及其化合物在现代农业、科技和国防建设中有着许多独特的用途。
I.如 ,是新型锂离子电池的电极材料,可采用
,是新型锂离子电池的电极材料,可采用 、
、 、LiC1和苯胺等作为原料制备。
、LiC1和苯胺等作为原料制备。
(1)基态铁原子的价电子排布式为______ , 中,除氢元素外,其余三种元素第一电离能最大的是
中,除氢元素外,其余三种元素第一电离能最大的是______ (填元素符号)。
(2) 的熔点为306℃,沸点为315℃,
的熔点为306℃,沸点为315℃, 的晶体类型是
的晶体类型是______ 。
(3)苯胺(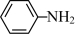 )和
)和 中的N原子杂化方式分别为
中的N原子杂化方式分别为______ 。
(4)苯胺和甲苯相对分子质量接近,但苯胺熔点比甲苯的高,原因是______ 。
II.氨、磷、砷、锑等第ⅤA族元素及其化合物在生产、生活中用途广泛。
(5)白磷在氯气中燃烧可以得到 和
和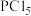 ,其中气态
,其中气态 分子的立体构型为
分子的立体构型为______ 。
(6)研究发现固态 和
和 均为离子晶体,但其结构分别为
均为离子晶体,但其结构分别为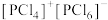 和
和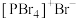 ,分析
,分析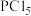 和
和 结构存在差异的原因是
结构存在差异的原因是______ 。
(7)锑酸亚铁晶胞如图所示,其晶胞参数分别为a nm、b nm、c nm, ,则:
,则:
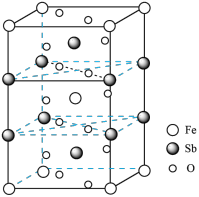
①锑酸亚铁的化学式为______ 。
②晶体的密度为______  (设
(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
I.如
 ,是新型锂离子电池的电极材料,可采用
,是新型锂离子电池的电极材料,可采用 、
、 、LiC1和苯胺等作为原料制备。
、LiC1和苯胺等作为原料制备。(1)基态铁原子的价电子排布式为
 中,除氢元素外,其余三种元素第一电离能最大的是
中,除氢元素外,其余三种元素第一电离能最大的是(2)
 的熔点为306℃,沸点为315℃,
的熔点为306℃,沸点为315℃, 的晶体类型是
的晶体类型是(3)苯胺(
 )和
)和 中的N原子杂化方式分别为
中的N原子杂化方式分别为(4)苯胺和甲苯相对分子质量接近,但苯胺熔点比甲苯的高,原因是
II.氨、磷、砷、锑等第ⅤA族元素及其化合物在生产、生活中用途广泛。
(5)白磷在氯气中燃烧可以得到
 和
和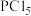 ,其中气态
,其中气态 分子的立体构型为
分子的立体构型为(6)研究发现固态
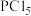 和
和 均为离子晶体,但其结构分别为
均为离子晶体,但其结构分别为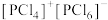 和
和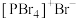 ,分析
,分析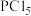 和
和 结构存在差异的原因是
结构存在差异的原因是(7)锑酸亚铁晶胞如图所示,其晶胞参数分别为a nm、b nm、c nm,
 ,则:
,则:
①锑酸亚铁的化学式为
②晶体的密度为
 (设
(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
3 . 镍铬钢俗称不锈钢,在日常生活中应用广泛,含有铁、铬、镍、碳等元素。请回答下列问题:
(1)基态镍原子有___ 个未成对电子,基态Fe3+有___ 种不同运动状态的电子,铬的基态原子核外价层电子排布式为___ 。
(2)配离子[Cr(H2O)6] 3+中,与Cr3+形成配位键的原子是___ (填元素符号),铬的高价化合物可将CH3CH2OH氧化为CH3CHO,CH3CHO中碳原子的杂化方式分别为___ 、___ 。
(3)镍能与CO形成Ni(CO)4,常温下Ni(CO)4是无色液体,易溶于有机溶剂,推测Ni(CO)4是___ 晶体,组成Ni(CO)4的三种元素电负性由大到小的顺序为___ (填元素符号),CO分子中π键与σ键的个数比为___ 。
(4)已知NiO晶体的密度为ρg·cm-3,Ni2-和O3-的半径分别为r1pm和r2pm,阿伏加德罗常数的值为NA,则该晶胞中粒子的体积占晶胞体积的百分率为___ 。

(1)基态镍原子有
(2)配离子[Cr(H2O)6] 3+中,与Cr3+形成配位键的原子是
(3)镍能与CO形成Ni(CO)4,常温下Ni(CO)4是无色液体,易溶于有机溶剂,推测Ni(CO)4是
(4)已知NiO晶体的密度为ρg·cm-3,Ni2-和O3-的半径分别为r1pm和r2pm,阿伏加德罗常数的值为NA,则该晶胞中粒子的体积占晶胞体积的百分率为

您最近一年使用:0次
解题方法
4 . 最近我国科研人员成功攻克了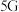 通信芯片制造中关键材料氮化镓
通信芯片制造中关键材料氮化镓 的研制难题.已知元素镓
的研制难题.已知元素镓 与
与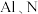 与
与 分别是同主族的元素,请回答下列问题:
分别是同主族的元素,请回答下列问题:
(1)基态 原子的核外电子排布式为
原子的核外电子排布式为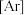
_________ 。
(2)根据元素周期律,元素的电负性
________ (填“大于”或“小于”,下同) ;
;
(3)超高导热绝缘耐高温纳米氮化铝在绝缘材料中应用广泛,氮化铝晶体与金刚石类似,每个铝原子与_______ 个氮原子相连,氮化铝晶体属于________ 晶体。
(4) 是氮的氢化物,中心原子的杂化方式是
是氮的氢化物,中心原子的杂化方式是_________ , 的沸点比
的沸点比 高的原因是
高的原因是_______ 。
(5) 可采用
可采用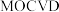 (金属有机物化学气相淀积)技术制得:以合成的三甲基镓为原料,使其与
(金属有机物化学气相淀积)技术制得:以合成的三甲基镓为原料,使其与 发生系列反应得到
发生系列反应得到 和另一种产物,该过程的化学方程式为:
和另一种产物,该过程的化学方程式为:____________________________ 。
(6)原子晶体 的晶胞参数
的晶胞参数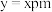 ,它的晶胞结构如下图所示,该晶胞内部存在的共价键数为
,它的晶胞结构如下图所示,该晶胞内部存在的共价键数为_________ ;紧邻的 原子之间的距离为a,紧邻的
原子之间的距离为a,紧邻的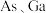 原子之间的距离为b,则
原子之间的距离为b,则
_________ .该晶胞的密度为__________  (阿伏加德罗常数用
(阿伏加德罗常数用 表示)。
表示)。
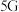 通信芯片制造中关键材料氮化镓
通信芯片制造中关键材料氮化镓 的研制难题.已知元素镓
的研制难题.已知元素镓 与
与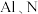 与
与 分别是同主族的元素,请回答下列问题:
分别是同主族的元素,请回答下列问题:(1)基态
 原子的核外电子排布式为
原子的核外电子排布式为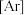
(2)根据元素周期律,元素的电负性

 ;
;(3)超高导热绝缘耐高温纳米氮化铝在绝缘材料中应用广泛,氮化铝晶体与金刚石类似,每个铝原子与
(4)
 是氮的氢化物,中心原子的杂化方式是
是氮的氢化物,中心原子的杂化方式是 的沸点比
的沸点比 高的原因是
高的原因是(5)
 可采用
可采用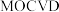 (金属有机物化学气相淀积)技术制得:以合成的三甲基镓为原料,使其与
(金属有机物化学气相淀积)技术制得:以合成的三甲基镓为原料,使其与 发生系列反应得到
发生系列反应得到 和另一种产物,该过程的化学方程式为:
和另一种产物,该过程的化学方程式为:(6)原子晶体
 的晶胞参数
的晶胞参数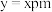 ,它的晶胞结构如下图所示,该晶胞内部存在的共价键数为
,它的晶胞结构如下图所示,该晶胞内部存在的共价键数为 原子之间的距离为a,紧邻的
原子之间的距离为a,紧邻的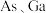 原子之间的距离为b,则
原子之间的距离为b,则
 (阿伏加德罗常数用
(阿伏加德罗常数用 表示)。
表示)。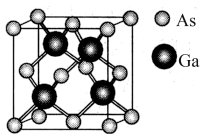
您最近一年使用:0次
解题方法
5 . 下图为钠的某种氧化物D的晶胞和H3BO3(层状结构)的结构示意图。请回答下列问题:


(1)基态硼原子的电子排布图为:_______ 其第一电离能小于Be,原因是_______ 。
(2)三价B易形成多种配离子如[B(OH)4]-、BH 离子[B(OH)4]-的空间构型为
离子[B(OH)4]-的空间构型为_______ 。硼酸显弱酸性与该配离子有关写出硼酸的电离方程式_______ 。写出一种与BH 互为等电子体的分子的电子式
互为等电子体的分子的电子式_______ 。
(3)在硼酸的层状结构中B的杂化类型是_______ 层内存在的作用力有_______ 。
(4)D的化学式为_______ ;晶胞中O原子的配位数为_______ ;已知该晶体F的密度为dg·cm-3,晶胞参数a=_______ nm。


(1)基态硼原子的电子排布图为:
(2)三价B易形成多种配离子如[B(OH)4]-、BH
 离子[B(OH)4]-的空间构型为
离子[B(OH)4]-的空间构型为 互为等电子体的分子的电子式
互为等电子体的分子的电子式(3)在硼酸的层状结构中B的杂化类型是
(4)D的化学式为
您最近一年使用:0次
2021-05-17更新
|
218次组卷
|
2卷引用:江西省南昌市2021届高三5月第三次模拟测试理综化学试题
名校
6 . 乙二胺在电刷镀铜溶液中能起到稳定剂的作用。回答下列问题。
(1)基态Cu原子最高能级组电子数为___________ 个。
(2)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子,如图所示:
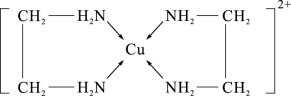
①配离子中含有的化学键类型有___________ 。
②C、N、O的第一电离能由大到小的顺序是___________ 。
③乙二胺分子中氮原子轨道的杂化类型为___________ 。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是___________ 。
(3)温度升高时,NaCl晶体出现缺陷,如图所示(当图中方格内填入Na+时,恰好构成氯化钠晶胞的 ,此时晶体的导电性大大增强,导电性增强的原因
,此时晶体的导电性大大增强,导电性增强的原因___________ ;在氯化钠晶体中两个相邻Cl-之间的间隙小于Na+直径,则___________ 是Na+最可能通过途径迁移到空位处(填图中序号)。
·
(4)某镍白铜合金的立方晶胞结构如图所示。
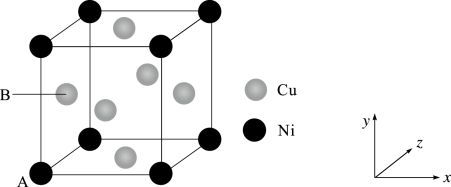
①原子A的原子坐标为(0,0,0),原子B的原子坐标为___________ 。
②若合金的密度为ρg/cm3,Ni原子之间最短距离为___________ nm(列出计算式)。
(1)基态Cu原子最高能级组电子数为
(2)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子,如图所示:

①配离子中含有的化学键类型有
②C、N、O的第一电离能由大到小的顺序是
③乙二胺分子中氮原子轨道的杂化类型为
(3)温度升高时,NaCl晶体出现缺陷,如图所示(当图中方格内填入Na+时,恰好构成氯化钠晶胞的
 ,此时晶体的导电性大大增强,导电性增强的原因
,此时晶体的导电性大大增强,导电性增强的原因·

(4)某镍白铜合金的立方晶胞结构如图所示。

①原子A的原子坐标为(0,0,0),原子B的原子坐标为
②若合金的密度为ρg/cm3,Ni原子之间最短距离为
您最近一年使用:0次
2021-05-07更新
|
985次组卷
|
6卷引用:江西省抚州市临川第一中学2021届高考5月模拟考试理综化学试题
江西省抚州市临川第一中学2021届高考5月模拟考试理综化学试题2022届江西省赣州市高三适应性考试(二模)理综化学试题安徽省宿州市2021届高三下学期第三次模拟考试理综化学试题(已下线)押全国卷理综第35题 物质结构与性质-备战2021年高考化学临考题号押题(已下线)押山东卷第17题 物质结构与性质综合题-备战2021年高考化学临考题号押题(山东卷)2021年山东高考化学试题变式题11-20
解题方法
7 . 非线性光学β相偏硼酸钡(β—BaB2O4,简称BBO)晶体被称为“中国牌”晶体,是大功率激光应用的关键材料。BBO晶体结构如图所示,晶胞参数为a=b=12.532Å,c=12.717,α=β=90°,γ=120°,晶胞内总共含有126个原子。请回答下列问题:

(1)写出B原子的基态价电子排布: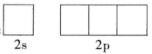
______ 。
(2)B和O的电负性大小顺序是χ(B)______ χ(O)(填“<”或“=”或“>”)。已知石墨中的C—C键长小于金刚石中的C—C键长,则桥O—B键长______ (填“<”或“=”或“>”)端O—B键长。
(3)BBO晶体中[B3O6]3-结构单元中B原子的杂化类型是______ ,桥氧O原子的杂化类型是______ ,大π键类型是______ 。BBO晶体中存在______ (填编号)。
A.共价键 B.σ键 C.π键 D.范德华力
(4)BBO晶胞内含有______ 个O原子,其密度约为______ (保留1位有效数字)。

(1)写出B原子的基态价电子排布:

(2)B和O的电负性大小顺序是χ(B)
(3)BBO晶体中[B3O6]3-结构单元中B原子的杂化类型是
A.共价键 B.σ键 C.π键 D.范德华力
(4)BBO晶胞内含有
您最近一年使用:0次
名校
解题方法
8 . 碳(C)、铜(Cu)、锡(Sn)及其化合物有许多用途。回答下列问题。
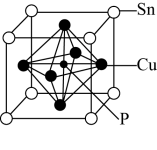
(1)在元素周期表里,锡和碳同族,锡位于第五周期。基态锡原子的最外层电子排布式为_______ 。
(2)磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金。磷化铜与水反应产生有毒的磷化氢(PH3)气体,P、S的第二电离能(I2)的大小关系为I2(P)___ I2(S)(填“>”、“<”或“=”),原因是_ 。PH3分子的热稳定性比NH3______ (填“强”或“弱”)。
(3)1mol苯中含 键的数目为
键的数目为______ 。CH3CH2COOH中C的杂化方式有______ ;
(4)磷青铜晶体的晶胞结构如图所示,该晶体中P原子与最近的Cu原子的核间距为anm,该晶体中P原子位于由铜原子形成的正八面体的空隙中,则该正八面体的边长为__________ nm,该晶体密度为______ g cm-3(用含NA的代数式表示)。
cm-3(用含NA的代数式表示)。

(1)在元素周期表里,锡和碳同族,锡位于第五周期。基态锡原子的最外层电子排布式为
(2)磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金。磷化铜与水反应产生有毒的磷化氢(PH3)气体,P、S的第二电离能(I2)的大小关系为I2(P)
(3)1mol苯中含
 键的数目为
键的数目为(4)磷青铜晶体的晶胞结构如图所示,该晶体中P原子与最近的Cu原子的核间距为anm,该晶体中P原子位于由铜原子形成的正八面体的空隙中,则该正八面体的边长为
 cm-3(用含NA的代数式表示)。
cm-3(用含NA的代数式表示)。
您最近一年使用:0次
2021-04-14更新
|
210次组卷
|
3卷引用:江西省六校2021届高三3月联合考试理综化学试题
名校
解题方法
9 . 氮(N)、磷(P)、砷(As)等VA族元素化合物在研究和生产中有重要用途。如我国科研人员研究发现 As2O3(或写成As4O6,俗称砒霜)对白血病有明显的治疗作用回答下列问题:
(1)As原子的核外电子排布式为____ ;P的第一电离能比S大的原因为____
(2)写出一种与 互为等电子体的粒子
互为等电子体的粒子_ (用化学式表示);(SCN)2分子中 键和
键和 键个数比为
键个数比为___
(3)砒霜剧毒,可用石灰消毒生成 和少量
和少量 ,其中
,其中 中As的杂化方式为
中As的杂化方式为__ , 的空间构型为
的空间构型为___
(4)工业制备铁氧体可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4)等弱碱。
比较上表中氨(NH3)、联氨(N2H4)的熔沸点,解释其高低的主要原因____ 。苯胺分子可看做氨分子中一个氢原子被苯基取代,苯胺分子中的离域 键表示为
键表示为____ 。PH3是一种无色剧毒、有类似大蒜臭味的气体,它与NH3互为等电子体,二者分子中的键角关系为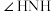
_____ 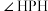 (填“>”或“<”)。
(填“>”或“<”)。
(5)BN的熔点为 ,密度为
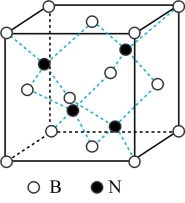
,密度为 ,其晶胞结构如图所示,晶体中一个B原子周围距离最近的N原子有
,其晶胞结构如图所示,晶体中一个B原子周围距离最近的N原子有_______ 个;若原子半径分别为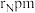 和
和 ,阿伏加德罗常数值为
,阿伏加德罗常数值为 ,则BN晶胞中原子的体积占晶胞体积的百分率为
,则BN晶胞中原子的体积占晶胞体积的百分率为_______ 。
(1)As原子的核外电子排布式为
(2)写出一种与
 互为等电子体的粒子
互为等电子体的粒子 键和
键和 键个数比为
键个数比为(3)砒霜剧毒,可用石灰消毒生成
 和少量
和少量 ,其中
,其中 中As的杂化方式为
中As的杂化方式为 的空间构型为
的空间构型为(4)工业制备铁氧体可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4)等弱碱。
| N2H4 | NH3 | |
| 熔点/℃ | 2 | -77.8 |
| 沸点/℃ | 113.5 | -33.5 |
比较上表中氨(NH3)、联氨(N2H4)的熔沸点,解释其高低的主要原因
 键表示为
键表示为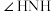
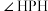 (填“>”或“<”)。
(填“>”或“<”)。 (5)BN的熔点为
 ,密度为
,密度为 ,其晶胞结构如图所示,晶体中一个B原子周围距离最近的N原子有
,其晶胞结构如图所示,晶体中一个B原子周围距离最近的N原子有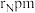 和
和 ,阿伏加德罗常数值为
,阿伏加德罗常数值为 ,则BN晶胞中原子的体积占晶胞体积的百分率为
,则BN晶胞中原子的体积占晶胞体积的百分率为
您最近一年使用:0次
2021-04-14更新
|
206次组卷
|
2卷引用:江西省南昌市第十中学2021届高三下学期第一次月考化学试题
名校
解题方法
10 . (1)分子中含有两个或两个以上中心原子(离子)的配合物称为多核配合物,如图为Co(Ⅱ)双核配合物的内界。

①配合物中每个中心离子的配位数为___________ 。
② 的最高能层电子排布式为
的最高能层电子排布式为___________ 。
③下列状态的钴中,电离最外层一个电子所需能量最大的是___________ (填标号)
A. B.
B. C.
C. D.
D.
(2)二氯甲醛的结构简式为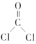 ,已知单键和双键的键角为
,已知单键和双键的键角为 ,单键和单键的键角为
,单键和单键的键角为 ,原因是
,原因是___________ 。
(3)碳酸亚乙酯( )是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因
)是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因___________ 。
(4)化学上有一种见解,认为含氧酸的通式可以写成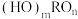 ,如果成酸元素R相同,则n值越大的R正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出
,如果成酸元素R相同,则n值越大的R正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出 ,即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱
,即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱___________ 。
(5)一氧化锰在医药、冶炼上应用广泛,其立方晶胞如图所示。
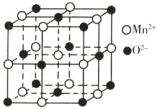
①该晶胞中由 形成的正八面体的空隙数为
形成的正八面体的空隙数为______
②晶胞中距离最近的两个 之间的距离为a pm,MnO晶体的密度为
之间的距离为a pm,MnO晶体的密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为___________ (用含a和 的代数式表示)。
的代数式表示)。

①配合物中每个中心离子的配位数为
②
 的最高能层电子排布式为
的最高能层电子排布式为③下列状态的钴中,电离最外层一个电子所需能量最大的是
A.
 B.
B.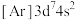 C.
C. D.
D.
(2)二氯甲醛的结构简式为
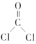 ,已知单键和双键的键角为
,已知单键和双键的键角为 ,单键和单键的键角为
,单键和单键的键角为 ,原因是
,原因是(3)碳酸亚乙酯(
 )是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因
)是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因(4)化学上有一种见解,认为含氧酸的通式可以写成
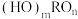 ,如果成酸元素R相同,则n值越大的R正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出
,如果成酸元素R相同,则n值越大的R正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出 ,即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱
,即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱(5)一氧化锰在医药、冶炼上应用广泛,其立方晶胞如图所示。

①该晶胞中由
 形成的正八面体的空隙数为
形成的正八面体的空隙数为②晶胞中距离最近的两个
 之间的距离为a pm,MnO晶体的密度为
之间的距离为a pm,MnO晶体的密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2021-04-10更新
|
569次组卷
|
4卷引用:江西省重点中学协作体2021届高三5月第二次联考理综化学试题



