2021高三·全国·专题练习
解题方法
1 . 根据所学知识回答问题
(1)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是___________ 。Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为___________ ,微粒之间存在的作用力是___________ 。比较下列锗卤化物的熔点和沸点,分析其变化规律及原因___________ 。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。[Ni(NH3)6]SO4中阴离子的立体构型是___________ 。在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为___________ ,提供孤电子对的成键原子是___________ 。氨的沸点___________ (填“高于”或“低于”)膦(PH3),原因是___________ ;氨是___________ 分子(填“极性”或“非极性”),中心原子的轨道杂化类型为___________ 。
(3) AsCl3分子的立体构型为___________ ,其中As的杂化轨道类型为___________ 。
(1)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | −49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。[Ni(NH3)6]SO4中阴离子的立体构型是
(3) AsCl3分子的立体构型为
您最近一年使用:0次
解题方法
2 . 金刚砂( )是重要的工业制品,可由二氧化硅与碳的反应制得:
)是重要的工业制品,可由二氧化硅与碳的反应制得: 。
。 的晶体结构与金刚石的相似,如本章如图所示,其中C原子和
的晶体结构与金刚石的相似,如本章如图所示,其中C原子和 原子的位置是交替的。
原子的位置是交替的。

(1)X是______ ?
(2)写出基态 原子的电子排布式
原子的电子排布式______ ; 中
中 的化合价是
的化合价是______ ?
(3)X可与氧气反应生成Y,判断Y分子的中心原子杂化轨道类型和键角______
(4) 晶体与晶体硅相比,熔点较高的是
晶体与晶体硅相比,熔点较高的是______ 晶体?请分析原因______
(5)在 中最小的环上有
中最小的环上有______ 个原子,已知 键的键能为a
键的键能为a ,理论上分解1
,理论上分解1
 形成气态原子所需要的能量是
形成气态原子所需要的能量是______ 。
 )是重要的工业制品,可由二氧化硅与碳的反应制得:
)是重要的工业制品,可由二氧化硅与碳的反应制得: 。
。 的晶体结构与金刚石的相似,如本章如图所示,其中C原子和
的晶体结构与金刚石的相似,如本章如图所示,其中C原子和 原子的位置是交替的。
原子的位置是交替的。
(1)X是
(2)写出基态
 原子的电子排布式
原子的电子排布式 中
中 的化合价是
的化合价是(3)X可与氧气反应生成Y,判断Y分子的中心原子杂化轨道类型和键角
(4)
 晶体与晶体硅相比,熔点较高的是
晶体与晶体硅相比,熔点较高的是(5)在
 中最小的环上有
中最小的环上有 键的键能为a
键的键能为a ,理论上分解1
,理论上分解1
 形成气态原子所需要的能量是
形成气态原子所需要的能量是
您最近一年使用:0次
名校
解题方法
3 . 中国科学家合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料 ,并获得该化合物的
,并获得该化合物的 器件,该结果有望为白光发射的设计和应用提供新的有效策略。
器件,该结果有望为白光发射的设计和应用提供新的有效策略。
(1)已知 与
与 同族,基态
同族,基态 原子价层电子的运动状态有
原子价层电子的运动状态有_________ 种,基态 原子的电子排布式不能表示为
原子的电子排布式不能表示为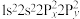 ,因为这违背了
,因为这违背了_________ (填选项)。
A.能量最低原理 B.泡利不相容原理 C.洪特规则
(2) 中硼原子的杂化轨道类型为
中硼原子的杂化轨道类型为_________ 。 中,
中, 与
与 之间不存在的化学键是
之间不存在的化学键是_________ (填选项)。
A. 键 B.
键 B.  键 C. 配位键 D. 极性键
键 C. 配位键 D. 极性键
(3)碳酸钡、碳酸镁分解得到的金属氧化物中,熔点较低的是_________ ,其原因是__________________ 。
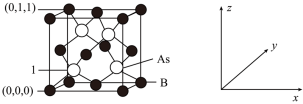
(4)超高热导率半导体材料砷化硼( )的晶胞结构如图所示,则1号砷原子的原子坐标为
)的晶胞结构如图所示,则1号砷原子的原子坐标为_________ 。已知阿伏加德罗常数的值为 ,若晶胞中
,若晶胞中 原子到
原子到 原子最近距离为
原子最近距离为 ,则该晶体的密度为
,则该晶体的密度为_________  (列出含
(列出含 、
、 的计算式即可)。
的计算式即可)。
 ,并获得该化合物的
,并获得该化合物的 器件,该结果有望为白光发射的设计和应用提供新的有效策略。
器件,该结果有望为白光发射的设计和应用提供新的有效策略。(1)已知
 与
与 同族,基态
同族,基态 原子价层电子的运动状态有
原子价层电子的运动状态有 原子的电子排布式不能表示为
原子的电子排布式不能表示为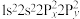 ,因为这违背了
,因为这违背了A.能量最低原理 B.泡利不相容原理 C.洪特规则
(2)
 中硼原子的杂化轨道类型为
中硼原子的杂化轨道类型为 中,
中, 与
与 之间不存在的化学键是
之间不存在的化学键是A.
 键 B.
键 B.  键 C. 配位键 D. 极性键
键 C. 配位键 D. 极性键(3)碳酸钡、碳酸镁分解得到的金属氧化物中,熔点较低的是
(4)超高热导率半导体材料砷化硼(
 )的晶胞结构如图所示,则1号砷原子的原子坐标为
)的晶胞结构如图所示,则1号砷原子的原子坐标为 ,若晶胞中
,若晶胞中 原子到
原子到 原子最近距离为
原子最近距离为 ,则该晶体的密度为
,则该晶体的密度为 (列出含
(列出含 、
、 的计算式即可)。
的计算式即可)。
您最近一年使用:0次
2022-11-13更新
|
434次组卷
|
6卷引用:山西省太原市第五中学2021-2022学年上学期高三第四次模块诊断化学试题
山西省太原市第五中学2021-2022学年上学期高三第四次模块诊断化学试题(已下线)第十一单元 物质结构与性质(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)一轮巩固卷7-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)广东省广州市广大附中、广外、铁一中学三校2022届高三三模联考化学试题(已下线)化学(全国乙卷单科卷)-学易金卷:2023年高考第一次模拟考试卷福建永春一中、培元中学、季延中学、石光中学2022-2023学年高三上学期期中考联考化学试题
2022高三·全国·专题练习
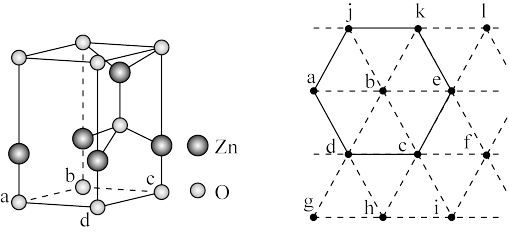
4 . 以 、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
(1)基态O原子的电子排布式_______ ,其中未成对电子有_______ 个。
(2)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是_______ 。
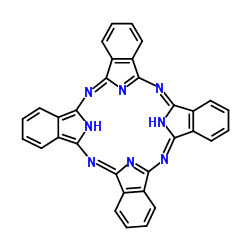
(3)酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取_______ 杂化。邻苯二甲酸酐( )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺(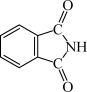 )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是_______ 。
(4)金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为_______ 。
(5)ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是_______ 。
(6)下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。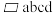 为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面_______ 、_______ 。
 、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:(1)基态O原子的电子排布式
(2)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是
(3)酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取
 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺( )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是
(4)金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为
(5)ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是
(6)下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。
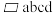 为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
您最近一年使用:0次
2022-07-04更新
|
9156次组卷
|
11卷引用:专题九 物质结构与性质-实战高考·二轮复习核心突破
(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破(已下线)专题17 物质结构与性质(综合题)-2022年高考真题模拟题分项汇编(已下线)第19练 物质结构与性质综合题难点突破-2022年【暑假分层作业】高二化学(2023届一轮复习通用)山西省晋中市祁县中学2022-2023学年高三上学期10月月考化学试题(已下线)热点情景汇编-专题十四 结构性质中的新材料(已下线)【知识图鉴】单元讲练测选择性必修2第三章03单元测(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)专题17 物质结构与性质综合题-2023年高考化学真题题源解密(新高考专用)2022年海南省高考真题化学试题(已下线)2022年海南省高考真题变式题15-19
2021·全国·模拟预测
5 . 元素及其化合物在生产、生活中用途广泛。
(1)①P4S3常用于制造火柴,P和S的第一电离能较大的是___________ 。
②As4S4俗称雄黄,其中基态As原子的核外电子排布式为[Ar]___________ ,有___________ 个未成对电子。
③NH3、PH3、AsH3中沸点最高的是___________ ,其主要原因是___________ 。
(2)①Fe、Co、Ni能与Cl2反应,其中Co和Ni均生成二氯化物,由此推断FeCl3、CoCl3和Cl2的氧化性由强到弱的顺序为_____ 。
②研究发现固态PCl5和PBr5均为离子晶体,但其结构分别为[PCl4]+[PCl6]-和[PBr4]+Br-,分析PCl5和PBr5结构存在差异的原因是____ 。
(3)锑酸亚铁晶胞如图所示,其晶胞参数分别为anm、bnm、cnm,α=β=γ=90°,则:
①锑酸亚铁的化学式为___________ 。
②晶体的密度为___________ g•cm-3.(设NA为阿伏加德罗常数的值)

(1)①P4S3常用于制造火柴,P和S的第一电离能较大的是
②As4S4俗称雄黄,其中基态As原子的核外电子排布式为[Ar]
③NH3、PH3、AsH3中沸点最高的是
(2)①Fe、Co、Ni能与Cl2反应,其中Co和Ni均生成二氯化物,由此推断FeCl3、CoCl3和Cl2的氧化性由强到弱的顺序为
②研究发现固态PCl5和PBr5均为离子晶体,但其结构分别为[PCl4]+[PCl6]-和[PBr4]+Br-,分析PCl5和PBr5结构存在差异的原因是
(3)锑酸亚铁晶胞如图所示,其晶胞参数分别为anm、bnm、cnm,α=β=γ=90°,则:
①锑酸亚铁的化学式为
②晶体的密度为

您最近一年使用:0次
2021高三·全国·专题练习
解题方法
6 . 我国科学家借助自主研制的新型钨钴铁合金催化剂攻克了单壁碳纳米管结构的可控制备难题。海底金属软泥是在海底覆盖着的一层红棕色沉积物,蕴藏着大量的金属资源, 含有钨、铁、锰、锌、钴等金属元素。
(1)基态钴原子的价电子排布图为___________ 。单壁碳纳米管可看作石墨烯沿一定方向卷曲而成的空心圆柱体,其碳原子的杂化方式为___________ 。
(2)纳米结构氧化钴可在室温下将甲硫醛(CH2S)完全催化氧化,甲硫醛分子属___________ (填“极性”或“非极性”)分子,其中心原子的VSEPR模型名称为___________ 。
(3)六羰基钨[W(CO)6]的熔点为172 ℃,是一种重要的无机金属配合物,可溶于大多数有机溶剂。三种组成元素的电负性由大到小的顺序为___________ (用元素符号表示)。配体CO中与W形成配位键的原子是C而不是O,原因是___________ 。
(4)多原子分子中各原子若在同一平面内,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”。下列物质中存在“离域π键”的是___________(填字母)。
(1)基态钴原子的价电子排布图为
(2)纳米结构氧化钴可在室温下将甲硫醛(CH2S)完全催化氧化,甲硫醛分子属
(3)六羰基钨[W(CO)6]的熔点为172 ℃,是一种重要的无机金属配合物,可溶于大多数有机溶剂。三种组成元素的电负性由大到小的顺序为
(4)多原子分子中各原子若在同一平面内,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”。下列物质中存在“离域π键”的是___________(填字母)。
| A.苯 | B.二氧化硫 |
| C.四氯化碳 | D.环己烷 |
您最近一年使用:0次
2021高三·全国·专题练习
解题方法
7 . 铬的同位素有 Cr、
Cr、 Cr、
Cr、 Cr、
Cr、 Cr。铬及其化合物在生活、生产中有广泛应用。回答下列问题:
Cr。铬及其化合物在生活、生产中有广泛应用。回答下列问题:
(1)基态 Cr的价层电子排布图为
Cr的价层电子排布图为___________ 。
(2)交警用“酒精仪”查酒驾,其化学反应原理为2K2Cr2O7+3CH3CH2OH+8H2SO4―→3CH3COOH+2Cr2(SO4)3+2K2SO4+11H2O。
①CH3CH2OH、CH3COOH的沸点高于对应的CH3OCH3(二甲醚)、HCOOCH3(甲酸甲酯),主要原因是___________ 。
②CH3COOH分子中碳原子的杂化类型是___________ ;CH3COOH分子中σ键和π键的数目之比为___________ 。
③K2SO4晶体中阴离子的立体构型是___________ 。
该反应中,只含极性键的极性分子有___________ (填分子式)。
(3)CrF3晶体、CrBr3晶体的熔点分别为1 100 ℃以上、79 ℃,其可能的原因是___________ 。
(4)晶体铬的晶胞结构如图所示,其堆积模型为___________ ;铬原子的配位数为___________ 。

 Cr、
Cr、 Cr、
Cr、 Cr、
Cr、 Cr。铬及其化合物在生活、生产中有广泛应用。回答下列问题:
Cr。铬及其化合物在生活、生产中有广泛应用。回答下列问题:(1)基态
 Cr的价层电子排布图为
Cr的价层电子排布图为(2)交警用“酒精仪”查酒驾,其化学反应原理为2K2Cr2O7+3CH3CH2OH+8H2SO4―→3CH3COOH+2Cr2(SO4)3+2K2SO4+11H2O。
①CH3CH2OH、CH3COOH的沸点高于对应的CH3OCH3(二甲醚)、HCOOCH3(甲酸甲酯),主要原因是
②CH3COOH分子中碳原子的杂化类型是
③K2SO4晶体中阴离子的立体构型是
该反应中,只含极性键的极性分子有
(3)CrF3晶体、CrBr3晶体的熔点分别为1 100 ℃以上、79 ℃,其可能的原因是
(4)晶体铬的晶胞结构如图所示,其堆积模型为

您最近一年使用:0次
2021高三·全国·专题练习
解题方法
8 . 回答下列问题
(1)火箭使用的推进剂燃料由N、H两种元素组成,且原子个数N(N)∶N(H)=1∶2,其水溶液显碱性,则该物质中N原子的杂化方式为___________ 。
(2)笑气(N2O)曾被用作麻醉剂,但过度吸食会导致身体机能紊乱。预测N2O的结构式为___________ 。
(3)在电解冶炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2A+3CO2↑+9H2O。

①冰晶石的化学式为___________ 。
②冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示, 位于大立方体的顶点和面心,
位于大立方体的顶点和面心, 位于大立方体的12条棱的中点和8个小立方体的体心,
位于大立方体的12条棱的中点和8个小立方体的体心, 位于大立方体的体心,那么大立方体的体心处所代表的微粒是
位于大立方体的体心,那么大立方体的体心处所代表的微粒是___________ (填微粒符号)。
③冰晶石溶液中不存在的微粒间作用力有___________ (填字母)。
A.离子键 B.共价键 C.配位键 D.金属键 E.范德华力 F.氢键
④Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示。若已知Al的原子半径为d cm,NA代表阿伏加德罗常数的值,Al的相对原子质量为M,则晶胞中Al原子的配位数为___________ 。

(4)配合物Fe(CO)5的熔点为-20 ℃,沸点为103 ℃,可用于制备纯铁。Fe(CO)5的结构如图戊所示:
①Fe(CO)5晶体类型属于___________ 晶体。
②关于Fe(CO)5,下列说法正确的是___________ 。
A.Fe(CO)5是非极性分子,CO是极性分子
B.Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1 mol Fe(CO)5含有10 mol配位键
D.反应Fe(CO)5=Fe+5CO↑没有新化学键生成
(1)火箭使用的推进剂燃料由N、H两种元素组成,且原子个数N(N)∶N(H)=1∶2,其水溶液显碱性,则该物质中N原子的杂化方式为
(2)笑气(N2O)曾被用作麻醉剂,但过度吸食会导致身体机能紊乱。预测N2O的结构式为
(3)在电解冶炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2A+3CO2↑+9H2O。

①冰晶石的化学式为
②冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,
 位于大立方体的顶点和面心,
位于大立方体的顶点和面心, 位于大立方体的12条棱的中点和8个小立方体的体心,
位于大立方体的12条棱的中点和8个小立方体的体心, 位于大立方体的体心,那么大立方体的体心处所代表的微粒是
位于大立方体的体心,那么大立方体的体心处所代表的微粒是③冰晶石溶液中不存在的微粒间作用力有
A.离子键 B.共价键 C.配位键 D.金属键 E.范德华力 F.氢键
④Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示。若已知Al的原子半径为d cm,NA代表阿伏加德罗常数的值,Al的相对原子质量为M,则晶胞中Al原子的配位数为

(4)配合物Fe(CO)5的熔点为-20 ℃,沸点为103 ℃,可用于制备纯铁。Fe(CO)5的结构如图戊所示:
①Fe(CO)5晶体类型属于
②关于Fe(CO)5,下列说法正确的是
A.Fe(CO)5是非极性分子,CO是极性分子
B.Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1 mol Fe(CO)5含有10 mol配位键
D.反应Fe(CO)5=Fe+5CO↑没有新化学键生成
您最近一年使用:0次
名校
解题方法
9 . ⅢA族与ⅤA族元素及其化合物具有众多优良特性,可用于制作航天器等耐高温设备。回答下列问题。
(1)Al原子中电子占据的最高能层符号为_______ ,第三周期元素中第一电离能介于Al和P有_______ 种
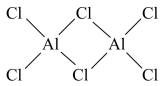
(2)AlCl3在气态时可以发生二聚,其分子式为Al2Cl6,其二聚体结构如图,请在图中以“→”表示该结构中存在的配位键。其中Cl-Al-Cl键角的大小情况是AlCl3_______ Al2Cl6(填“<”、“>”或“=”下同)原因为_______ 。
(3)咪唑结构为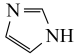 ,N原子的杂化类型为
,N原子的杂化类型为_______ ,分子中的大π键可以用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则咪唑中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则咪唑中的大π键可表示为_______ 。
(4)噻唑结构与咪唑很相似,结构为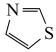 ,噻唑的熔沸点
,噻唑的熔沸点_______ 咪唑,原因是_______ 。
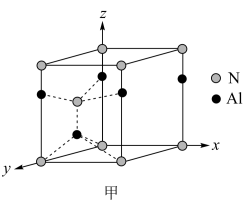
(5)氮化铝晶体是第三代半导体材料的典型代表之一,属于六方晶系,其晶胞结构如图甲所示,Al原子位于氮原子形成的_______ 空隙(填“正四面体”或“正八面体”)。已知晶胞的密度为ρ g·cm-3,两种原子半径分别为rN nm和rAl nm,阿伏加德罗常数值为NA,则该晶胞中原子的体积占晶胞体积的百分率为_______ 。(用含ρ、rN 、rAl和NA的代数式表示)
(1)Al原子中电子占据的最高能层符号为
(2)AlCl3在气态时可以发生二聚,其分子式为Al2Cl6,其二聚体结构如图,请在图中以“→”表示该结构中存在的配位键。其中Cl-Al-Cl键角的大小情况是AlCl3

(3)咪唑结构为
 ,N原子的杂化类型为
,N原子的杂化类型为 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则咪唑中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则咪唑中的大π键可表示为(4)噻唑结构与咪唑很相似,结构为
 ,噻唑的熔沸点
,噻唑的熔沸点(5)氮化铝晶体是第三代半导体材料的典型代表之一,属于六方晶系,其晶胞结构如图甲所示,Al原子位于氮原子形成的

您最近一年使用:0次
名校
解题方法
10 . 氮( )、磷(
)、磷( )、砷(
)、砷( )为第ⅥA族元素,该族元素的化合物在研究和生产中有着许多重要用途。
)为第ⅥA族元素,该族元素的化合物在研究和生产中有着许多重要用途。
(1)基态 原子中,核外电子占据最高能层的符号是
原子中,核外电子占据最高能层的符号是___________ ,占据该能层电子的电子云轮廓图形状为___________ 。
(2)化合物 中
中 原子的
原子的 构型为
构型为___________ ,该化合物能溶于水,其主要原因是___________ , 与盐酸反应生成
与盐酸反应生成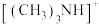 ,该过程新生成的化学键类型为
,该过程新生成的化学键类型为___________ 。
(3)氮化硼( )和磷化硼(
)和磷化硼( )都是受到高度关注的耐磨涂料,它们的结构相似,但是氮化硼晶体的熔点要比磷化硼晶体高,其原因是
)都是受到高度关注的耐磨涂料,它们的结构相似,但是氮化硼晶体的熔点要比磷化硼晶体高,其原因是___________ ;
(4)磷化硼晶体的晶胞如图所示。
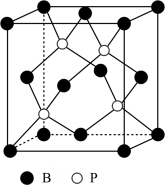
①在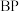 晶胞中键角为
晶胞中键角为___________ , 的堆积方式为
的堆积方式为___________ 。
②磷化硼(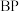 )晶体中“一般共价键”与配位键的数目之比为
)晶体中“一般共价键”与配位键的数目之比为___________ 。
③磷化硼晶胞密度为 ,则磷化硼中硼原子和磷原子之间的最近的核间距离为
,则磷化硼中硼原子和磷原子之间的最近的核间距离为___________  。(只要求列算式,阿伏加德罗常数的数值为
。(只要求列算式,阿伏加德罗常数的数值为 )。
)。
 )、磷(
)、磷( )、砷(
)、砷( )为第ⅥA族元素,该族元素的化合物在研究和生产中有着许多重要用途。
)为第ⅥA族元素,该族元素的化合物在研究和生产中有着许多重要用途。(1)基态
 原子中,核外电子占据最高能层的符号是
原子中,核外电子占据最高能层的符号是(2)化合物
 中
中 原子的
原子的 构型为
构型为 与盐酸反应生成
与盐酸反应生成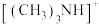 ,该过程新生成的化学键类型为
,该过程新生成的化学键类型为(3)氮化硼(
 )和磷化硼(
)和磷化硼(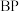 )都是受到高度关注的耐磨涂料,它们的结构相似,但是氮化硼晶体的熔点要比磷化硼晶体高,其原因是
)都是受到高度关注的耐磨涂料,它们的结构相似,但是氮化硼晶体的熔点要比磷化硼晶体高,其原因是(4)磷化硼晶体的晶胞如图所示。

①在
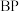 晶胞中键角为
晶胞中键角为 的堆积方式为
的堆积方式为②磷化硼(
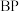 )晶体中“一般共价键”与配位键的数目之比为
)晶体中“一般共价键”与配位键的数目之比为③磷化硼晶胞密度为
 ,则磷化硼中硼原子和磷原子之间的最近的核间距离为
,则磷化硼中硼原子和磷原子之间的最近的核间距离为 。(只要求列算式,阿伏加德罗常数的数值为
。(只要求列算式,阿伏加德罗常数的数值为 )。
)。
您最近一年使用:0次



