解题方法
1 . 碳是一种很常见的元素,它能形成多种物质。
(1)碳与铁可以形成合金。
①基态碳原子的价电子排布图(即价电子轨道表示式)为___________ ;基态铁原子核外共有___________ 种不同空间运动状态的电子。
②从结构角度分析, 较
较 稳定的原因是
稳定的原因是___________ 。
(2)碳与其他元素一起能形成多种酸或酸根。
① 的空间构型是
的空间构型是___________ 。
②类卤素 分子中σ键与π键的数目比
分子中σ键与π键的数目比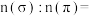
___________ 。 对应的酸有两种,理论上硫氰酸(
对应的酸有两种,理论上硫氰酸( )的沸点低于异硫氰酸(
)的沸点低于异硫氰酸(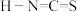 )的沸点,其原因是
)的沸点,其原因是___________ 。
(3)碳也可以形成多种有机化合物。
①有机物尿素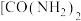 。尿素中C、N、O第一电离能大小顺序为
。尿素中C、N、O第一电离能大小顺序为___________ 。
②吡咯(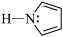 )结构中N原子的杂化轨道类型为
)结构中N原子的杂化轨道类型为___________ ;分子中的大π键可以用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为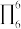 ),则吡咯中的大π键应表示为
),则吡咯中的大π键应表示为___________ 。
(4)碳还能形成多种同素异形体,如石墨、金刚石等。
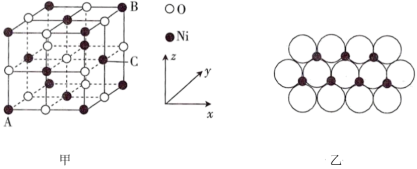
①石墨具有平面层状结构,同一层中的原子构成许许多多的正六边形,它与熔融的K单质相互作用,形成某种青铜色的物质(其中的元素K用“●”表示),原子分布如图甲所示,该物质的化学式为___________ 。
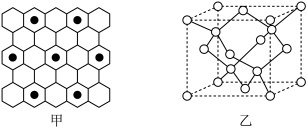
(图中的○表示碳形成的正四面体结构 )
)
②2017年,中外科学家团队共同合成了碳的一种新型同素异形体:T-碳。T-碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代,可形成碳的一种新型三维立方晶体结构——T-碳(如图乙)。已知T-碳密度为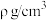 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则T-碳的晶胞参数
,则T-碳的晶胞参数
___________ pm(写出表达式即可)。
(1)碳与铁可以形成合金。
①基态碳原子的价电子排布图(即价电子轨道表示式)为
②从结构角度分析,
 较
较 稳定的原因是
稳定的原因是(2)碳与其他元素一起能形成多种酸或酸根。
①
 的空间构型是
的空间构型是②类卤素
 分子中σ键与π键的数目比
分子中σ键与π键的数目比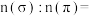
 对应的酸有两种,理论上硫氰酸(
对应的酸有两种,理论上硫氰酸( )的沸点低于异硫氰酸(
)的沸点低于异硫氰酸(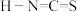 )的沸点,其原因是
)的沸点,其原因是(3)碳也可以形成多种有机化合物。
①有机物尿素
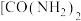 。尿素中C、N、O第一电离能大小顺序为
。尿素中C、N、O第一电离能大小顺序为②吡咯(
 )结构中N原子的杂化轨道类型为
)结构中N原子的杂化轨道类型为 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为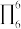 ),则吡咯中的大π键应表示为
),则吡咯中的大π键应表示为(4)碳还能形成多种同素异形体,如石墨、金刚石等。
①石墨具有平面层状结构,同一层中的原子构成许许多多的正六边形,它与熔融的K单质相互作用,形成某种青铜色的物质(其中的元素K用“●”表示),原子分布如图甲所示,该物质的化学式为

(图中的○表示碳形成的正四面体结构
 )
)②2017年,中外科学家团队共同合成了碳的一种新型同素异形体:T-碳。T-碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代,可形成碳的一种新型三维立方晶体结构——T-碳(如图乙)。已知T-碳密度为
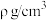 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则T-碳的晶胞参数
,则T-碳的晶胞参数
您最近一年使用:0次
名校
解题方法
2 . 某催化剂材料中包含了Fe、Cr、Ni、C等多种元素。回答下列问题:
(1)基态铁原子的价电子排布式为_______ 。
(2)与Cr同周期且基态原子最外层电子数相同的元素,可能位于周期表中的_______ 区。
(3)实验室常用KSCN溶液、苯酚(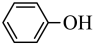 )检验Fe,其中N、O、S的第一电离能由大到小的顺序为
)检验Fe,其中N、O、S的第一电离能由大到小的顺序为_______ (用元素符号表示),苯酚中碳原子的杂化轨道类型为_______ 。
(4)铁元素能与CO形成五羰基铁[Fe(CO)5],Fe(CO)5可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含_______ molσ键,与CO互为等电子体的一种离子的化学式为_______ 。
(5)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的_______ 空隙和_______ 空隙(填几何空间构型);若C60分子的坐标参数分别为A(0,0,0),B( ,0,
,0, ),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为
),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为_______ 。
(6)Ni可以形成多种氧化物,其中一种NiaO晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0.88,且晶体中的Ni分别为Ni2+、Ni3+,则晶体中Ni2+与Ni3+的最简整数比为_______ ,晶胞参数为428pm,则晶体密度为_______ g/cm3(NA表示阿伏伽德罗常数的值,列出表达式)。

(1)基态铁原子的价电子排布式为
(2)与Cr同周期且基态原子最外层电子数相同的元素,可能位于周期表中的
(3)实验室常用KSCN溶液、苯酚(
 )检验Fe,其中N、O、S的第一电离能由大到小的顺序为
)检验Fe,其中N、O、S的第一电离能由大到小的顺序为(4)铁元素能与CO形成五羰基铁[Fe(CO)5],Fe(CO)5可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含
(5)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的
 ,0,
,0, ),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为
),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为(6)Ni可以形成多种氧化物,其中一种NiaO晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0.88,且晶体中的Ni分别为Ni2+、Ni3+,则晶体中Ni2+与Ni3+的最简整数比为

您最近一年使用:0次
解题方法
3 . “中国紫”——硅酸铜钡( ),其合成原料为
),其合成原料为 、孔雀石[
、孔雀石[ ]和砂子(
]和砂子( )。回答下列问题:
)。回答下列问题:
(1)基态Ba原子的价电子排布式为_______ 。
(2) 常用作光导纤维,在生产和生活中有广泛的用途。
常用作光导纤维,在生产和生活中有广泛的用途。
① 属于
属于_______ 晶体,在 晶体中,硅原子的杂化类型为
晶体中,硅原子的杂化类型为_______ , 的空间构型为
的空间构型为_______ 。
②1mol 晶体中,Si-O键的数目为
晶体中,Si-O键的数目为_______ 。
(3) 不溶于水,但可溶于浓氨水,反应的化学方程式为
不溶于水,但可溶于浓氨水,反应的化学方程式为
 。
。
①氨水中存在的化学键有_______ (填标号)。
A.极性键 B.非极性键 C.氢键 D.σ键 E.π键
② 中配体是
中配体是_______ ,所含元素中电负性最小的非金属元素是_______ (填元素符号)。
(4) 的熔点比
的熔点比 的
的_______ (填“高”或“低”),原因是_______ 。
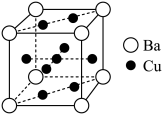
(5)Cu和Ba形成的某种合金的晶胞结构如图所示,设 为阿伏加德罗常数的值,晶胞参数为a nm,则该晶体的密度
为阿伏加德罗常数的值,晶胞参数为a nm,则该晶体的密度
_______ (列出计算式) 。
。
 ),其合成原料为
),其合成原料为 、孔雀石[
、孔雀石[ ]和砂子(
]和砂子( )。回答下列问题:
)。回答下列问题:(1)基态Ba原子的价电子排布式为
(2)
 常用作光导纤维,在生产和生活中有广泛的用途。
常用作光导纤维,在生产和生活中有广泛的用途。①
 属于
属于 晶体中,硅原子的杂化类型为
晶体中,硅原子的杂化类型为 的空间构型为
的空间构型为②1mol
 晶体中,Si-O键的数目为
晶体中,Si-O键的数目为(3)
 不溶于水,但可溶于浓氨水,反应的化学方程式为
不溶于水,但可溶于浓氨水,反应的化学方程式为
 。
。①氨水中存在的化学键有
A.极性键 B.非极性键 C.氢键 D.σ键 E.π键
②
 中配体是
中配体是(4)
 的熔点比
的熔点比 的
的(5)Cu和Ba形成的某种合金的晶胞结构如图所示,设
 为阿伏加德罗常数的值,晶胞参数为a nm,则该晶体的密度
为阿伏加德罗常数的值,晶胞参数为a nm,则该晶体的密度
 。
。
您最近一年使用:0次
名校
解题方法
4 . 元素周期表第IIIA族包括B、Al、Ga等元素,它们参与形成的化合物有重要研究和应用价值,回答下列问题:
(1)基态Ga原子的价电子排布式为________ ;Ga、As和Se的第一电离能由小到大的顺序是________ 。
(2)实验发现,氯化铝溶于非极性溶剂中或处于熔融状态、蒸气状态时,都以二聚态(A12C16)的形式存在。其球棍模型如图甲所示。

①该分子中A1原子采取________ 杂化。
②Al2Cl6与过量NaOH溶液反应生成Na[A1(OH)4],[A1(OH)4]-中存在的化学键有________ (序号)。
A.离子键 B.极性共价键 C.金属键 D.非极性共价键 E.配位键 F.σ键 G.氢键
(3)更高温度下Al2Cl6二聚体离解成A1Cl3,BF3是AlCl3的一种等电子体,根据价层电子对互斥理论判断BF3的分子构型为________ ;写出BF3的一种带负电荷的等电子体粒子:________ 。
(4)GaN是第三代半导体材料的研究热点,在干燥的NH3气流中焙烧磨细的GaAs可制得GaN。GaN熔点约为1500℃,GaAs熔点为1238℃,GaN熔点高于GaAs的原因是________ 。
(5)GaN的其中一种晶胞结构如图乙所示,与金刚石的晶体结构高度相似。该晶胞中Ga原子处于N原子形成的________ (填“正四面体形”或“正八面体形”)空隙。已知GaN的密度为ρg•cm-3,Ga和N的摩尔质量分别为ag•moL-1和bg•moL-1,NA为阿伏加德罗常数,则GaN晶胞的边长为________ pm(列出表达式)。

(1)基态Ga原子的价电子排布式为
(2)实验发现,氯化铝溶于非极性溶剂中或处于熔融状态、蒸气状态时,都以二聚态(A12C16)的形式存在。其球棍模型如图甲所示。

①该分子中A1原子采取
②Al2Cl6与过量NaOH溶液反应生成Na[A1(OH)4],[A1(OH)4]-中存在的化学键有
A.离子键 B.极性共价键 C.金属键 D.非极性共价键 E.配位键 F.σ键 G.氢键
(3)更高温度下Al2Cl6二聚体离解成A1Cl3,BF3是AlCl3的一种等电子体,根据价层电子对互斥理论判断BF3的分子构型为
(4)GaN是第三代半导体材料的研究热点,在干燥的NH3气流中焙烧磨细的GaAs可制得GaN。GaN熔点约为1500℃,GaAs熔点为1238℃,GaN熔点高于GaAs的原因是
(5)GaN的其中一种晶胞结构如图乙所示,与金刚石的晶体结构高度相似。该晶胞中Ga原子处于N原子形成的

您最近一年使用:0次
解题方法
5 . 离子液体被认为是21世纪理想的绿色溶剂,是指室温或者接近室温时呈液态,而本身由阴、阳离子构成的化合物。氯代1-丁基-3-甲基咪唑离子液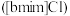 可以与
可以与 混合形成离子液体;
混合形成离子液体; 也可以转化成其他离子液体,下图是
也可以转化成其他离子液体,下图是 与
与 离子交换反应合成离子液体
离子交换反应合成离子液体 的流程:
的流程:

(1)请画出基态Ga原子的价电子排布图_____ ;同周期元素中基态原子未成对电子数与硼(B)原子相同的有_____ (填元素符号)。
(2)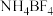 中N原子的杂化方式为
中N原子的杂化方式为_____ ,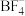 的空间构型为
的空间构型为_____ , 中几种元素电负性由大到小的顺序为
中几种元素电负性由大到小的顺序为_____ 。
(3)已知分子中的大 键可以用
键可以用 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表大
键的原子数,n代表大 键中的电子数,则
键中的电子数,则 中大
中大 键可以表示为
键可以表示为_____ 。
(4) 熔点为
熔点为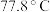 ,则
,则 的晶体类型为
的晶体类型为_____ , 和
和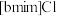 混合形成离子液体的过程中会存在以下转化:
混合形成离子液体的过程中会存在以下转化: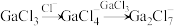 ,请画出
,请画出 的结构式
的结构式_____ 。
(5)某种 的晶胞结构如图所示,O2−以六方最密方式堆积,
的晶胞结构如图所示,O2−以六方最密方式堆积, 在其八面体空隙中(注:未全部标出,如:
在其八面体空隙中(注:未全部标出,如: 在1、2、3、4、5、6构成的八面体体心)。
在1、2、3、4、5、6构成的八面体体心)。
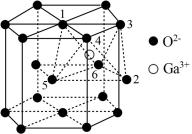
①该晶胞中O2−的配位数为_____ 。
②已知氧离子半径为acm,晶胞的高为bcm,NA代表阿伏加德罗常数的值,该晶体的密度为_____ g·cm−3(用含 和NA的代数式表示)。
和NA的代数式表示)。
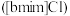 可以与
可以与 混合形成离子液体;
混合形成离子液体; 也可以转化成其他离子液体,下图是
也可以转化成其他离子液体,下图是 与
与 离子交换反应合成离子液体
离子交换反应合成离子液体 的流程:
的流程:
(1)请画出基态Ga原子的价电子排布图
(2)
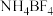 中N原子的杂化方式为
中N原子的杂化方式为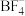 的空间构型为
的空间构型为 中几种元素电负性由大到小的顺序为
中几种元素电负性由大到小的顺序为(3)已知分子中的大
 键可以用
键可以用 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表大
键的原子数,n代表大 键中的电子数,则
键中的电子数,则 中大
中大 键可以表示为
键可以表示为(4)
 熔点为
熔点为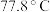 ,则
,则 的晶体类型为
的晶体类型为 和
和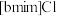 混合形成离子液体的过程中会存在以下转化:
混合形成离子液体的过程中会存在以下转化: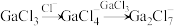 ,请画出
,请画出 的结构式
的结构式(5)某种
 的晶胞结构如图所示,O2−以六方最密方式堆积,
的晶胞结构如图所示,O2−以六方最密方式堆积, 在其八面体空隙中(注:未全部标出,如:
在其八面体空隙中(注:未全部标出,如: 在1、2、3、4、5、6构成的八面体体心)。
在1、2、3、4、5、6构成的八面体体心)。
①该晶胞中O2−的配位数为
②已知氧离子半径为acm,晶胞的高为bcm,NA代表阿伏加德罗常数的值,该晶体的密度为
 和NA的代数式表示)。
和NA的代数式表示)。
您最近一年使用:0次
名校
6 . 碳及钾元素形成的单质及其化合物有重要的应用。回答下列问题:
(1)放射性同位素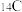 常用于测定古生物体的年龄,它可由中子轰击A原子制得:
常用于测定古生物体的年龄,它可由中子轰击A原子制得: 。则基态A原子的价电子排布式为
。则基态A原子的价电子排布式为_____ ;第四周期副族元素基态原子中,与A含有相同未成对电子数相同的元素有_____ (填元素符号)。
(2)碳元素可与氮等其他元素形成许多胺类物质,其中烟碱和多巴胺的结构如下:

烟碱中N原子的杂化方式为_____ ;多巴胺的沸点比烟碱高,其原因为_____ 。
(3) 可用于超微量Cu(Ⅱ)的测定。
可用于超微量Cu(Ⅱ)的测定。 中阴离子空间构型是
中阴离子空间构型是_____ ,与其互为等电子体的一种分子为_____ 。
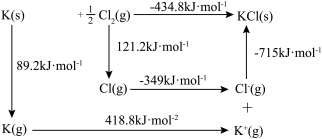
(4)KCl可用作氮肥的生产,其晶体的晶格能可通过下图热化学循环计算得到。则K原子的第一电离能为_____  ,Cl—Cl键键能为
,Cl—Cl键键能为_____  。
。
(5)石墨层间插入碱金属K可形成一系列夹层化合物,其导电性和磁性发生很大的变化。某种夹层化合物的结构如下图所示,每隔两层插入一层钾原子,与钾层相邻的上下两层碳原子的排列方式相同。
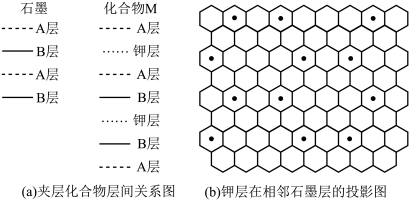
图(b)中正六边形的顶点代表碳原子,黑点代表钾原子。
①距离钾原子最近的碳原子的个数为_____ ;该夹层化合物的化学式为_____ 。
②若钾层相邻两个K之间的最近距离为dpm,则石墨层中C—C键键长为_____ pm。
(1)放射性同位素
 常用于测定古生物体的年龄,它可由中子轰击A原子制得:
常用于测定古生物体的年龄,它可由中子轰击A原子制得: 。则基态A原子的价电子排布式为
。则基态A原子的价电子排布式为(2)碳元素可与氮等其他元素形成许多胺类物质,其中烟碱和多巴胺的结构如下:

烟碱中N原子的杂化方式为
(3)
 可用于超微量Cu(Ⅱ)的测定。
可用于超微量Cu(Ⅱ)的测定。 中阴离子空间构型是
中阴离子空间构型是(4)KCl可用作氮肥的生产,其晶体的晶格能可通过下图热化学循环计算得到。则K原子的第一电离能为
 ,Cl—Cl键键能为
,Cl—Cl键键能为 。
。
(5)石墨层间插入碱金属K可形成一系列夹层化合物,其导电性和磁性发生很大的变化。某种夹层化合物的结构如下图所示,每隔两层插入一层钾原子,与钾层相邻的上下两层碳原子的排列方式相同。

图(b)中正六边形的顶点代表碳原子,黑点代表钾原子。
①距离钾原子最近的碳原子的个数为
②若钾层相邻两个K之间的最近距离为dpm,则石墨层中C—C键键长为
您最近一年使用:0次
名校
解题方法
7 . 芳香胺是多种染料产品的中间体,也是农药、除草剂和多种橡胶防老剂的主要原料。
I.制备 萘胺:
萘胺:
(1)溶剂 的结构简式为
的结构简式为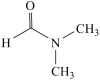 ,则
,则 中,C原子的杂化类型有
中,C原子的杂化类型有___________ , 中所含有的
中所含有的 键数目为
键数目为___________ ,分子中第一电离能最大的元素是___________ 。
(2) 萘胺的水溶性比
萘胺的水溶性比 硝基萘的强,原因是
硝基萘的强,原因是___________ 。
II.制备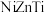 催化剂:向按比例配置的
催化剂:向按比例配置的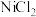 、
、 、
、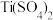 混合溶液中加入碱液,调节
混合溶液中加入碱液,调节 至9~11,使其共沉淀。将沉淀分离出来后焙烧并进一步还原,可得最终产物
至9~11,使其共沉淀。将沉淀分离出来后焙烧并进一步还原,可得最终产物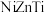 。制备过程中,会生成
。制备过程中,会生成 、
、 、
、 等中间产物。
等中间产物。

(3) 的基态原子价层电子排布式为
的基态原子价层电子排布式为___________ 。
(4) 的空间构型为
的空间构型为___________ 。
(5) 的熔点为
的熔点为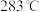 ,验证
,验证 晶体类型的实验方案为
晶体类型的实验方案为___________ 。
(6)中间产物 的一种晶体结构如图所示。由图可知,
的一种晶体结构如图所示。由图可知, 原子位于O原子所围成的
原子位于O原子所围成的___________ 空隙中(填“四面体”或“八面体”),已知晶胞参数为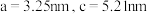 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则晶胞密度为
,则晶胞密度为___________  。(列出计算式,晶胞参数用字母a、c表示)
。(列出计算式,晶胞参数用字母a、c表示)
I.制备
 萘胺:
萘胺:
(1)溶剂
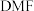 的结构简式为
的结构简式为 ,则
,则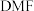 中,C原子的杂化类型有
中,C原子的杂化类型有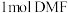 中所含有的
中所含有的 键数目为
键数目为(2)
 萘胺的水溶性比
萘胺的水溶性比 硝基萘的强,原因是
硝基萘的强,原因是II.制备
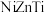 催化剂:向按比例配置的
催化剂:向按比例配置的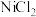 、
、 、
、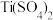 混合溶液中加入碱液,调节
混合溶液中加入碱液,调节 至9~11,使其共沉淀。将沉淀分离出来后焙烧并进一步还原,可得最终产物
至9~11,使其共沉淀。将沉淀分离出来后焙烧并进一步还原,可得最终产物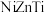 。制备过程中,会生成
。制备过程中,会生成 、
、 、
、 等中间产物。
等中间产物。
(3)
 的基态原子价层电子排布式为
的基态原子价层电子排布式为(4)
 的空间构型为
的空间构型为(5)
 的熔点为
的熔点为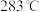 ,验证
,验证 晶体类型的实验方案为
晶体类型的实验方案为(6)中间产物
 的一种晶体结构如图所示。由图可知,
的一种晶体结构如图所示。由图可知, 原子位于O原子所围成的
原子位于O原子所围成的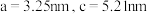 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则晶胞密度为
,则晶胞密度为 。(列出计算式,晶胞参数用字母a、c表示)
。(列出计算式,晶胞参数用字母a、c表示)
您最近一年使用:0次
2022-01-13更新
|
1002次组卷
|
5卷引用:广东省佛山市2021-2022学年高三上学期普通高中第一次教学质量检测化学试卷
广东省佛山市2021-2022学年高三上学期普通高中第一次教学质量检测化学试卷(已下线)第19周 周测卷-备战2022年高考化学周测与晚练(新高考专用)(已下线)专项17 物质结构与性质综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)黑龙江省哈尔滨市第九中学校2022届高考最后押题卷(一)化学试题甘肃省武威第六中学2022届高三下学期第八次诊断考试理综化学试题
解题方法
8 . 过渡金属及其化合物在生产、生活中有重要的应用。
回答下列问题:
(1)基态Cu的价电子轨道表达式为___________ 。
(2)一种含Ti的催化剂X能催化乙烯、丙烯等的聚合,其结构如图甲所示。X中,C原子的杂化类型有___________ ,不含有的作用力类型是___________ (填序号)。

A. 键 B.
键 B. 键 C.配位键 D.离子键 E.共价键
键 C.配位键 D.离子键 E.共价键
(3)分子中的大 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数。
键的电子数。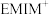 子由H、C、N三种元素组成,其结构如图乙所示,则
子由H、C、N三种元素组成,其结构如图乙所示,则 离子中的大
离子中的大 键应表示为
键应表示为___________ 。

(4)已知第三电离能数据: ,
,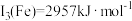 。锰的第三电离能大于铁的第三电离能,其主要原因是
。锰的第三电离能大于铁的第三电离能,其主要原因是___________ 。
(5)黄铜矿是提炼铜的主要原料,其主要成分的晶胞结构如图丙所示。

① 周围距离最近的
周围距离最近的 数为
数为___________ 。
②在高温下,黄铜矿的主要成分的晶体中金属离子可以发生迁移。若亚铁离子与铜离子发生完全无序的置换,可将它们视作等同的金属离子,在无序的高温型结构中,金属离子占据___________ (填“四面体空隙”或“八面体空隙”)。
③该晶胞上下底面均为正方形,侧面与底面垂直,晶胞参数如图所示,设NA为阿伏加德罗常数的值,请计算该晶体的密度
___________  。
。
回答下列问题:
(1)基态Cu的价电子轨道表达式为
(2)一种含Ti的催化剂X能催化乙烯、丙烯等的聚合,其结构如图甲所示。X中,C原子的杂化类型有

A.
 键 B.
键 B. 键 C.配位键 D.离子键 E.共价键
键 C.配位键 D.离子键 E.共价键(3)分子中的大
 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数。
键的电子数。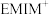 子由H、C、N三种元素组成,其结构如图乙所示,则
子由H、C、N三种元素组成,其结构如图乙所示,则 离子中的大
离子中的大 键应表示为
键应表示为
(4)已知第三电离能数据:
 ,
,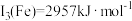 。锰的第三电离能大于铁的第三电离能,其主要原因是
。锰的第三电离能大于铁的第三电离能,其主要原因是(5)黄铜矿是提炼铜的主要原料,其主要成分的晶胞结构如图丙所示。

①
 周围距离最近的
周围距离最近的 数为
数为②在高温下,黄铜矿的主要成分的晶体中金属离子可以发生迁移。若亚铁离子与铜离子发生完全无序的置换,可将它们视作等同的金属离子,在无序的高温型结构中,金属离子占据
③该晶胞上下底面均为正方形,侧面与底面垂直,晶胞参数如图所示,设NA为阿伏加德罗常数的值,请计算该晶体的密度

 。
。
您最近一年使用:0次
名校
解题方法
9 . 锰(Mn)、钴(Co)、镍(Ni)等过渡金属元素化合物的应用研究是前沿科学之一,回答下列问题:
(1)Mn的价电子排布式为___________ 。金属锰可导电、导热,有金属光泽和延展性,这些性质都可以用“___________ 理论”解释。
(2)已知金属锰有多种晶型,γ型锰的面心立方晶胞俯视图符合下列___________ (填序号),每个Mn原子周围紧邻的原子数为___________ 。
A. B.
B.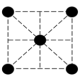 C.
C.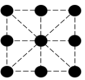 D.
D.
(3)[Co(DMSO)6](ClO4)2是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为SO(CH3)2。DMSO中硫原子的杂化轨道类型为___________ ,SO(CH3)2中键角∠C—S—O___________ CH3COCH3中键角∠C—C—O(填“大于”“小于”或“等于”),ClO 的空间构型是
的空间构型是___________ ,元素S、Cl、O的电负性由大到小的顺序为___________ 。
(4)镍和苯基硼酸在催化剂作用下可以合成丙烯醇(CH2=CH—CH2OH),其相对分子质量等于丙醛(CH3CH2CHO),但两者沸点相差较大,原因是___________ 。
(5)NiO的晶胞结构如图甲所示,其中离子坐标参数A为(0,0,0),B为(1,1,1),则C的离子坐标参数为___________ 。一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图乙),已知O2-的半径为apm,设阿伏加德罗常数值为NA,每平方米面积上具有该晶体的质量为___________ g(用含a、NA的代数式表示)。
(1)Mn的价电子排布式为
(2)已知金属锰有多种晶型,γ型锰的面心立方晶胞俯视图符合下列
A.
 B.
B. C.
C. D.
D.
(3)[Co(DMSO)6](ClO4)2是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为SO(CH3)2。DMSO中硫原子的杂化轨道类型为
 的空间构型是
的空间构型是(4)镍和苯基硼酸在催化剂作用下可以合成丙烯醇(CH2=CH—CH2OH),其相对分子质量等于丙醛(CH3CH2CHO),但两者沸点相差较大,原因是
(5)NiO的晶胞结构如图甲所示,其中离子坐标参数A为(0,0,0),B为(1,1,1),则C的离子坐标参数为

您最近一年使用:0次
2021-12-23更新
|
1212次组卷
|
9卷引用:广东省“六校联盟”2021-2022学年高三上学期第三次联考化学试题
广东省“六校联盟”2021-2022学年高三上学期第三次联考化学试题(已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)回归教材重难点11 物质结构与性质-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)回归教材重难点11 物质结构与性质(选考)-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)四川省成都市成都外国语学校2022届高三下学期第二次诊断性考试理科综合化学试题黑龙江省哈尔滨师范大学附属中学2022-2023学年高三上学期10月月考化学试题黑龙江省绥化市绥棱县第一中学2022-2023学年高三上学期10月月考化学试题四川省南充高级中学2023-2024学年高三下学期第二次模拟考试化学四川省南充高级中学2024届高三第二次模拟考试理综-化学试题
10 . 钒常以钒铁、钒化合物和金属钒的形式广泛应用于冶金、宇航、电池、超导材料等领域。
I.Na3V2O2(PO4)2F被认为是钠离子电池最有希望的正极材料之一,其合成原料包括偏钒酸氨(NH4VO3),氟化钠NaF和磷酸二氢按(NH4H2PO4)。
(1)基态钒原子价层电子排布式是___ 。
(2)上述原料涉及元素中,N、O、F、Na的第一电离能由大到小的顺序为___ ,请解释原因___ 。
(3)下列关于上述化合物的说法,正确的是___ 。(填字母)
A.Na3V2O2(PO4)2F中原子半径最大的前三周期原子是Na
B.Na3V2O2(PO4)2F与NaF所含化学键的类型完全相同
C.NH4VO3水溶液中中心原子杂化类型为sp3的粒子只有NH
D.NH4H2PO4的晶体类型是离子晶体
E.NH4H2PO4中阴离子的空间构型是正四面体形
II.一种含钒超导材料的晶胞结构(图a)及晶体结构俯视图(图b)如图。

(4)该晶体中粒子个数比Cs:V:Sb=___ ;与V原子最近的V原子的个数是___ 。
(5)设该含钒超导材料最简式的式量为Mr,则该晶体密度为___ g•cm-3(列出算式)。
I.Na3V2O2(PO4)2F被认为是钠离子电池最有希望的正极材料之一,其合成原料包括偏钒酸氨(NH4VO3),氟化钠NaF和磷酸二氢按(NH4H2PO4)。
(1)基态钒原子价层电子排布式是
(2)上述原料涉及元素中,N、O、F、Na的第一电离能由大到小的顺序为
(3)下列关于上述化合物的说法,正确的是
A.Na3V2O2(PO4)2F中原子半径最大的前三周期原子是Na
B.Na3V2O2(PO4)2F与NaF所含化学键的类型完全相同
C.NH4VO3水溶液中中心原子杂化类型为sp3的粒子只有NH

D.NH4H2PO4的晶体类型是离子晶体
E.NH4H2PO4中阴离子的空间构型是正四面体形
II.一种含钒超导材料的晶胞结构(图a)及晶体结构俯视图(图b)如图。

(4)该晶体中粒子个数比Cs:V:Sb=
(5)设该含钒超导材料最简式的式量为Mr,则该晶体密度为
您最近一年使用:0次



