名校
解题方法
1 . 中国科学家合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料 ,并获得该化合物的
,并获得该化合物的 器件,该结果有望为白光发射的设计和应用提供新的有效策略。
器件,该结果有望为白光发射的设计和应用提供新的有效策略。
(1)已知 与
与 同族,基态
同族,基态 原子价层电子的运动状态有
原子价层电子的运动状态有_________ 种,基态 原子的电子排布式不能表示为
原子的电子排布式不能表示为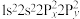 ,因为这违背了
,因为这违背了_________ (填选项)。
A.能量最低原理 B.泡利不相容原理 C.洪特规则
(2) 中硼原子的杂化轨道类型为
中硼原子的杂化轨道类型为_________ 。 中,
中, 与
与 之间不存在的化学键是
之间不存在的化学键是_________ (填选项)。
A. 键 B.
键 B.  键 C. 配位键 D. 极性键
键 C. 配位键 D. 极性键
(3)碳酸钡、碳酸镁分解得到的金属氧化物中,熔点较低的是_________ ,其原因是__________________ 。
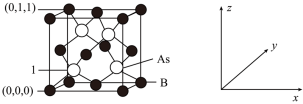
(4)超高热导率半导体材料砷化硼( )的晶胞结构如图所示,则1号砷原子的原子坐标为
)的晶胞结构如图所示,则1号砷原子的原子坐标为_________ 。已知阿伏加德罗常数的值为 ,若晶胞中
,若晶胞中 原子到
原子到 原子最近距离为
原子最近距离为 ,则该晶体的密度为
,则该晶体的密度为_________  (列出含
(列出含 、
、 的计算式即可)。
的计算式即可)。
 ,并获得该化合物的
,并获得该化合物的 器件,该结果有望为白光发射的设计和应用提供新的有效策略。
器件,该结果有望为白光发射的设计和应用提供新的有效策略。(1)已知
 与
与 同族,基态
同族,基态 原子价层电子的运动状态有
原子价层电子的运动状态有 原子的电子排布式不能表示为
原子的电子排布式不能表示为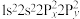 ,因为这违背了
,因为这违背了A.能量最低原理 B.泡利不相容原理 C.洪特规则
(2)
 中硼原子的杂化轨道类型为
中硼原子的杂化轨道类型为 中,
中, 与
与 之间不存在的化学键是
之间不存在的化学键是A.
 键 B.
键 B.  键 C. 配位键 D. 极性键
键 C. 配位键 D. 极性键(3)碳酸钡、碳酸镁分解得到的金属氧化物中,熔点较低的是
(4)超高热导率半导体材料砷化硼(
 )的晶胞结构如图所示,则1号砷原子的原子坐标为
)的晶胞结构如图所示,则1号砷原子的原子坐标为 ,若晶胞中
,若晶胞中 原子到
原子到 原子最近距离为
原子最近距离为 ,则该晶体的密度为
,则该晶体的密度为 (列出含
(列出含 、
、 的计算式即可)。
的计算式即可)。
您最近一年使用:0次
2022-11-13更新
|
434次组卷
|
6卷引用:山西省太原市第五中学2021-2022学年上学期高三第四次模块诊断化学试题
山西省太原市第五中学2021-2022学年上学期高三第四次模块诊断化学试题(已下线)第十一单元 物质结构与性质(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)一轮巩固卷7-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)广东省广州市广大附中、广外、铁一中学三校2022届高三三模联考化学试题福建永春一中、培元中学、季延中学、石光中学2022-2023学年高三上学期期中考联考化学试题(已下线)化学(全国乙卷单科卷)-学易金卷:2023年高考第一次模拟考试卷
2 . 过渡金属及其化合物在生产、生活中有重要的应用。回答下列问题:
(1)基态 的价电子轨道表达式为
的价电子轨道表达式为_______ 。
(2)一种含 的催化剂
的催化剂 能催化乙烯、丙烯等的聚合,其结构如图甲所示。
能催化乙烯、丙烯等的聚合,其结构如图甲所示。 中,
中, 原子的杂化类型有
原子的杂化类型有_______ , 中含有的作用力类型有
中含有的作用力类型有_______ (填序号),非金属元素电负性由大到小的顺序为_______ 。
A.π键 B. 氢键 C. 配位键 D.σ键 E. 离子键

(3)分子中的大 键可用符号
键可用符号 表示,其中
表示,其中 代表参与形成大
代表参与形成大 键的原子数,
键的原子数, 代表参与形成大
代表参与形成大 键的电子数。
键的电子数。 离子由
离子由 、
、 、
、 三种元素组成,其结构如图乙所示,则
三种元素组成,其结构如图乙所示,则 离子中的大
离子中的大 键应表示为
键应表示为_______ 。
(4) 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的
中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的 的结构式为
的结构式为_______ 。
(5)黄铜矿是提炼铜的主要原料,其主要成分的晶胞结构如图。

① 周围距离最近的
周围距离最近的 数为
数为_______ 。
②黄铜矿炼铜过程中会产生硫的氧化物废气,其中 分子空间构型为
分子空间构型为_______ ,与 互为等电子体的阴离子有
互为等电子体的阴离子有_______ (写一种即可)。
③该晶胞上下底面均为正方形,侧面与底面垂直,晶胞参数如图所示,设 为阿伏加德罗常数的值,请计算该晶体的密度
为阿伏加德罗常数的值,请计算该晶体的密度
_______  。
。
(1)基态
 的价电子轨道表达式为
的价电子轨道表达式为(2)一种含
 的催化剂
的催化剂 能催化乙烯、丙烯等的聚合,其结构如图甲所示。
能催化乙烯、丙烯等的聚合,其结构如图甲所示。 中,
中, 原子的杂化类型有
原子的杂化类型有 中含有的作用力类型有
中含有的作用力类型有A.π键 B. 氢键 C. 配位键 D.σ键 E. 离子键

(3)分子中的大
 键可用符号
键可用符号 表示,其中
表示,其中 代表参与形成大
代表参与形成大 键的原子数,
键的原子数, 代表参与形成大
代表参与形成大 键的电子数。
键的电子数。 离子由
离子由 、
、 、
、 三种元素组成,其结构如图乙所示,则
三种元素组成,其结构如图乙所示,则 离子中的大
离子中的大 键应表示为
键应表示为(4)
 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的
中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的 的结构式为
的结构式为(5)黄铜矿是提炼铜的主要原料,其主要成分的晶胞结构如图。

①
 周围距离最近的
周围距离最近的 数为
数为②黄铜矿炼铜过程中会产生硫的氧化物废气,其中
 分子空间构型为
分子空间构型为 互为等电子体的阴离子有
互为等电子体的阴离子有③该晶胞上下底面均为正方形,侧面与底面垂直,晶胞参数如图所示,设
 为阿伏加德罗常数的值,请计算该晶体的密度
为阿伏加德罗常数的值,请计算该晶体的密度
 。
。
您最近一年使用:0次
解题方法
3 . 金属氢化物作还原剂具有反应条件温和、副反应少以及产率高的优点,常用的有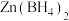 、
、 、
、 等。回答下列问题:
等。回答下列问题:
(1)基态锌原子的电子排布式为___________ , 核外电子的运动状态有
核外电子的运动状态有___________ 种。
(2)硼氢化锌 能发生
能发生 -非对映选择性还原:
-非对映选择性还原:
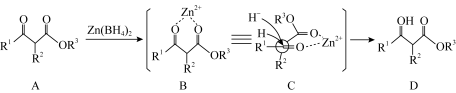
对比 与
与 两种有机物,与
两种有机物,与 相连的碳原子的杂化轨道类型由
相连的碳原子的杂化轨道类型由___________ 变为___________ ,过渡态 中存在的化学键有
中存在的化学键有 键,还有
键,还有___________ (填标号)。
a.离子键 b.配位键 c.氢键 d. 键
键
(3) 晶胞结构如图所示,它由两个正六面体叠加而成。
晶胞结构如图所示,它由两个正六面体叠加而成。

① 中三种元素的电负性大小顺序是
中三种元素的电负性大小顺序是___________ ,与 晶体中的阴离子空间构型相同,电子总数也相同的分子是
晶体中的阴离子空间构型相同,电子总数也相同的分子是___________ (填分子式)。
② 晶体中,与
晶体中,与 紧邻且等距的
紧邻且等距的 有
有___________ 个。若该晶体的密度为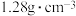 ,则晶胞底面边长
,则晶胞底面边长
___________  (列出计算式即可)。
(列出计算式即可)。
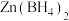 、
、 、
、 等。回答下列问题:
等。回答下列问题:(1)基态锌原子的电子排布式为
 核外电子的运动状态有
核外电子的运动状态有(2)硼氢化锌
 能发生
能发生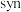 -非对映选择性还原:
-非对映选择性还原:
对比
 与
与 两种有机物,与
两种有机物,与 相连的碳原子的杂化轨道类型由
相连的碳原子的杂化轨道类型由 中存在的化学键有
中存在的化学键有 键,还有
键,还有a.离子键 b.配位键 c.氢键 d.
 键
键(3)
 晶胞结构如图所示,它由两个正六面体叠加而成。
晶胞结构如图所示,它由两个正六面体叠加而成。
①
 中三种元素的电负性大小顺序是
中三种元素的电负性大小顺序是 晶体中的阴离子空间构型相同,电子总数也相同的分子是
晶体中的阴离子空间构型相同,电子总数也相同的分子是②
 晶体中,与
晶体中,与 紧邻且等距的
紧邻且等距的 有
有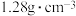 ,则晶胞底面边长
,则晶胞底面边长
 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
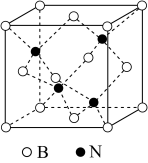
4 . 氮化硼(BN)是一种重要的功能陶瓷材料,以天然硼砂为起始物,经过一系列反应可以得到 和BN,如图所示:
和BN,如图所示:
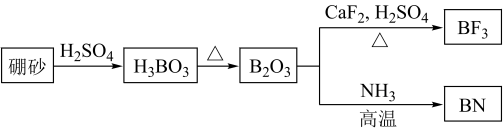
请回答下列问题:
(1) 的电子式为
的电子式为___________ 。
(2)由 制备
制备 的化学方程式是
的化学方程式是___________ , 的结构式为
的结构式为___________ 。
(3)根据对角线规则,B的一些化学性质与元素___________ 的相似。 分子中,
分子中,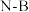 化学键称为
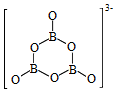
化学键称为___________ 键,其电子对由___________ 提供。氨硼烷在催化剂作用下水解释放氢气: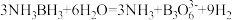 ,
, 的结构如图所示:在该反应中,B原子的杂化轨道类型由
的结构如图所示:在该反应中,B原子的杂化轨道类型由___________ 变为___________ 。与 互为等电子体的阳离子
互为等电子体的阳离子___________ (写一种即可)。
(4)氮化硼晶体有多种结构,如立方氮化硼和六方氮化硼等。立方氮化硼结构与金刚石相似(如图),晶胞边长为apm,立方氮化硼的密度是 。设阿伏加德罗常数值为
。设阿伏加德罗常数值为 。则a=
。则a=___________ (用 、
、 表示)。
表示)。
 和BN,如图所示:
和BN,如图所示:
请回答下列问题:
(1)
 的电子式为
的电子式为(2)由
 制备
制备 的化学方程式是
的化学方程式是 的结构式为
的结构式为(3)根据对角线规则,B的一些化学性质与元素
 分子中,
分子中,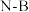 化学键称为
化学键称为 ,
, 的结构如图所示:在该反应中,B原子的杂化轨道类型由
的结构如图所示:在该反应中,B原子的杂化轨道类型由 互为等电子体的阳离子
互为等电子体的阳离子
(4)氮化硼晶体有多种结构,如立方氮化硼和六方氮化硼等。立方氮化硼结构与金刚石相似(如图),晶胞边长为apm,立方氮化硼的密度是
 。设阿伏加德罗常数值为
。设阿伏加德罗常数值为 。则a=
。则a= 、
、 表示)。
表示)。
您最近一年使用:0次
解题方法
5 . 稀土有“工业维生素”的美称,如今已成为极其重要的战略资源。回答下列问题:
(1)基态钪(Se)原子核外电子排布式为_______ ,M能层中能量不同的电子有_______ 种。
(2)铌的混合配体离子[Nd(H2O)6Cl2]+中,配体是_______ (填“微粒符号”)。
(3)Sm(钐)的单质与1,2-二碘乙烧可发生如下反应:Sm+CH2I-CH2I→SmI2+CH2=CH2↑。CH2I-CH2I中碳原子杂化轨道类型为_______ ,1molCH2=CH2中含有的σ键数目为_______ 。常温下1,2-二碘乙烷为液体而乙烷为气体,其主要原因是_______ 。
(4)化合物中,稀土元素最常见的化合价是+3,但也有少数的稀土元素可以显+4价。下面四种稀土元素的电离能(单位:kJ·mol-1)数据如下表,判断最有可能显+4价的稀土元素是________ (填元素符号)。
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,则PrO2(二氧化镨)的晶胞中Pr原子的配位数为_______ 。原子与Pr原子配位数不同,影响这一结果的是离子晶体的_______ (填“几何”“电荷”或“键性”)因素。
(6)掺杂稀土的硼化镁在39K时有超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。图1是该晶体微观结构中取出的部分原子沿z轴方向的投影,白球是镁原子投影,黑球是硼原子投影。则硼化镁的化学式为_______ 。

(7)磷化硼(BP)是一种有价值的超硬耐磨涂层材料,这种陶瓷材料可作为金属表面的保护薄膜。磷化硼晶胞如图2所示。当晶胞晶格参数为478pm时,磷化硼中硼原子和磷原子之间的最近距离为___ cm。
(1)基态钪(Se)原子核外电子排布式为
(2)铌的混合配体离子[Nd(H2O)6Cl2]+中,配体是
(3)Sm(钐)的单质与1,2-二碘乙烧可发生如下反应:Sm+CH2I-CH2I→SmI2+CH2=CH2↑。CH2I-CH2I中碳原子杂化轨道类型为
(4)化合物中,稀土元素最常见的化合价是+3,但也有少数的稀土元素可以显+4价。下面四种稀土元素的电离能(单位:kJ·mol-1)数据如下表,判断最有可能显+4价的稀土元素是
| 元素 | I1 | I2 | I3 | I4 |
| Sc(钪) | 633 | 1235 | 2389 | 7019 |
| Y(铱) | 616 | 1181 | 1980 | 5963 |
| La(镧) | 538 | 1067 | 1850 | 4819 |
| Ce(铈) | 527 | 1047 | 1949 | 3547 |
(6)掺杂稀土的硼化镁在39K时有超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。图1是该晶体微观结构中取出的部分原子沿z轴方向的投影,白球是镁原子投影,黑球是硼原子投影。则硼化镁的化学式为

(7)磷化硼(BP)是一种有价值的超硬耐磨涂层材料,这种陶瓷材料可作为金属表面的保护薄膜。磷化硼晶胞如图2所示。当晶胞晶格参数为478pm时,磷化硼中硼原子和磷原子之间的最近距离为
您最近一年使用:0次
2021-07-13更新
|
251次组卷
|
2卷引用:山西省太原市2021-2022学年高三上学期期中检测化学试题
6 . 钛(Ti)及其化合物的应用研究是目前前沿科学之一,请回答下列问题:
(1)基态钛原子的电子排布式为_______ ,核外电子占据的轨道数为_______ 。
(2)与钛位于同一周期且基态原子单电子数与钛相同的元素,第一电离能由大到小的顺序为_______ (用元素符号填空)。
(3)TiCl4常温下为无色液体,熔点250K,沸点409K,则TiCl4属于_______ 晶体。TiCl4在水中或空气中极易水解,露置于空气中形成白色烟雾,烟雾中的固体成分可用TiO2·nH2O表示,请写出TiCl4在空气中产生烟雾的化学方程式:_______ 。
(4)TiO2作光催化剂可将甲醛、苯等有害气体转化为CO2和H2O。
①上述含碳原子的分子中,碳原子的杂化方式为sp2的是_______ (填名称,下同),属于极性分子的是_______ 。
②下列各组微粒互为等电子体的是_______ (填字母标号)。
A.H2O与SO2 B.CO2与N2O C.CH2O与BF3 D.C6H6与B3N3H6
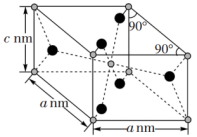
(5)金红石(TiO2)的晶胞结构如图所示,晶胞内均摊的氧原子数为_______ ;设NA为阿伏加德罗常数的值,则该晶体的密度为_______ g·cm-3(用含相关字母和符号的代数式表示)。
(1)基态钛原子的电子排布式为
(2)与钛位于同一周期且基态原子单电子数与钛相同的元素,第一电离能由大到小的顺序为
(3)TiCl4常温下为无色液体,熔点250K,沸点409K,则TiCl4属于
(4)TiO2作光催化剂可将甲醛、苯等有害气体转化为CO2和H2O。
①上述含碳原子的分子中,碳原子的杂化方式为sp2的是
②下列各组微粒互为等电子体的是
A.H2O与SO2 B.CO2与N2O C.CH2O与BF3 D.C6H6与B3N3H6
(5)金红石(TiO2)的晶胞结构如图所示,晶胞内均摊的氧原子数为

您最近一年使用:0次
解题方法
7 . 2019年的化学诺贝尔奖颁给了为锂电池研究作出贡献的三位科学家。有两种常见锂电池:一种是采用镍钴锰酸锂Li(NiCoMn)O2或镍钴铝酸锂为正极的“三元材料锂电池”;另一种是采用磷酸铁锂为正极的磷酸铁锂电池。请回答下列问题:
(1)现代化学中,常利用___________ 上的特征谱线来鉴定元素
(2)基态钴原子的价电子轨道表达式为___________ ,Mn位于元素周期表的___________ 区。
(3)磷元素可以形成多种含氧酸H3PO4、H3PO2、H3PO3、HPO3,这四种酸中酸性最强的是___________ 。PO 的空间构型是
的空间构型是___________ ,中心原子的杂化方式是___________ 。
(4)有些锂电池的负极锂嵌在石墨内,利用物质结构和性质解释含碳的两种微粒HCO 和CO
和CO 后者水解程度大的原因是
后者水解程度大的原因是___________ 。
(5)PH3是___________ 分子(填“极性”或“非极性”),其键角比NH3小,原因是___________ 。
(6)硫化锂Li2S(摩尔质量Mg∙mol−1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如图。若硫化锂晶体的密度为ag·cm−3,则距离最近的两个S2−的距离是___________ nm。(用含a、M、NA的计算式表示)

(1)现代化学中,常利用
(2)基态钴原子的价电子轨道表达式为
(3)磷元素可以形成多种含氧酸H3PO4、H3PO2、H3PO3、HPO3,这四种酸中酸性最强的是
 的空间构型是
的空间构型是(4)有些锂电池的负极锂嵌在石墨内,利用物质结构和性质解释含碳的两种微粒HCO
 和CO
和CO 后者水解程度大的原因是
后者水解程度大的原因是(5)PH3是
(6)硫化锂Li2S(摩尔质量Mg∙mol−1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如图。若硫化锂晶体的密度为ag·cm−3,则距离最近的两个S2−的距离是

您最近一年使用:0次
名校
解题方法
8 . 铬、镍等过渡元素的单质、化合物在工业上有广泛的应用。
(1)基态镍原子核外共有______ 种不同的能量的电子,3d能级上的未成对电子数为______ 。
(2)Cu和Cr位于同一周期。
①向CuSO4溶液中逐滴加入氨水,可得深蓝色晶体[Cu(NH3)4]SO4·H2O,其中心离子是______ (填元素符号),配体是______ ,SO 的几何构型为
的几何构型为______ 。
②Cr元素所在周期中金属原子第一电离能最大的是______ (填元素符号,下同)。
③Cr元素所在周期中原子电负性最大的是______ (不考虑零族元素)。
(3)过渡金属单质及其化合物是有机合成反应的重要催化剂。
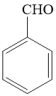
例如: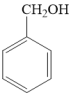

 。
。
①苯甲醇分子中的碳原子的杂化类型分别是______ 、______ 。
②苯甲醇、苯甲醛的沸点依次为206℃、179℃,造成二者沸点差异的主要原因是______ 。
(1)基态镍原子核外共有
(2)Cu和Cr位于同一周期。
①向CuSO4溶液中逐滴加入氨水,可得深蓝色晶体[Cu(NH3)4]SO4·H2O,其中心离子是
 的几何构型为
的几何构型为②Cr元素所在周期中金属原子第一电离能最大的是
③Cr元素所在周期中原子电负性最大的是
(3)过渡金属单质及其化合物是有机合成反应的重要催化剂。
例如:


 。
。①苯甲醇分子中的碳原子的杂化类型分别是
②苯甲醇、苯甲醛的沸点依次为206℃、179℃,造成二者沸点差异的主要原因是
您最近一年使用:0次
2021-05-11更新
|
150次组卷
|
3卷引用:山西省晋城市高平一中、阳城一中、高平一中实验学校2020-2021学年高二下学期期中联考化学试题
解题方法
9 . 回答下列问题:
(1)符号“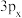 ”没有给出的信息是
”没有给出的信息是___________ 。
A.能层
B.能级
C.电子云在空间的伸展方向
D.电子的自旋方向
(2)将 通入稀NaOH溶液中可生成
通入稀NaOH溶液中可生成 。
。 中氧原子的杂化方式为
中氧原子的杂化方式为___________ 。
(3) 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得。基态
反应制得。基态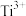 的电子占据的最高能层符号为
的电子占据的最高能层符号为___________ ,该能层具有的原子轨道数为___________ , 的立体结构是
的立体结构是___________ 。
(4)目前发现有些元素的化学性质和它在周期表中左上方或右下方的另一主族元素性质相似,这称为对角线规则。氯化铍在气态时存在 分子(a)和二聚分子
分子(a)和二聚分子 (b),a属于
(b),a属于___________ (填“离子”或“共价”)化合物;b中Be原子的杂化方式相同。且所有原子都在同一平面上,则b的结构式为___________ (标出配位键)。
(5)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般 或
或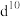 排布无颜色,
排布无颜色, 排布有颜色。如
排布有颜色。如 显粉红色。据此判断:
显粉红色。据此判断: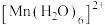
___________ (填“无”或“有”)颜色。
(6)过渡金属易与CO形成羰基配合物,如配合物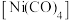 ,常温下为液态,易溶于
,常温下为液态,易溶于 、苯等有机溶剂。
、苯等有机溶剂。
①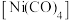 固态时属于
固态时属于___________ 分子(填极性或非极性);
②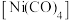 中Ni与CO的
中Ni与CO的___________ 原子形成配位键;
③ 分子中
分子中 键与
键与 键个数比为
键个数比为___________ 。
(1)符号“
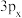 ”没有给出的信息是
”没有给出的信息是A.能层
B.能级
C.电子云在空间的伸展方向
D.电子的自旋方向
(2)将
 通入稀NaOH溶液中可生成
通入稀NaOH溶液中可生成 。
。 中氧原子的杂化方式为
中氧原子的杂化方式为(3)
 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得。基态
反应制得。基态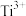 的电子占据的最高能层符号为
的电子占据的最高能层符号为 的立体结构是
的立体结构是(4)目前发现有些元素的化学性质和它在周期表中左上方或右下方的另一主族元素性质相似,这称为对角线规则。氯化铍在气态时存在
 分子(a)和二聚分子
分子(a)和二聚分子 (b),a属于
(b),a属于(5)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般
 或
或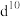 排布无颜色,
排布无颜色, 排布有颜色。如
排布有颜色。如 显粉红色。据此判断:
显粉红色。据此判断: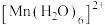
(6)过渡金属易与CO形成羰基配合物,如配合物
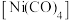 ,常温下为液态,易溶于
,常温下为液态,易溶于 、苯等有机溶剂。
、苯等有机溶剂。①
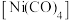 固态时属于
固态时属于②
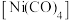 中Ni与CO的
中Ni与CO的③
 分子中
分子中 键与
键与 键个数比为
键个数比为
您最近一年使用:0次
10 . 太阳能电池一共可分为三代,请回答下列问题:
(1)第一代太阳能电池为硅基太阳能电池,其中以单晶硅太阳能电池的转化效率最高,技术最为成熟,应用最为广泛。
①在基态Si原子中,电子占据的最高能层符号为___________ ,电子占据的最高能级的电子云轮廓图为___________ 。
②根据对角线规则,Si的一些化学性质与___________ (填短周期元素名称)相似。
(2)第二代太阳能电池是薄膜太阳能电池,如砷化镓电池。
①原子半径:Ga___________ As(填“大于”或“小于”,下同),第一电离能:Ga___________ As。
② 分子含有
分子含有___________ (填“ 键”或“
键”或“ 键”),As的最高价氧化物的化学式为
键”),As的最高价氧化物的化学式为___________ 。
③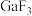 的熔点约为1000℃,
的熔点约为1000℃, 的熔点为77.9℃,其原因是
的熔点为77.9℃,其原因是___________ 。
④Ga、F、Cl的电负性由大到小的顺序为___________ 。
(3)第三代太阳能电池—钙钛矿型太阳能电池,它利用有机金属卤化物(组成为 、
、 和有机碱离子
和有机碱离子 )作为吸光材料,其晶胞结构如图所示。
)作为吸光材料,其晶胞结构如图所示。

①该有机碱离子中,C、N原子的杂化轨道类型分别为___________ 、___________ 。
②若晶胞参数为apm,则晶体密度为___________  。(阿伏加德罗常数的值为
。(阿伏加德罗常数的值为 ,列出计算式)
,列出计算式)
(1)第一代太阳能电池为硅基太阳能电池,其中以单晶硅太阳能电池的转化效率最高,技术最为成熟,应用最为广泛。
①在基态Si原子中,电子占据的最高能层符号为
②根据对角线规则,Si的一些化学性质与
(2)第二代太阳能电池是薄膜太阳能电池,如砷化镓电池。
①原子半径:Ga
②
 分子含有
分子含有 键”或“
键”或“ 键”),As的最高价氧化物的化学式为
键”),As的最高价氧化物的化学式为③
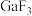 的熔点约为1000℃,
的熔点约为1000℃, 的熔点为77.9℃,其原因是
的熔点为77.9℃,其原因是④Ga、F、Cl的电负性由大到小的顺序为
(3)第三代太阳能电池—钙钛矿型太阳能电池,它利用有机金属卤化物(组成为
 、
、 和有机碱离子
和有机碱离子 )作为吸光材料,其晶胞结构如图所示。
)作为吸光材料,其晶胞结构如图所示。
①该有机碱离子中,C、N原子的杂化轨道类型分别为
②若晶胞参数为apm,则晶体密度为
 。(阿伏加德罗常数的值为
。(阿伏加德罗常数的值为 ,列出计算式)
,列出计算式)
您最近一年使用:0次



