山东省德州市齐河县第一中学2020-2021学年高二下学期期中考试化学试题
山东
高二
期中
2021-06-14
359次
整体难度:
容易
考查范围:
物质结构与性质、常见无机物及其应用
山东省德州市齐河县第一中学2020-2021学年高二下学期期中考试化学试题
山东
高二
期中
2021-06-14
359次
整体难度:
容易
考查范围:
物质结构与性质、常见无机物及其应用
一、单选题 添加题型下试题
单选题
|
容易(0.94)
名校
您最近一年使用:0次
2020-09-15更新
|
286次组卷
|
4卷引用:辽宁省辽阳市2021届高三9月联考化学试题
单选题
|
较易(0.85)
名校
2. 下列各基态原子或离子的电子排布式书写错误的是
| A.K:1s22s22p63s23p6 | B.F:1s22s22p5 |
| C.Mg2+:1s22s22p6 | D.O2-:1s22s22p6 |
您最近一年使用:0次
2021-04-30更新
|
428次组卷
|
4卷引用:山东省德州市2020-2021学年高二下学期期中考试化学试题
山东省德州市2020-2021学年高二下学期期中考试化学试题山东省德州市齐河县第一中学2020-2021学年高二下学期期中考试化学试题(已下线)第1.1.2讲 构造原理与电子排布式 电子云与原子轨道-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)山东省菏泽第一中学2022-2023学年高二上学期12月月考化学试题
单选题
|
较易(0.85)
名校
您最近一年使用:0次
单选题
|
容易(0.94)
名校
解题方法
您最近一年使用:0次
2020-09-15更新
|
181次组卷
|
3卷引用:辽宁省辽阳市2021届高三9月联考化学试题
单选题
|
较易(0.85)
名校
解题方法
您最近一年使用:0次
2021-04-30更新
|
209次组卷
|
4卷引用:山东省德州市2020-2021学年高二下学期期中考试化学试题
山东省德州市2020-2021学年高二下学期期中考试化学试题甘肃省武威第十八中学2020-2021学年高二下学期期中考试化学试题山东省德州市齐河县第一中学2020-2021学年高二下学期期中考试化学试题(已下线)作业06 物质的聚集状态与晶体的常识-2021年高二化学暑假作业(人教版2019)
单选题
|
较易(0.85)
名校
解题方法
6. 下列比较错误的是
| A.离子半径:r(Li+)>r(H-) |
| B.键能:C—C >C—Si |
| C.键长:N—N >N=N |
| D.H2O与CH4分子中的键角:CH4>H2O |
【知识点】 共价键对分子构型、性质的影响 键能、键长、键角及应用解读
您最近一年使用:0次
2020-09-15更新
|
284次组卷
|
6卷引用:辽宁省辽阳市2021届高三9月联考化学试题
单选题
|
较易(0.85)
名校
7. 某元素X的逐级电离能如图所示,下列说法正确的是( )
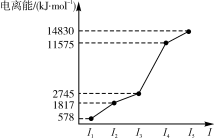
| A.X元素的常见价态为+4价 |
| B.X不可能为金属元素 |
| C.X一定为第五周期元素 |
| D.X与氧气反应时最可能生成的阳离子为X3+ |
【知识点】 电离能
您最近一年使用:0次
2019-12-04更新
|
126次组卷
|
4卷引用:专题11.1 原子结构与性质(讲)-《2020年高考一轮复习讲练测》
(已下线)专题11.1 原子结构与性质(讲)-《2020年高考一轮复习讲练测》山东省德州市2020-2021学年高二下学期期中考试化学试题山东省德州市齐河县第一中学2020-2021学年高二下学期期中考试化学试题山东省乳山市银滩高级中学2022-2023学年高一下学期3月月考化学试题
单选题
|
适中(0.65)
名校
8. 短周期主族元素W、X、Y、Z的原子序数依次增大,基态W的原子2p轨道处于半充满状态,基态X的原子的2p能级上只有一对成对电子,基态Y的原子的最外层电子运动状态只有1种,元素Z与X同主族。下列说法错误的是
| A.第一电离能:W>X>Y | B.电负性:Y>W>Z |
| C.简单离子半径:Z>X>Y | D.最简单氢化物的沸点:X>W>Z |
【知识点】 物质结构与性质综合考查解读 电子排布式解读
您最近一年使用:0次
2021-04-30更新
|
501次组卷
|
11卷引用:山东省德州市2020-2021学年高二下学期期中考试化学试题
山东省德州市2020-2021学年高二下学期期中考试化学试题山东省德州市齐河县第一中学2020-2021学年高二下学期期中考试化学试题河南省辉县市一中2020-2021学年高二下学期第二次阶段性考试化学试题广东省江门市第二中学2021-2022学年高二下学期期中考试化学试题山东省菏泽第一中学2022-2023学年高二上学期12月月考化学试题 山东省乳山市银滩高级中学2022-2023学年高一下学期3月月考化学试题广东省江门市新会陈经纶中学2022-2023学年高二下学期期中考试化学试题广东省龙川县第一中学2022-2023学年高二下学期4月期中考试化学试题广东省湛江市第二中学2021-2022学年高二下学期第17周(6.11)周练化学试题重庆市石柱中学校2022-2023学年高二下学期第二次月考化学试题内蒙古赤峰第四中学2020-2021学年高二下学期期中考试化学试题
单选题
|
适中(0.65)
名校
解题方法
9. 已知短周期元素的离子aA2+、bB+、cC3-、dD-具有相同的电子层结构。则下列叙述正确的是
| A.金属性:A>B;非金属性:C>D |
| B.元素的第一电离能:D>C>A>B |
| C.C、D的最高价氧化物对应的水化物均为强酸 |
| D.原子序数:d>c>b>a |
【知识点】 具有相同结构的多种离子的性质相关分析及判断解读
您最近一年使用:0次
2020-08-03更新
|
154次组卷
|
3卷引用:辽宁省辽阳市2019-2020学年高二下学期期末考试化学试题
单选题
|
适中(0.65)
名校
10. 将Na2O2、SiO2、KCl、Al、冰分别加热熔化,需要克服的作用力类型相同的物质有
| A.2种 | B.3种 | C.4种 | D.5种 |
【知识点】 化学键与分子间作用力解读 晶体类型判断解读
您最近一年使用:0次
2021-04-30更新
|
162次组卷
|
3卷引用:山东省德州市2020-2021学年高二下学期期中考试化学试题
单选题
|
较易(0.85)
名校
11. 下列分子或离子中,立体构型不是平面三角形的是
| A.CO32- | B.NH3 | C.BF3 | D.SO3 |
【知识点】 利用杂化轨道理论判断分子的空间构型解读
您最近一年使用:0次
2017-04-27更新
|
300次组卷
|
4卷引用:河北省正定中学2016-2017学年高二下学期第二次月考(期中)化学试题
二、多选题 添加题型下试题
多选题
|
较易(0.85)
名校
12. 关于金属元素的特征,下列叙述正确的是
| A.金属元素的原子只有还原性,离子只有氧化性 |
| B.金属元素在化合物中一般显正价 |
| C.金属性越强的元素相应的离子氧化性越弱 |
| D.价电子越多的金属原子的金属性越强 |
您最近一年使用:0次
2021-04-30更新
|
248次组卷
|
4卷引用:山东省德州市2020-2021学年高二下学期期中考试化学试题
多选题
|
较易(0.85)
名校
解题方法
13. 德国科学家发现新配方:他使用了远古地球上存在的O2、N2、CH3、NH3、H2O和HCN,再使用硫醇和铁盐等物质合成RNA的四种基本碱基。下列说法正确的是
| A.基态Fe3+价电子排布为:3d5 |
| B.O2、N2、HCN中均存在σ键和π键 |
| C.CH4、NH3、H2O分子间均存在氢键 |
| D.沸点:C2H5SH(乙硫醇)>C2H5OH |
您最近一年使用:0次
2020-09-15更新
|
321次组卷
|
7卷引用:辽宁省辽阳市2021届高三9月联考化学试题
辽宁省辽阳市2021届高三9月联考化学试题(已下线)第02章 微粒间相互作用与物质性质 (A卷基础强化篇)-2020-2021学年高二化学同步单元AB卷(鲁科版2019选择性必修2)山东省德州市2020-2021学年高二下学期期中考试化学试题山东省德州市齐河县第一中学2020-2021学年高二下学期期中考试化学试题新疆生产建设兵团第六师芳草湖农场中学2021-2022学年高二上学期期末考试化学试题山东省菏泽第一中学2022-2023学年高二上学期12月月考化学试题 山东省乳山市银滩高级中学2022-2023学年高一下学期3月月考化学试题
14. A、B、C三种元素原子的最外层电子排布分别为3s1、2s22p3和2s22p4,由这三种元素组成的化合物的化学式可能是
| A.ABC3 | B.A2BC4 | C.ABC2 | D.A2BC3 |
您最近一年使用:0次
2021-04-30更新
|
285次组卷
|
7卷引用:山西省临汾第一中学等五校2017-2018学年高二上学期期末联考化学试题
山西省临汾第一中学等五校2017-2018学年高二上学期期末联考化学试题第1章 原子结构——C挑战区 模拟高考(鲁科版选修3)山东省德州市2020-2021学年高二下学期期中考试化学试题山东省德州市齐河县第一中学2020-2021学年高二下学期期中考试化学试题(已下线)1.1.2 构造原理与电子排布式(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)海南省五指山中学2021-2022学年高二下学期期中考试化学试题1.2.2核外电子排布与元素周期表(课中)-鲁科版选择性必修2
三、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
15. 下列有关说法正确的是
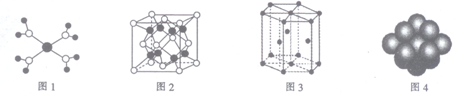

| A.水合铜离子的模型如图1所示,1个水合铜离子中含有4个配位键 |
| B.K2O晶体的晶胞如图2所示,每个K2O晶胞平均占有8个O2- |
| C.金属Zn中Zn原子堆积模型如图3所示,空间利用率为68% |
| D.金属Cu中Cu原子堆积模型如图4所示,为面心立方最密堆积,每个Cu原子的配位数均为8 |
您最近一年使用:0次
2016-08-11更新
|
512次组卷
|
10卷引用:2015-2016学年山西省临汾一中高二下期末化学试卷
2015-2016学年山西省临汾一中高二下期末化学试卷河北省正定中学2016-2017学年高二下学期第二次月考(期中)化学试题河北省邢台市2016-2017学年高二下学期第二次月考化学试题四川省成都外国语学校2017-2018学年高二下学期期中考试化学试题成都外国语学校2017-2018学年高二下学期期中考试化学试题山东省德州市2020-2021学年高二下学期期中考试化学试题山东省德州市齐河县第一中学2020-2021学年高二下学期期中考试化学试题宁夏银川市第六中学2020-2021学年高二下学期期末考试化学试题新疆乌鲁木齐市第八中学2021-2022学年高二下学期期中考试化学试题云南省玉龙县第一中学2021-2022学年高二下学期3月份考试化学试题
四、解答题 添加题型下试题
解答题-无机推断题
|
适中(0.65)
名校
解题方法
16. A、B、C、D、E、F为原子序数依次增大的短周期主族元素。其中A与其他元素均不同周期;B的最外层电子数是其内层电子总数的2倍;由C、D组成的化合物D2C和D2C2均为离子晶体;E的内层电子数总和是其最外层电子数的5倍;基态F原子3p轨道上有2个未成对电子且其单质的晶体属于分子晶体。回答下列问题:
(1)基态F的价电子排布式为______ ;D位于第______ 周期______ 族。
(2)与E同周期的元素中,第一电离能小于E的元素有______ (填元素符号)。
(3)BC2分子中,B原子的轨道杂化类型为______ ,BC2属于______ (填“极性”或“非极性”)分子;A2C、A2F中沸点更高的是______ (填化学式),原因是______ ;D与氯元素形成的化合物DCl的熔点比B的氯化物BCl4的熔点高,原因是______ 。
(1)基态F的价电子排布式为
(2)与E同周期的元素中,第一电离能小于E的元素有
(3)BC2分子中,B原子的轨道杂化类型为
您最近一年使用:0次
2021-04-30更新
|
163次组卷
|
2卷引用:山东省德州市2020-2021学年高二下学期期中考试化学试题
解答题-结构与性质
|
适中(0.65)
名校
解题方法
17. 快离子导体是一类具有优良离子导电能力的固体电解质,研究得最多的是Ag、Cu、Li、Na、F、O等的快离子导体。
(1)Cu-e-=Cu+的过程中,失去的电子是基态Cu中______ 轨道上的电子。
(2)N、O、F的第一电离能从小到大的顺序为______ (用元素符号表示);NH3、H2O、HF的沸点由低到高的顺序为______ (用化学式表示,下同),其中NH3、H2O的键角由小到大的顺序为______ 。
(3)二乙二胺合铜配离子{[Cu(H2NCH2CH2NH2)2]2+}的结构如图1,1mol该配合物中所含的配位键为______ mol。

(4)Li3SBF4是潜在的快离子导体,其晶胞结构如图2,A原子的坐标为______ ;若在运算建立该晶体的模型过程中,晶胞中部分BF 被Cl-取代后得到的晶胞结构如图3所示,则得到的晶体的化学式为
被Cl-取代后得到的晶胞结构如图3所示,则得到的晶体的化学式为______ 。

(1)Cu-e-=Cu+的过程中,失去的电子是基态Cu中
(2)N、O、F的第一电离能从小到大的顺序为
(3)二乙二胺合铜配离子{[Cu(H2NCH2CH2NH2)2]2+}的结构如图1,1mol该配合物中所含的配位键为

(4)Li3SBF4是潜在的快离子导体,其晶胞结构如图2,A原子的坐标为
 被Cl-取代后得到的晶胞结构如图3所示,则得到的晶体的化学式为
被Cl-取代后得到的晶胞结构如图3所示,则得到的晶体的化学式为
您最近一年使用:0次
2021-04-30更新
|
128次组卷
|
2卷引用:山东省德州市2020-2021学年高二下学期期中考试化学试题
解答题-结构与性质
|
适中(0.65)
名校
解题方法
18. 铬、镍等过渡元素的单质、化合物在工业上有广泛的应用。
(1)基态镍原子核外共有______ 种不同的能量的电子,3d能级上的未成对电子数为______ 。
(2)Cu和Cr位于同一周期。
①向CuSO4溶液中逐滴加入氨水,可得深蓝色晶体[Cu(NH3)4]SO4·H2O,其中心离子是______ (填元素符号),配体是______ ,SO 的几何构型为
的几何构型为______ 。
②Cr元素所在周期中金属原子第一电离能最大的是______ (填元素符号,下同)。
③Cr元素所在周期中原子电负性最大的是______ (不考虑零族元素)。
(3)过渡金属单质及其化合物是有机合成反应的重要催化剂。
例如: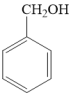

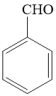 。
。
①苯甲醇分子中的碳原子的杂化类型分别是______ 、______ 。
②苯甲醇、苯甲醛的沸点依次为206℃、179℃,造成二者沸点差异的主要原因是______ 。
(1)基态镍原子核外共有
(2)Cu和Cr位于同一周期。
①向CuSO4溶液中逐滴加入氨水,可得深蓝色晶体[Cu(NH3)4]SO4·H2O,其中心离子是
 的几何构型为
的几何构型为②Cr元素所在周期中金属原子第一电离能最大的是
③Cr元素所在周期中原子电负性最大的是
(3)过渡金属单质及其化合物是有机合成反应的重要催化剂。
例如:


 。
。①苯甲醇分子中的碳原子的杂化类型分别是
②苯甲醇、苯甲醛的沸点依次为206℃、179℃,造成二者沸点差异的主要原因是
您最近一年使用:0次
2021-05-11更新
|
150次组卷
|
3卷引用:山东省德州市2020-2021学年高二下学期期中考试化学试题
五、填空题 添加题型下试题
填空题
|
较易(0.85)
名校
19. 磷酸盐几乎是所有食物的天然成分之一,作为重要的食品配料和功能添加剂被广泛用于食品加工中。在食品加工中使用的磷酸盐通常为钠盐、钙盐、钾盐以及作为营养强化剂的铁盐和锌盐。天然存在的磷酸盐是磷矿石[主要成分为Ca3(PO4)2,同时还有SiO2等],用硫酸跟磷矿石反应,能生成被植物吸收的Ca(H2PO4)2。
回答下列问题:
(1)金属铁可导电、导热,具有金属光泽,有延展性,这些性质都可以用______ “理论”解释。
(2)SiO2硬而脆,其原因是______ 。
(3)Ca、Fe、K、Zn的第一电离能由大到小的顺序为______ 。
(4)O、Si、P、S四种元素形成的最简单氢化物的稳定性最强的是______ (填化学式);P4难溶于水却易溶于CS2,其原因为______ 。
(5)PO 的空间构型为
的空间构型为______ ,酸性条件下,PO 可与Fe3+形成H3[Fe(PO4)2]从而掩蔽溶液中的Fe3+,基态Fe3+核外M层有
可与Fe3+形成H3[Fe(PO4)2]从而掩蔽溶液中的Fe3+,基态Fe3+核外M层有______ 种空间运动状态不同的电子。
回答下列问题:
(1)金属铁可导电、导热,具有金属光泽,有延展性,这些性质都可以用
(2)SiO2硬而脆,其原因是
(3)Ca、Fe、K、Zn的第一电离能由大到小的顺序为
(4)O、Si、P、S四种元素形成的最简单氢化物的稳定性最强的是
(5)PO
 的空间构型为
的空间构型为 可与Fe3+形成H3[Fe(PO4)2]从而掩蔽溶液中的Fe3+,基态Fe3+核外M层有
可与Fe3+形成H3[Fe(PO4)2]从而掩蔽溶液中的Fe3+,基态Fe3+核外M层有
您最近一年使用:0次
2021-05-11更新
|
182次组卷
|
3卷引用:山东省德州市2020-2021学年高二下学期期中考试化学试题
六、解答题 添加题型下试题
解答题-结构与性质
|
适中(0.65)
名校
解题方法
20. 硒化物(如KCu4Se8)可用于太阳能电池、光传感器、热电发电与制冷等。回答下列问题:
(1)K与Cu位于同周期,金属钾的熔点比铜的低,这是因为______ 。
(2)O、S、Se均位于元素周期表第ⅥA族,它们的氢化物H2O、H2S及H2Se分子的键角从大到小顺序为______ 。
(3)配合物[Cu(CH3CN)4]BF4中,阴离子的空间构型为______ ,配合离子中与Cu(Ⅱ)形成配位键的原子是______ ,配体中碳原子的杂化方式是______ 。
(4)TMTSF(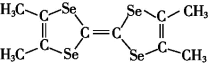 )中共价键的类型是
)中共价键的类型是______ 。
(5)Cu、Sb、Se组成的热电材料,其晶胞结构如图所示,a=b=566pm,c=1128pm,该晶体的密度为______ g·cm-3。
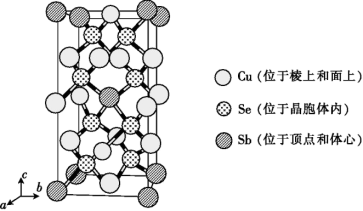
(1)K与Cu位于同周期,金属钾的熔点比铜的低,这是因为
(2)O、S、Se均位于元素周期表第ⅥA族,它们的氢化物H2O、H2S及H2Se分子的键角从大到小顺序为
(3)配合物[Cu(CH3CN)4]BF4中,阴离子的空间构型为
(4)TMTSF(
 )中共价键的类型是
)中共价键的类型是(5)Cu、Sb、Se组成的热电材料,其晶胞结构如图所示,a=b=566pm,c=1128pm,该晶体的密度为

您最近一年使用:0次
2021-05-11更新
|
127次组卷
|
2卷引用:山东省德州市2020-2021学年高二下学期期中考试化学试题
试卷分析
整体难度:适中
考查范围:物质结构与性质、常见无机物及其应用
试卷题型(共 20题)
题型
数量
单选题
12
多选题
3
解答题
4
填空题
1
试卷难度
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.94 | 晶体与非晶体 | |
| 2 | 0.85 | 电子排布式 | |
| 3 | 0.85 | 简单配合物的成键 | |
| 4 | 0.94 | 焰色试验 电离能变化规律 | |
| 5 | 0.85 | 晶胞的有关计算 | |
| 6 | 0.85 | 共价键对分子构型、性质的影响 键能、键长、键角及应用 | |
| 7 | 0.85 | 电离能 | |
| 8 | 0.65 | 物质结构与性质综合考查 电子排布式 | |
| 9 | 0.65 | 具有相同结构的多种离子的性质相关分析及判断 | |
| 10 | 0.65 | 化学键与分子间作用力 晶体类型判断 | |
| 11 | 0.85 | 利用杂化轨道理论判断分子的空间构型 | |
| 15 | 0.65 | 配合物的概念、组成及形成条件 根据晶胞结构确定晶体化学式 晶胞的有关计算 金属晶体原子堆积模型 | |
| 二、多选题 | |||
| 12 | 0.85 | 金属元素原子结构与化学性质 常见金属的活动性顺序及其应用 | |
| 13 | 0.85 | 电子排布式 共价键的形成及主要类型 含有氢键的物质 | |
| 14 | 0.85 | 电子排布式 | |
| 三、解答题 | |||
| 16 | 0.65 | 根据原子结构进行元素种类推断 电离能变化规律 氢键对物质性质的影响 晶体的类型与物质熔点、硬度、导电性的关系 | 无机推断题 |
| 17 | 0.65 | 物质结构与性质综合考查 电离能变化规律 氢键对物质性质的影响 晶胞的有关计算 | 结构与性质 |
| 18 | 0.65 | 电离能变化规律 利用杂化轨道理论判断化学键杂化类型 简单配合物的成键 氢键对物质性质的影响 | 结构与性质 |
| 20 | 0.65 | 物质结构与性质综合考查 元素性质与电负性的关系 利用杂化轨道理论判断化学键杂化类型 晶胞的有关计算 | 结构与性质 |
| 四、填空题 | |||
| 19 | 0.85 | 电离能变化规律 相似相溶原理及应用 金属键 共价晶体的物理性质 | |








