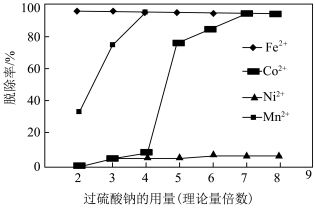
1 . 湿法炼锌的主要工序有焙烧、浸出、净化和电积,浸出后获得大量的含Zn、Co、Ni、Fe、Mn、Cd等金属的钴镍渣,为有效回收钴镍渣中的有价金属,设计如图所示的工艺流程:___________ (填1条即可)。“酸溶”时却不宜采用加热的方法来加快反应速率,其原因是___________ 。
(2)“氧化分离”时,过硫酸钠的用量与溶液中金属离子的脱除率的关系如图所示。___________ (填字母)倍。
a.2~3 b.4~5 c.7~8
(3)滤渣1中主要含MnO2、_______ ,写出生成MnO2的离子方程式:_________ 。
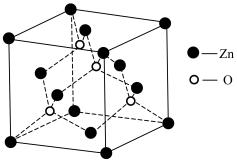
(4)由碱式碳酸锌可制备ZnO,ZnO的晶胞结构如图,则锌的配位数为___________ ;已知晶胞参数为acm,该晶体的密度为___________ g∙cm-3 (列出计算式,阿伏加德罗常数的值为NA)。
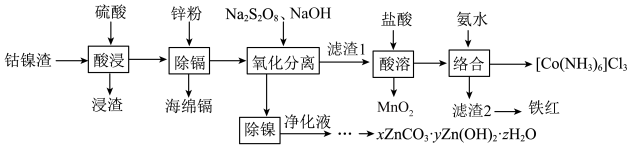
(2)“氧化分离”时,过硫酸钠的用量与溶液中金属离子的脱除率的关系如图所示。
①氧化剂Na2S2O8的阴离子结构为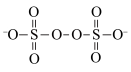 ,其中硫元素化合价为
,其中硫元素化合价为
a.2~3 b.4~5 c.7~8
(3)滤渣1中主要含MnO2、
(4)由碱式碳酸锌可制备ZnO,ZnO的晶胞结构如图,则锌的配位数为
您最近一年使用:0次
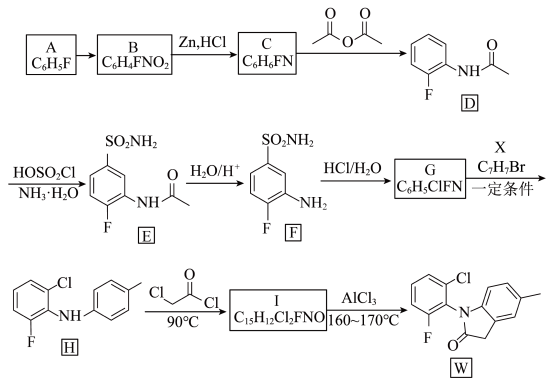
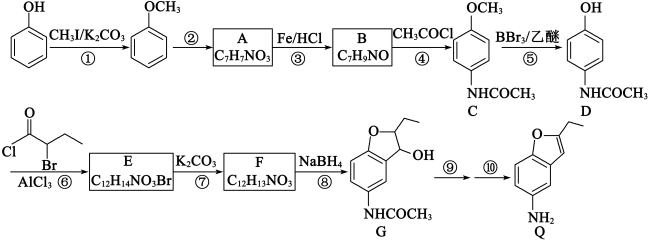
2 . 化合物W是合成风湿性关节炎药物罗美昔布的一种中间体,合成路线如下图:
(1)A的化学名称是_______ 。
(2)B→C的反应类型是_______ ,G→H的反应类型是_______ 。
(3)写出X的结构简式_______ 。
(4)C→D反应的另一产物中碳原子的杂化类型是_______ 。
(5)化合物G的官能团名称是_______ 。
(6)写出I→W的化学反应方程式_______ 。
(7)和物质G有相同的分子式且属于芳香族化合物的同分异构体还有_______ 种,其中只有一个支链的物质的结构简式_______ 。
(ⅰ) ;
;
(ⅱ) 。
。
(1)A的化学名称是
(2)B→C的反应类型是
(3)写出X的结构简式
(4)C→D反应的另一产物中碳原子的杂化类型是
(5)化合物G的官能团名称是
(6)写出I→W的化学反应方程式
(7)和物质G有相同的分子式且属于芳香族化合物的同分异构体还有
您最近一年使用:0次
名校
3 . 硅与储及其化合物在医药、生产、生活中有着重要的作用。回答下列问题:
(1)某铁的配合物结构如图所示,可由 与
与 混合加热制得。
混合加热制得。_______ 区。C、O、H三种元素的电负性从大到小的顺序为_______ 。
②配位体CO分子中碳元素提供孤电子对的原因:_______ 。铁的配合物中碳元素的杂化方式共有_______ 种。
③在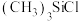 、
、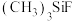 、
、 中,
中,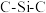 键角最大的是
键角最大的是_______ 。
(2)硅和卤素单质反应可以得到SiX4,SiX4的熔沸点如下表(已知:绝对零度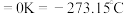 ):
):
0℃时,SiF4、SiCl4、SiBr4、SiI4呈液态的是_______ (填化学式),沸点依次升高的原因是_______ ,气态SiX4分子的空间结构是_______ 。
(3)一种含锗的化合物应用于太阳能电池,其晶胞为长方体,结构如图(a):_______ (填“b”“c”或“d”)图也能表示此化合物的晶胞。
②已知晶胞(a)密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为_______ (用含x、y、z和ρ的式子表示)。
(1)某铁的配合物结构如图所示,可由
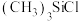 与
与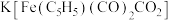 混合加热制得。
混合加热制得。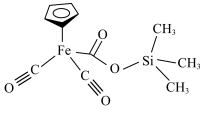
②配位体CO分子中碳元素提供孤电子对的原因:
③在
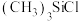 、
、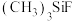 、
、 中,
中,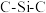 键角最大的是
键角最大的是(2)硅和卤素单质反应可以得到SiX4,SiX4的熔沸点如下表(已知:绝对零度
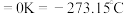 ):
):| SiF4 | SiCl4 | SiBr4 | SiI4 | |
| 熔点/K | 183.0 | 203.2 | 278.6 | 393.7 |
| 沸点/K | 187.2 | 330.8 | 427.2 | 560.7 |
(3)一种含锗的化合物应用于太阳能电池,其晶胞为长方体,结构如图(a):
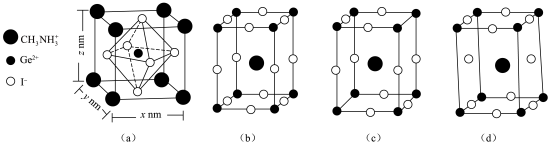
②已知晶胞(a)密度为
 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为
您最近一年使用:0次
2024-05-31更新
|
59次组卷
|
2卷引用:山西省运城市三晋卓越联盟2023-2024学年高二下学期期中考试化学试题
名校
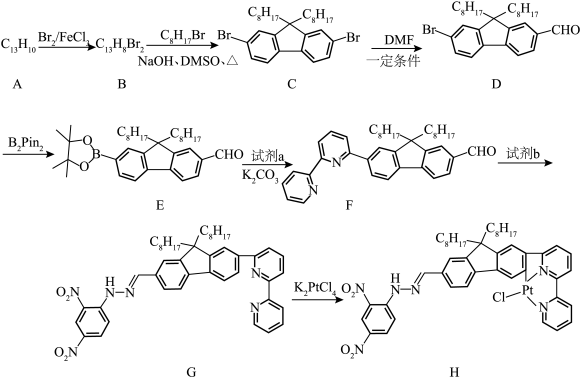
4 . 二联吡啶铂(Ⅱ)配合物(H)在传感器中有重要应用,一种合成路线如图。回答下列问题: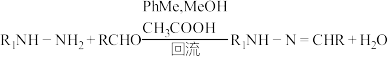
(1)有机物 的官能团的名称为
的官能团的名称为__________ 。
(2)写出 的反应方程式:
的反应方程式:______________ ,该反应的反应类型为__________ 。
(3)试剂 的结构简式为
的结构简式为__________ 。
(4)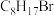 的同分异构体有多种,其中含有两个甲基的结构有
的同分异构体有多种,其中含有两个甲基的结构有__________ 种。
(5)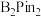 的结构为
的结构为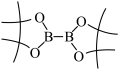 ,可由频哪醇(
,可由频哪醇(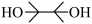 )和四(二甲氨基)二硼合成制得,频哪醇在浓硫酸作用下,加热,可制得分子式为
)和四(二甲氨基)二硼合成制得,频哪醇在浓硫酸作用下,加热,可制得分子式为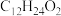 的物质,写出其结构:
的物质,写出其结构:__________ 。
(6)请从物质结构角度分析有机物 能与
能与 反应的原因:
反应的原因:______________ 。
(7)下列关于有机物 的说法错误的是__________(填标号)。
的说法错误的是__________(填标号)。
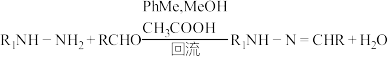
(1)有机物
 的官能团的名称为
的官能团的名称为(2)写出
 的反应方程式:
的反应方程式:(3)试剂
 的结构简式为
的结构简式为(4)
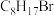 的同分异构体有多种,其中含有两个甲基的结构有
的同分异构体有多种,其中含有两个甲基的结构有(5)
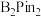 的结构为
的结构为 ,可由频哪醇(
,可由频哪醇( )和四(二甲氨基)二硼合成制得,频哪醇在浓硫酸作用下,加热,可制得分子式为
)和四(二甲氨基)二硼合成制得,频哪醇在浓硫酸作用下,加热,可制得分子式为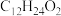 的物质,写出其结构:
的物质,写出其结构:(6)请从物质结构角度分析有机物
 能与
能与 反应的原因:
反应的原因:(7)下列关于有机物
 的说法错误的是__________(填标号)。
的说法错误的是__________(填标号)。A. 的配位数为4 的配位数为4 | B.含有手性碳原子 |
C. 原子的杂化方式为 原子的杂化方式为 | D.存在由 轨道“头碰头”形成的 轨道“头碰头”形成的 键 键 |
您最近一年使用:0次
2024-05-30更新
|
176次组卷
|
4卷引用:2024届山西省晋城市高三下学期第三次模拟考试理科综合试题-高中化学
名校
解题方法
5 . BAY-069是目前体外活性最强的支链氨基酸转氨酶抑制剂,对治疗肺癌有关键作用,下面是合成它的路线。
(1)A→B的化学方程式为_______ 。
(2)B中官能团名称是_______ 、_______ 。
(3)NBS中氮原子的杂化轨道类型为_______ 。
(4)D的名称是_______ 。
(5)G的结构简式为_______ 。
(6)F→G、G→H的反应类型分别为_______ 、_______ 。
(7)B的含有萘环结构,官能团也相同的同分异构体有_______ 种。
(8)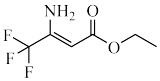 中有
中有_______ 种核磁共振氢谱峰,该物质存在顺反异构体,写出其异构体的结构简式_______ 。
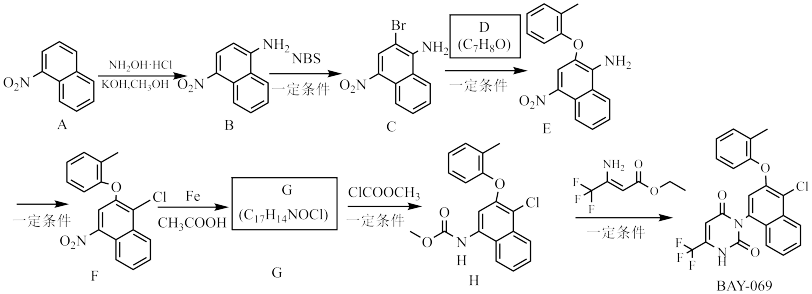
已知:NBS为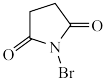 。
。
(1)A→B的化学方程式为
(2)B中官能团名称是
(3)NBS中氮原子的杂化轨道类型为
(4)D的名称是
(5)G的结构简式为
(6)F→G、G→H的反应类型分别为
(7)B的含有萘环结构,官能团也相同的同分异构体有
(8)
 中有
中有
您最近一年使用:0次
名校
6 . 苯、甲苯,乙苯、二甲苯等均是重要的芳香族化合物。回答下列问题:
(1)苯的实验式为___________ 。
(2)1mol苯与3molH2发生加成反应,碳的杂化类型由___________ ,转化为___________ 。
(3)甲苯的一氯代物有___________ 种,由甲苯制备2,4,6-三硝基甲苯(TNT)的化学方程式为___________ 。
(4)向对二甲苯中加入足量酸性高锰酸钾溶液,生成的有机物中的官能团名称___________ 。
(5)如图是某同学设计的制取少量溴苯(熔点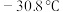 ,沸点
,沸点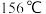 )的装置。实验时,打开K,向圆底烧瓶中滴加苯和溴的混合液,发现a中有微沸现象,b中的液体逐渐变为浅红色,c中有少量气泡产生,反应结束后,对a中的液体进行后续处理即可获得溴苯。
)的装置。实验时,打开K,向圆底烧瓶中滴加苯和溴的混合液,发现a中有微沸现象,b中的液体逐渐变为浅红色,c中有少量气泡产生,反应结束后,对a中的液体进行后续处理即可获得溴苯。___________ 。
②该实验___________ (填“放热”或“吸热”)。
③c中看到的现象证明___________ 。
④得到粗溴苯后,用如下操作进行精制:
①水洗 ②蒸馏 ③用干燥剂干燥 ④10%NaOH溶液洗
正确的操作顺序是___________ (填序号)。
A.①②③④② B.②④②③① C.④①③①② D.①④①③②
⑤进行蒸馏操作中,仪器选择及安装(夹持及加热装置已省略)均正确的是___________ (填字母)。
(1)苯的实验式为
(2)1mol苯与3molH2发生加成反应,碳的杂化类型由
(3)甲苯的一氯代物有
(4)向对二甲苯中加入足量酸性高锰酸钾溶液,生成的有机物中的官能团名称
(5)如图是某同学设计的制取少量溴苯(熔点
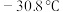 ,沸点
,沸点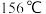 )的装置。实验时,打开K,向圆底烧瓶中滴加苯和溴的混合液,发现a中有微沸现象,b中的液体逐渐变为浅红色,c中有少量气泡产生,反应结束后,对a中的液体进行后续处理即可获得溴苯。
)的装置。实验时,打开K,向圆底烧瓶中滴加苯和溴的混合液,发现a中有微沸现象,b中的液体逐渐变为浅红色,c中有少量气泡产生,反应结束后,对a中的液体进行后续处理即可获得溴苯。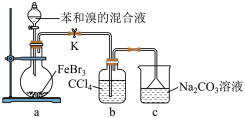
②该实验
③c中看到的现象证明
④得到粗溴苯后,用如下操作进行精制:
①水洗 ②蒸馏 ③用干燥剂干燥 ④10%NaOH溶液洗
正确的操作顺序是
A.①②③④② B.②④②③① C.④①③①② D.①④①③②
⑤进行蒸馏操作中,仪器选择及安装(夹持及加热装置已省略)均正确的是
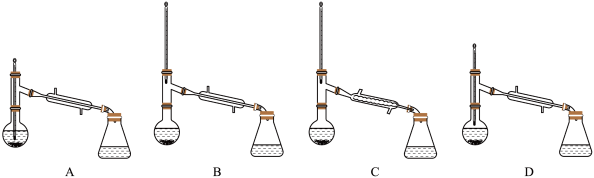
您最近一年使用:0次
2024-05-21更新
|
207次组卷
|
2卷引用:山西省运城市三晋卓越联盟2023-2024学年高二下学期期中考试化学试题
解题方法
7 . 冶炼金属产生的酸泥属于有价值危险物。从某酸泥(含 单质,
单质, 及
及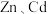 的化合物等)中回收汞和硒的一种工艺如图:
的化合物等)中回收汞和硒的一种工艺如图: 如下表所示:
如下表所示:
回答下列问题:
(1)“氧化浸出”时,酸泥中硒、汞、锌、镉分别以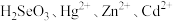 形式进入溶液。
形式进入溶液。
①基态 原子核外电子的运动状态有
原子核外电子的运动状态有_______ 种, 中
中 原子杂化类型为
原子杂化类型为_______ 。
②不溶于水的 被氧化的离子方程式为
被氧化的离子方程式为_______ 。
(2)沉汞后液中磷以最高价形式存在。“还原沉汞”的主要反应中,氧化剂和还原剂的物质的量之比为_____ , 加入量对沉汞效果的影响如下表所示,则其最适宜加入量是汞量的
加入量对沉汞效果的影响如下表所示,则其最适宜加入量是汞量的_____ 倍。
(3)①“沉硒”时“气液逆流”的目的是_______ 。
②已知: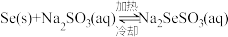 ,粗硒中的杂质不溶于
,粗硒中的杂质不溶于 溶液。利用该原理对粗硒进行提纯:将粗硒投入
溶液。利用该原理对粗硒进行提纯:将粗硒投入______ 中,待硒充分溶解后_____ ,冷却析出硒,再过滤、洗涤、干燥。
(4)为使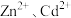 完全沉淀,“中和”时需调节溶液的
完全沉淀,“中和”时需调节溶液的 范围为
范围为____ ,所得“中和液”中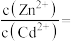
_______ 。
 单质,
单质, 及
及 的化合物等)中回收汞和硒的一种工艺如图:
的化合物等)中回收汞和硒的一种工艺如图: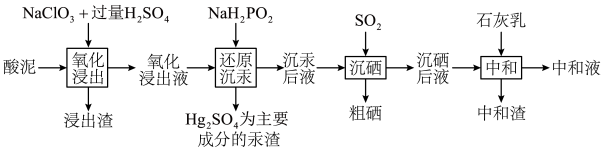
 如下表所示:
如下表所示:| 氢氧化物 |  | |||
开始沉淀 | 完全沉淀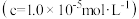 | 沉淀 开始溶解 | 沉淀 完全溶解 | |
 | 8.2 | 9.7 | — | — |
 | 6.5 | 8.0 | 10.5 | 12~13 |
(1)“氧化浸出”时,酸泥中硒、汞、锌、镉分别以
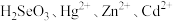 形式进入溶液。
形式进入溶液。①基态
 原子核外电子的运动状态有
原子核外电子的运动状态有 中
中 原子杂化类型为
原子杂化类型为②不溶于水的
 被氧化的离子方程式为
被氧化的离子方程式为(2)沉汞后液中磷以最高价形式存在。“还原沉汞”的主要反应中,氧化剂和还原剂的物质的量之比为
 加入量对沉汞效果的影响如下表所示,则其最适宜加入量是汞量的
加入量对沉汞效果的影响如下表所示,则其最适宜加入量是汞量的 加入量 加入量 | 沉汞率 | 汞渣含 | 沉硒率 |
| 汞量的1.0倍 | 68.42 | 57.80 | 1.23 |
| 汞量的1.25倍 | 85.93 | 66.30 | 1.77 |
| 汞量的1.5倍 | 99.53 | 78.84 | 2.95 |
| 汞量的1.75倍 | 99.70 | 70.80 | 5.23 |
| 汞量的2.0倍 | 99.72 | 60.84 | 6.59 |
(3)①“沉硒”时“气液逆流”的目的是
②已知:
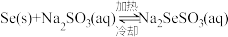 ,粗硒中的杂质不溶于
,粗硒中的杂质不溶于 溶液。利用该原理对粗硒进行提纯:将粗硒投入
溶液。利用该原理对粗硒进行提纯:将粗硒投入(4)为使
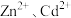 完全沉淀,“中和”时需调节溶液的
完全沉淀,“中和”时需调节溶液的 范围为
范围为
您最近一年使用:0次
8 . 丹皮酚(G)可用于缓解骨关节炎引起的疼痛,过敏性鼻炎以及感冒。一种合成丹皮酚及其衍生物H的合成路线如下:
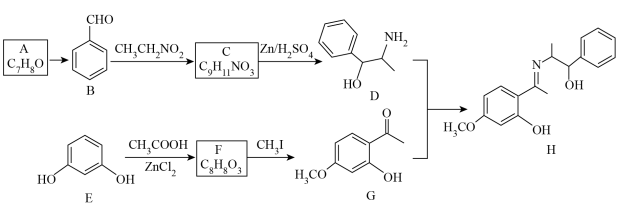
回答下列问题:
(1)E的化学名称为_______ 。
(2)A生成B的反应类型为_______ 。
(3)C的结构简式为_______ 。
(4)D中官能团的名称为_______ 。
(5)H中氮原子的杂化轨道类型为_______ ,手性碳个数为_______ 。
(6)E转变为F的化学方程式为_______ 。
(7)在G的同分异构体中,同时满足下列条件的共有_______ 种(不考虑立体异构);
①与 溶液反应放出
溶液反应放出 ;②与
;②与 溶液显色;③苯环上有两个取代基。其中核磁共振氢谱显示为6组峰,且峰面积比为
溶液显色;③苯环上有两个取代基。其中核磁共振氢谱显示为6组峰,且峰面积比为 的同分异构体的结构简式为
的同分异构体的结构简式为_______ 。

回答下列问题:
(1)E的化学名称为
(2)A生成B的反应类型为
(3)C的结构简式为
(4)D中官能团的名称为
(5)H中氮原子的杂化轨道类型为
(6)E转变为F的化学方程式为
(7)在G的同分异构体中,同时满足下列条件的共有
①与
 溶液反应放出
溶液反应放出 ;②与
;②与 溶液显色;③苯环上有两个取代基。其中核磁共振氢谱显示为6组峰,且峰面积比为
溶液显色;③苯环上有两个取代基。其中核磁共振氢谱显示为6组峰,且峰面积比为 的同分异构体的结构简式为
的同分异构体的结构简式为
您最近一年使用:0次
名校
9 . 化合物Q是一种药物的中间体,可利用如下合成路线制备化合物Q;
(1)有机物A的化学名称为__________ ;有机物C中官能团的名称为__________ 。
(2)反应①中加入 的作用是
的作用是____________________ ;合成路线中设计反应①和⑤目的是____________________ 。反应⑦的化学方程式为______________________________ 。下列关于反应③的说法,错误的是__________ (填标号)。
A.反应前后N原子的杂化方式未发生变化
B.反应类型为还原反应,当生成1molB时转移6mol电子
C.可以利用酸性 溶液鉴别物质A和B
溶液鉴别物质A和B
(3)有机物D的同分异构体中,同时含有苯环和硝基的共__________ 种(考虑立体异构);其中核磁共振氢谱显示含3组吸收峰,且吸收峰面积比为6:2:1的同分异构体的结构简式为__________ 。
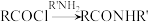
Ⅱ.
(1)有机物A的化学名称为
(2)反应①中加入
 的作用是
的作用是A.反应前后N原子的杂化方式未发生变化
B.反应类型为还原反应,当生成1molB时转移6mol电子
C.可以利用酸性
 溶液鉴别物质A和B
溶液鉴别物质A和B(3)有机物D的同分异构体中,同时含有苯环和硝基的共
您最近一年使用:0次
2024-03-29更新
|
550次组卷
|
3卷引用:2024届山西省朔州市怀仁市第一中学校高三下学期四模理科综合试题-高中化学
解题方法
10 . 新能源汽车在实现可持续发展的环境目标、减少空气的污染问题及应对气候的逐渐恶化中起到了至关重要的作用。锂离子电池使用寿命在5~8年,研究回收废旧正极材料中Li、Ni、Co、Mn等资源可以促进锂离子电池产业的良性发展。下图是一种三元锂电池正极材料的回收工艺。

回答下列问题:
(1)浸取时 中钴元素转化为
中钴元素转化为 ,有机酸用醋酸时反应的离子方程式为
,有机酸用醋酸时反应的离子方程式为___________ 。
(2)浸取时有机酸用苹果酸 比醋酸浸取效果好,苹果酸分子中C原子的杂化类型为
比醋酸浸取效果好,苹果酸分子中C原子的杂化类型为___________ 。
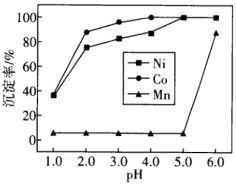
(3) 时溶液中
时溶液中
___________ ;随pH增大, 和
和 的沉淀率增大的原因为
的沉淀率增大的原因为___________ 。
(4)沉锂时生成 ,反应的离子方程式为
,反应的离子方程式为___________ 。
(5)还可以通过电渗析法分离金属离子。硫酸、双氧水浸取后,分三次电渗析可分离成功。下图所示为第一次电渗析分离 的工艺,离子交换膜B为
的工艺,离子交换膜B为___________ (填“阴”或“阳”)离子交换膜。第二次用同样方法分离 ,第三次直接对剩余溶液电渗析分离,且需要将C改为一价阳离子交换膜。由上述分离过程可推测,
,第三次直接对剩余溶液电渗析分离,且需要将C改为一价阳离子交换膜。由上述分离过程可推测, 、
、 、
、 中与
中与 反应最难的为
反应最难的为___________ , 在
在___________ 膜(填“AB”、“BC”或“CD”)之间获得。


已知:①正极材料主要成分可以表示为 (M:Ni、Co、Mn)。
(M:Ni、Co、Mn)。
②浸取液中金属离子生成MS沉淀情况与pH的关系如下图。
③ 、
、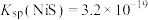 、
、 。
。
回答下列问题:
(1)浸取时
 中钴元素转化为
中钴元素转化为 ,有机酸用醋酸时反应的离子方程式为
,有机酸用醋酸时反应的离子方程式为(2)浸取时有机酸用苹果酸
 比醋酸浸取效果好,苹果酸分子中C原子的杂化类型为
比醋酸浸取效果好,苹果酸分子中C原子的杂化类型为(3)
 时溶液中
时溶液中
 和
和 的沉淀率增大的原因为
的沉淀率增大的原因为(4)沉锂时生成
 ,反应的离子方程式为
,反应的离子方程式为(5)还可以通过电渗析法分离金属离子。硫酸、双氧水浸取后,分三次电渗析可分离成功。下图所示为第一次电渗析分离
 的工艺,离子交换膜B为
的工艺,离子交换膜B为 ,第三次直接对剩余溶液电渗析分离,且需要将C改为一价阳离子交换膜。由上述分离过程可推测,
,第三次直接对剩余溶液电渗析分离,且需要将C改为一价阳离子交换膜。由上述分离过程可推测, 、
、 、
、 中与
中与 反应最难的为
反应最难的为 在
在
您最近一年使用:0次



