新能源汽车在实现可持续发展的环境目标、减少空气的污染问题及应对气候的逐渐恶化中起到了至关重要的作用。锂离子电池使用寿命在5~8年,研究回收废旧正极材料中Li、Ni、Co、Mn等资源可以促进锂离子电池产业的良性发展。下图是一种三元锂电池正极材料的回收工艺。

回答下列问题:
(1)浸取时 中钴元素转化为
中钴元素转化为 ,有机酸用醋酸时反应的离子方程式为
,有机酸用醋酸时反应的离子方程式为___________ 。
(2)浸取时有机酸用苹果酸 比醋酸浸取效果好,苹果酸分子中C原子的杂化类型为
比醋酸浸取效果好,苹果酸分子中C原子的杂化类型为___________ 。
(3) 时溶液中
时溶液中
___________ ;随pH增大, 和
和 的沉淀率增大的原因为
的沉淀率增大的原因为___________ 。
(4)沉锂时生成 ,反应的离子方程式为
,反应的离子方程式为___________ 。
(5)还可以通过电渗析法分离金属离子。硫酸、双氧水浸取后,分三次电渗析可分离成功。下图所示为第一次电渗析分离 的工艺,离子交换膜B为
的工艺,离子交换膜B为___________ (填“阴”或“阳”)离子交换膜。第二次用同样方法分离 ,第三次直接对剩余溶液电渗析分离,且需要将C改为一价阳离子交换膜。由上述分离过程可推测,
,第三次直接对剩余溶液电渗析分离,且需要将C改为一价阳离子交换膜。由上述分离过程可推测, 、
、 、
、 中与
中与 反应最难的为
反应最难的为___________ , 在
在___________ 膜(填“AB”、“BC”或“CD”)之间获得。


已知:①正极材料主要成分可以表示为 (M:Ni、Co、Mn)。
(M:Ni、Co、Mn)。
②浸取液中金属离子生成MS沉淀情况与pH的关系如下图。
③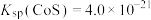 、
、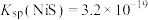 、
、 。
。
回答下列问题:
(1)浸取时
 中钴元素转化为
中钴元素转化为 ,有机酸用醋酸时反应的离子方程式为
,有机酸用醋酸时反应的离子方程式为(2)浸取时有机酸用苹果酸
 比醋酸浸取效果好,苹果酸分子中C原子的杂化类型为
比醋酸浸取效果好,苹果酸分子中C原子的杂化类型为(3)
 时溶液中
时溶液中
 和
和 的沉淀率增大的原因为
的沉淀率增大的原因为(4)沉锂时生成
 ,反应的离子方程式为
,反应的离子方程式为(5)还可以通过电渗析法分离金属离子。硫酸、双氧水浸取后,分三次电渗析可分离成功。下图所示为第一次电渗析分离
 的工艺,离子交换膜B为
的工艺,离子交换膜B为 ,第三次直接对剩余溶液电渗析分离,且需要将C改为一价阳离子交换膜。由上述分离过程可推测,
,第三次直接对剩余溶液电渗析分离,且需要将C改为一价阳离子交换膜。由上述分离过程可推测, 、
、 、
、 中与
中与 反应最难的为
反应最难的为 在
在
更新时间:2024-03-26 17:09:26
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】工业上常用水钴矿(主要成分为Co2O3,还含少量Fe2O3、Al2O3、MgO、CaO等杂质)制备钴的氧化物,其制备工艺流程如下:

回答下列问题:
(1)在加入盐酸进行“酸浸”时,能提高“酸浸”速率的方法有_______ (任写两种)。
(2)“酸浸”后加入Na2SO3,钴的存在形式为Co2+,写出产生Co2+反应的离子方程式_______ 。
(3)溶液a中加入NaClO的作用为_______ 。
(4)沉淀A的成分为_______ ,操作2的名称是_______ 。
(5)已知:Ksp(CaF2)=5.3×10-9,Ksp(MgF2)=5.2×10-12,若向溶液c中加入NaF溶液,当Mg2+恰好沉淀完全即溶液中c(Mg2+)=1.0×10-5 mol·L-1,此时溶液中c(Ca2+)最大等于_______ mol·L-1。
(6)在空气中煅烧CoC2O4生成钴的某种氧化物和CO2,测得充分煅烧后固体质量为12.05 g,CO2的体积为6.72 L(标准状况),则此反应的化学方程式为_______ 。

回答下列问题:
(1)在加入盐酸进行“酸浸”时,能提高“酸浸”速率的方法有
(2)“酸浸”后加入Na2SO3,钴的存在形式为Co2+,写出产生Co2+反应的离子方程式
(3)溶液a中加入NaClO的作用为
(4)沉淀A的成分为
(5)已知:Ksp(CaF2)=5.3×10-9,Ksp(MgF2)=5.2×10-12,若向溶液c中加入NaF溶液,当Mg2+恰好沉淀完全即溶液中c(Mg2+)=1.0×10-5 mol·L-1,此时溶液中c(Ca2+)最大等于
(6)在空气中煅烧CoC2O4生成钴的某种氧化物和CO2,测得充分煅烧后固体质量为12.05 g,CO2的体积为6.72 L(标准状况),则此反应的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】钨在自然界的储量只有620万吨,江西独占有520万吨。江西每年产生大量的钨冶炼渣(主要含SiO2、MnO2、Al2O3、CaO、MgO、Fe的氧化物以及少量重金属氧化物等),以钨冶炼渣为原料,提炼制备电池级硫酸锰的工艺流程如下:

已知①溶液中金属离子的物质的量浓度≤10-5mol/L时可以看成沉淀完全, ,
, 。
。
②Mn(OH)₂易被空气中的氧气氧化生成MnO₂,MnO₂一般般难溶于酸溶液。
(1)“酸浸”时,为提高锰的浸出率,可采取的措施是___________ (写一种即可),滤渣1的主要成分为SiO2、___________ (填化学式)。
(2)酸浸后所得浸出液中金属阳离子包括Mn2⁺,写出生成Mn2⁺的离子方程式___________ 。
(3)浸出液加入H2O2需要过量的原因___________ 。若要使 和
和 沉淀完全,则需调节溶液的pH最小值为
沉淀完全,则需调节溶液的pH最小值为___________ 。
(4)滤渣 3的主要成分是CaF2和___________ 。
(5)加MnS的目的是___________ 。
(6)如图为MnSO4溶解度曲线。从MnSO4溶液中提取MnSO4晶体的操作为___________ 干燥,碾磨,即得到了电池级硫酸锰。


已知①溶液中金属离子的物质的量浓度≤10-5mol/L时可以看成沉淀完全,
 ,
, 。
。②Mn(OH)₂易被空气中的氧气氧化生成MnO₂,MnO₂一般般难溶于酸溶液。
(1)“酸浸”时,为提高锰的浸出率,可采取的措施是
(2)酸浸后所得浸出液中金属阳离子包括Mn2⁺,写出生成Mn2⁺的离子方程式
(3)浸出液加入H2O2需要过量的原因
 和
和 沉淀完全,则需调节溶液的pH最小值为
沉淀完全,则需调节溶液的pH最小值为(4)滤渣 3的主要成分是CaF2和
(5)加MnS的目的是
(6)如图为MnSO4溶解度曲线。从MnSO4溶液中提取MnSO4晶体的操作为

您最近一年使用:0次
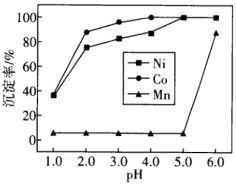
【推荐3】某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):
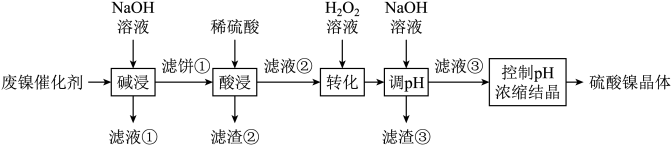
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)写出微粒的核外电子排布式:Al________ 。Fe3+________ 。
(2)“碱浸”中NaOH的两个作用分别是___________ 。为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式______________________ 。“滤液②”中含有的金属离子是________________ 。
(3)“转化”中可替代H2O2的物质是________ 。
A 酸性KMnO4溶液 B O2 C 硝酸 D 新制氯水
若工艺流程改为先“调pH”后“转化”,即
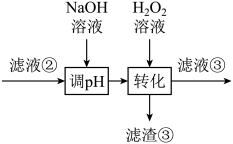
则“滤液③”中可能含有的杂质离子为__________________ 。
(4)利用上述表格数据,计算Ni(OH)2的Ksp=_________ 。如果“转化”后的溶液中Ni2+浓度为1.0 mol·L−1,则“调pH”应控制的pH范围是_________ 。
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。
(6)写出该反应的离子方程式_________________ 。
(7)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是__________ 。

溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
| 开始沉淀时(c=0.01 mol·L−1)的pH 沉淀完全时(c=1.0×10−5 mol·L−1)的pH | 7.2 8.7 | 3.7 4.7 | 2.2 3.2 | 7.5 9.0 |
(1)写出微粒的核外电子排布式:Al
(2)“碱浸”中NaOH的两个作用分别是
(3)“转化”中可替代H2O2的物质是
A 酸性KMnO4溶液 B O2 C 硝酸 D 新制氯水
若工艺流程改为先“调pH”后“转化”,即

则“滤液③”中可能含有的杂质离子为
(4)利用上述表格数据,计算Ni(OH)2的Ksp=
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。
(6)写出该反应的离子方程式
(7)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】氨氮废水中含有氨和铵盐,直接排放会造成环境污染。可用以下方法处理:
(1)沉淀法
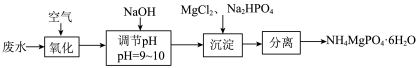
①“氧化”时在微生物的催化作用下, 被氧化为
被氧化为 。该反应的化学方程式为
。该反应的化学方程式为_______ 。
②“沉淀”中将“氧化”步骤后剩余的 转化为
转化为 沉淀,发生反应的离子方程式为
沉淀,发生反应的离子方程式为_______ 。
③若调节pH过大,会降低氨氮去除率,其原因为_______ 。
(2)生物硝化反硝化法
生物硝化反硝化法可将酸性废水中的氨氮转化为氮气,其原理如图所示。
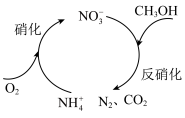
①硝化过程中溶液的pH_______ 。(填“升高”或“降低”)。
②每处理含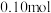
 的酸性废水,理论上消耗
的酸性废水,理论上消耗 的物质的量为
的物质的量为_______ 。
(3)电解间接氧化处理法
最近我国科学家开发了如图所示电解装置,可将氨氮氧化去除。处理前先调节废水 ,通电后可将其转化为无害气体。
,通电后可将其转化为无害气体。
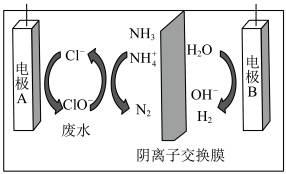
请结合电极反应式简述其去除氨氮的化学原理_______ 。
(1)沉淀法

①“氧化”时在微生物的催化作用下,
 被氧化为
被氧化为 。该反应的化学方程式为
。该反应的化学方程式为②“沉淀”中将“氧化”步骤后剩余的
 转化为
转化为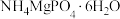 沉淀,发生反应的离子方程式为
沉淀,发生反应的离子方程式为③若调节pH过大,会降低氨氮去除率,其原因为
(2)生物硝化反硝化法
生物硝化反硝化法可将酸性废水中的氨氮转化为氮气,其原理如图所示。

①硝化过程中溶液的pH
②每处理含
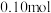
 的酸性废水,理论上消耗
的酸性废水,理论上消耗 的物质的量为
的物质的量为(3)电解间接氧化处理法
最近我国科学家开发了如图所示电解装置,可将氨氮氧化去除。处理前先调节废水
 ,通电后可将其转化为无害气体。
,通电后可将其转化为无害气体。
请结合电极反应式简述其去除氨氮的化学原理
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】亚硝酰氯(NOCl)是—种红褐色液体或黄色气体,其熔点:-64.5℃,沸点:-5.5℃,遇水易水解。它是有机合成中的重要试剂,可由NO与C12在常温常压下合成。
(1)实验室制备原料气NO和Cl2的装置如下图所示:

实验室制Cl2时,装置A中烧瓶内发生反应的化学方程式为________________________ 。装置B中盛放的试剂为______________ ,其作用为____________________________ 。
(2)将上述收集到的Cl2充入D的集气瓶中,按图示装置制备亚硝酰氯。

①NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为____________________________ 。
②装置D中发生的反应方程式为____________________________ 。
③如果不用装置E会引起什么后果____________________________ 。
(3)工业上可用间接电化学法除去NO,其原理如下图所示,吸收塔中发生的反应为:NO+S2O42-+H2O→N2+HSO3-

①吸收塔内发生反应的氧化剂与还原剂物质的量之比为__________________________________________ 。
②阴极的电极反应式为__________________________________________ 。
(1)实验室制备原料气NO和Cl2的装置如下图所示:

实验室制Cl2时,装置A中烧瓶内发生反应的化学方程式为
(2)将上述收集到的Cl2充入D的集气瓶中,按图示装置制备亚硝酰氯。

①NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为
②装置D中发生的反应方程式为
③如果不用装置E会引起什么后果
(3)工业上可用间接电化学法除去NO,其原理如下图所示,吸收塔中发生的反应为:NO+S2O42-+H2O→N2+HSO3-

①吸收塔内发生反应的氧化剂与还原剂物质的量之比为
②阴极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】高浓度SO2、氮氧化物及粉尘颗粒等有害物质,在排放前必须进行脱硫脱硝。
(1)利用甲烷可将氮氧化物还原为氮气除去。已知:
2NO(g)+O2(g)=2NO2(g) ΔH=a kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=b kJ·mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH=c kJ·mol-1
反应CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=____ kJ·mol-1
(2)利用电解法对烟气进行脱硫脱硝的工艺如下图所示。

①电解池中阴极的电极反应式为:______ 。
②标准状况下Ce4+溶液每吸收2.24 L NO,反应器中消耗的O2的物质的量为______ 。
(1)利用甲烷可将氮氧化物还原为氮气除去。已知:
2NO(g)+O2(g)=2NO2(g) ΔH=a kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=b kJ·mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH=c kJ·mol-1
反应CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=
(2)利用电解法对烟气进行脱硫脱硝的工艺如下图所示。

①电解池中阴极的电极反应式为:
②标准状况下Ce4+溶液每吸收2.24 L NO,反应器中消耗的O2的物质的量为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】回答下列问题:
(1)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。
①磷化硼晶体晶胞如图甲所示(白球代表磷原子,黑球代表硼原子),已知晶胞边长a pm,则磷化硼晶体的密度为___________ 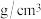 。(设NA为阿伏加德罗常数的值)
。(设NA为阿伏加德罗常数的值)
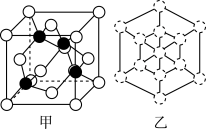
②磷化硼晶胞沿着体对角线方向的投影如图乙所示(图乙中 表示P原子的投影),请在图乙中把B原子的投影位置涂黑
表示P原子的投影),请在图乙中把B原子的投影位置涂黑
_______ 。
(2)在多原子分子中如有相互平行的p轨道,它们连贯重叠在一起构成一个整体,p电子在多个原子间运动形成 型化学键,简称大
型化学键,简称大 键。例如,O3的大
键。例如,O3的大 键表示为
键表示为
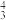 ,3表示3个原子,4表示4个电子。
,3表示3个原子,4表示4个电子。
①呋喃(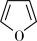 )是一种具有芳香性的平面分子,其中氧原子的杂化方式为
)是一种具有芳香性的平面分子,其中氧原子的杂化方式为___________ 杂化。
②呋喃分子中的大 键可表示为
键可表示为___________ 。
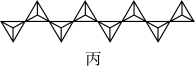
(3)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为___________ ;也可以得到偏钒酸钠,其阴离子呈如图丙所示的无限链状结构(钒位于阴离子结构体心),则偏钒酸钠的化学式为___________ 。
(1)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。
①磷化硼晶体晶胞如图甲所示(白球代表磷原子,黑球代表硼原子),已知晶胞边长a pm,则磷化硼晶体的密度为
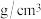 。(设NA为阿伏加德罗常数的值)
。(设NA为阿伏加德罗常数的值)
②磷化硼晶胞沿着体对角线方向的投影如图乙所示(图乙中
 表示P原子的投影),请在图乙中把B原子的投影位置涂黑
表示P原子的投影),请在图乙中把B原子的投影位置涂黑
(2)在多原子分子中如有相互平行的p轨道,它们连贯重叠在一起构成一个整体,p电子在多个原子间运动形成
 型化学键,简称大
型化学键,简称大 键。例如,O3的大
键。例如,O3的大 键表示为
键表示为
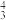 ,3表示3个原子,4表示4个电子。
,3表示3个原子,4表示4个电子。①呋喃(
 )是一种具有芳香性的平面分子,其中氧原子的杂化方式为
)是一种具有芳香性的平面分子,其中氧原子的杂化方式为②呋喃分子中的大
 键可表示为
键可表示为(3)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】Fe、Ni均为Ⅷ族元素,与C、N、O、P等组成的化合物有广泛的用途。回答下列问题:
(1)基态 的价层电子轨道表达式为
的价层电子轨道表达式为_______ ,C、N、O的第一电离能从小到大的顺序为_______ 。
(2)N、P可形成一些复杂离子,如 、
、 、
、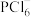 等。
等。 中N原子的杂化类型为
中N原子的杂化类型为_______ , 的空间构型为
的空间构型为_______ 。
(3)Fe、Ni易与CO形成配合物, 中σ键与π键个数比为
中σ键与π键个数比为_______ , 熔点-25℃,沸点43℃,不溶于水,溶于乙醇、苯等有机溶剂,
熔点-25℃,沸点43℃,不溶于水,溶于乙醇、苯等有机溶剂, 为
为_______ 晶体。
(4)FeO、NiO的晶体类型与结构和NaCl相同。
①熔点FeO_______ NiO(填“>”、“<”或“=”)。
②FeO晶胞如图, 的配位数为
的配位数为_______ 。

(1)基态
 的价层电子轨道表达式为
的价层电子轨道表达式为(2)N、P可形成一些复杂离子,如
 、
、 、
、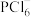 等。
等。 中N原子的杂化类型为
中N原子的杂化类型为 的空间构型为
的空间构型为(3)Fe、Ni易与CO形成配合物,
 中σ键与π键个数比为
中σ键与π键个数比为 熔点-25℃,沸点43℃,不溶于水,溶于乙醇、苯等有机溶剂,
熔点-25℃,沸点43℃,不溶于水,溶于乙醇、苯等有机溶剂, 为
为(4)FeO、NiO的晶体类型与结构和NaCl相同。
①熔点FeO
②FeO晶胞如图,
 的配位数为
的配位数为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】镍及其化合物是重要的合金材料和催化剂。请回答下列问题:

(1)基态镍原子的价电子排布式为___________ ,排布时最高电子层的电子所占的原子轨道有___________ 个伸展方向。
(2)镍能形成多种配合物如正四面体形的 、正方形的
、正方形的 和正八面体形的
和正八面体形的 等。下列说法不正确的有
等。下列说法不正确的有___________ 。
A. 与
与 互为等电子体,其中
互为等电子体,其中 分子内
分子内 键和
键和 键个数之比为
键个数之比为
B. 的空间结构为平面三角形
的空间结构为平面三角形
C. 在形成配合物时,其配位数可能为4或6
在形成配合物时,其配位数可能为4或6
D. 中,镍元素是
中,镍元素是 杂化
杂化
(3)丁二酮肟常用于检验 :在稀氨水中,丁二酮肟与
:在稀氨水中,丁二酮肟与 反应生成鲜红色沉淀,其结构如图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用“…”表示出氢键
反应生成鲜红色沉淀,其结构如图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用“…”表示出氢键___________ 。
(4) 的晶体结构类型与氯化钠的相同,相关离子半径如下表:
的晶体结构类型与氯化钠的相同,相关离子半径如下表:
 熔点比
熔点比 高的原因是
高的原因是___________ 。

(1)基态镍原子的价电子排布式为
(2)镍能形成多种配合物如正四面体形的
 、正方形的
、正方形的 和正八面体形的
和正八面体形的 等。下列说法不正确的有
等。下列说法不正确的有A.
 与
与 互为等电子体,其中
互为等电子体,其中 分子内
分子内 键和
键和 键个数之比为
键个数之比为
B.
 的空间结构为平面三角形
的空间结构为平面三角形C.
 在形成配合物时,其配位数可能为4或6
在形成配合物时,其配位数可能为4或6D.
 中,镍元素是
中,镍元素是 杂化
杂化(3)丁二酮肟常用于检验
 :在稀氨水中,丁二酮肟与
:在稀氨水中,丁二酮肟与 反应生成鲜红色沉淀,其结构如图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用“…”表示出氢键
反应生成鲜红色沉淀,其结构如图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用“…”表示出氢键(4)
 的晶体结构类型与氯化钠的相同,相关离子半径如下表:
的晶体结构类型与氯化钠的相同,相关离子半径如下表: |  |  |  |
 |  |  |  |
 熔点比
熔点比 高的原因是
高的原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】某化学实验室以一种工业上的废渣(废渣主要含有MgCO3、MgSiO3和少量Fe、Al的氧化物)为原料,制备MgCO3·3H2O。实验流程如下图所示:
(1)为了加快废渣的酸溶速率,可采取的办法有_________ (任写一点),酸溶时废渣中主要成分发生反应的离子方程式为___________________________________ 。
(2)加入30%H2O2的目的是__________________________________ 。
(3)用萃取分液的方法除去溶液中的Fe3+
①加入30%H2O2后,检验溶液中是否含有Fe2+的最佳试剂是__________________________ 。
②萃取分液完成后,检验水相中是否含有Fe3+的最佳试剂是______________________________ 。
(4)室温下,除去MgSO4溶液中的A13+(使Al3+浓度小于1×10-6mol/L)而不引入其它杂质,应加入的试剂X为__________ ,应调节pH的范围为_________________ 。
已知:①Ksp[Al(OH)3]=1.0×10-33 ②pH=8.5时,Mg(OH)2开始沉淀
(5)向滤液中加入Na2CO3溶液生成MgCO3沉淀并用蒸馏水洗涤,确认沉淀洗净的操作及现象是____________________________ 。
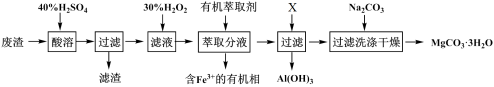
(6)下图为不同反应温度下所得水合碳酸镁的X射线衍射谱图。由图可知,干燥时需控制温度范围为___________________ ,温度较高时MgCO3·3H2O发生转化的化学方程式为_______________________________ 。

(1)为了加快废渣的酸溶速率,可采取的办法有
(2)加入30%H2O2的目的是
(3)用萃取分液的方法除去溶液中的Fe3+
①加入30%H2O2后,检验溶液中是否含有Fe2+的最佳试剂是
②萃取分液完成后,检验水相中是否含有Fe3+的最佳试剂是
(4)室温下,除去MgSO4溶液中的A13+(使Al3+浓度小于1×10-6mol/L)而不引入其它杂质,应加入的试剂X为
已知:①Ksp[Al(OH)3]=1.0×10-33 ②pH=8.5时,Mg(OH)2开始沉淀
(5)向滤液中加入Na2CO3溶液生成MgCO3沉淀并用蒸馏水洗涤,确认沉淀洗净的操作及现象是
(6)下图为不同反应温度下所得水合碳酸镁的X射线衍射谱图。由图可知,干燥时需控制温度范围为

您最近一年使用:0次
【推荐2】氯化亚铜( )常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水、不溶于乙醇和稀硫酸。工业上用制作印刷电路的废液(含
)常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水、不溶于乙醇和稀硫酸。工业上用制作印刷电路的废液(含 、
、 、
、 、
、 )生产
)生产 的流程如图所示:
的流程如图所示:
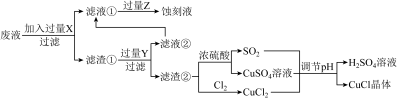
根据以上信息回答下列问题:
(1)生产过程中:X是________ ,Z是________ 。(均填化学式)
(2)写出生成 的离子方程式
的离子方程式________ 。
(3)析出的 晶体不用水而用无水乙醇洗涤的原因是
晶体不用水而用无水乙醇洗涤的原因是________ 。
(4)在 的生成过程中理论上不需要补充SO2气体,其理由是
的生成过程中理论上不需要补充SO2气体,其理由是________ 。
(5)已知:常温下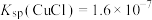 ,
,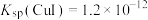 ,现向
,现向 饱和溶液中加入
饱和溶液中加入 固体至
固体至 ,此时溶液中
,此时溶液中 =
=________ 。
(6)实验探究pH对 产率的影响如下表所示:
产率的影响如下表所示:
析出 晶体最佳pH为
晶体最佳pH为________ ,当pH较大时 产率变低的原因是
产率变低的原因是________ 。
 )常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水、不溶于乙醇和稀硫酸。工业上用制作印刷电路的废液(含
)常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水、不溶于乙醇和稀硫酸。工业上用制作印刷电路的废液(含 、
、 、
、 、
、 )生产
)生产 的流程如图所示:
的流程如图所示:
根据以上信息回答下列问题:
(1)生产过程中:X是
(2)写出生成
 的离子方程式
的离子方程式(3)析出的
 晶体不用水而用无水乙醇洗涤的原因是
晶体不用水而用无水乙醇洗涤的原因是(4)在
 的生成过程中理论上不需要补充SO2气体,其理由是
的生成过程中理论上不需要补充SO2气体,其理由是(5)已知:常温下
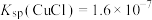 ,
,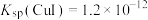 ,现向
,现向 饱和溶液中加入
饱和溶液中加入 固体至
固体至 ,此时溶液中
,此时溶液中 =
=(6)实验探究pH对
 产率的影响如下表所示:
产率的影响如下表所示:| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率/% | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
析出
 晶体最佳pH为
晶体最佳pH为 产率变低的原因是
产率变低的原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】优化的 复合材料作钠离子电池的正极材料时表现出优异的循环稳定性。以黄铁矿(主要成分是
复合材料作钠离子电池的正极材料时表现出优异的循环稳定性。以黄铁矿(主要成分是 ,含少量
,含少量 等杂质)为原料制备
等杂质)为原料制备 的流程如图所示。
的流程如图所示。
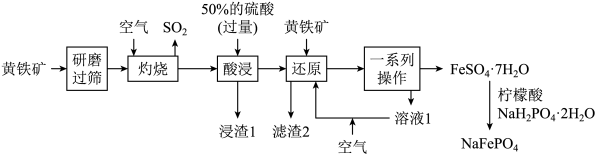
已知:①“滤渣2”中不含硫单质;②柠檬酸是一种重要的有机酸,易溶于水,具有一定的还原性。回答下列问题:
(1) 中Fe元素化合价为
中Fe元素化合价为_______ 价;“研磨”的目的是_______ 。
(2)写出“灼烧”步骤中 转化为
转化为 的化学方程式
的化学方程式_______ 。
(3)常温下,“酸浸”时,加入过量50%的硫酸的目的为_______ 。
(4)“浸渣1”的主要成分是_______ (填化学式),列举出该物质的一种用途:_______ 。
(5)流程中加入柠檬酸的目的是_______ 。
 复合材料作钠离子电池的正极材料时表现出优异的循环稳定性。以黄铁矿(主要成分是
复合材料作钠离子电池的正极材料时表现出优异的循环稳定性。以黄铁矿(主要成分是 ,含少量
,含少量 等杂质)为原料制备
等杂质)为原料制备 的流程如图所示。
的流程如图所示。
已知:①“滤渣2”中不含硫单质;②柠檬酸是一种重要的有机酸,易溶于水,具有一定的还原性。回答下列问题:
(1)
 中Fe元素化合价为
中Fe元素化合价为(2)写出“灼烧”步骤中
 转化为
转化为 的化学方程式
的化学方程式(3)常温下,“酸浸”时,加入过量50%的硫酸的目的为
(4)“浸渣1”的主要成分是
(5)流程中加入柠檬酸的目的是
您最近一年使用:0次



