解题方法
1 . 我国提出“2030 年前碳达峰、2060年前碳中和”战略目标,优先布局和发展新能源产业势在必行。目前,太阳能电池的发展已趋向于微型化、薄膜化、最新产品是含铜、镓( Ga)、硒(Se)等元素的化合物薄膜太阳能电池和Si系薄膜太阳能电池。完成下列填空:
(1)基态Ga原子的价层电子排布式为_______ 。
(2)Ga是重要的第四代半导体元素,已知GaAs的熔点为1238℃, GaAs与GaN具有相同的晶胞结构,则二者晶体的类型均为_______ , GaAs 的熔点_______ (填“高于”或“低于”)GaN,其原因是_______ 。
(3)Se 能形成与S相似的化合物,判断SeO3分子的空间结构为_______ , 中心原子的杂化方式为_______ ,Se 的第一电离能比S的第一电离能_______ (填“大”或“小”)
(4)亚铜离子(Cu+)可以形成[Cu( NH3)2]+配合离子,其中的配位原子为_______ ,1mol [Cu( NH3)2]+离子中含有σ键的数目为_______ 个。
(5)如图所示为金刚砂( SiC)晶体的单位结构,若晶胞边长为a pm,则Si原子的配位数为_______ ,晶胞密度为_______ g/cm3。

(1)基态Ga原子的价层电子排布式为
(2)Ga是重要的第四代半导体元素,已知GaAs的熔点为1238℃, GaAs与GaN具有相同的晶胞结构,则二者晶体的类型均为
(3)Se 能形成与S相似的化合物,判断SeO3分子的空间结构为
(4)亚铜离子(Cu+)可以形成[Cu( NH3)2]+配合离子,其中的配位原子为
(5)如图所示为金刚砂( SiC)晶体的单位结构,若晶胞边长为a pm,则Si原子的配位数为

您最近一年使用:0次
解题方法
2 . 铬、铜、锌、硒、镉、锡等金属及其化合物具有广泛的用途,在现代工业中备受青睐。回答下列问题:
(1)铬是一种硬而脆、抗腐蚀性强的金属,常用于电镀和制造特种钢。基态 原子中,电子占据最高能层的符号为
原子中,电子占据最高能层的符号为_______ ,铬原子价电子排布式为_______ 。
(2) 可用于去头皮屑,常温下为白色晶体,熔点340~350℃,则
可用于去头皮屑,常温下为白色晶体,熔点340~350℃,则 的晶体类型为
的晶体类型为_______ , 的分子构型为
的分子构型为_______ , 分子中
分子中 的杂化类型是
的杂化类型是_______ ,与 互为等电子体的阴离子
互为等电子体的阴离子_______ (写出一种即可)。
(3)我国科学家最新研制成功的一种纳米半导体材料可以高效实现光化学转换,该种材料主要成分为硫化镉和硫化锌。 与
与 位于同一副族,且在
位于同一副族,且在 的下一周期。已知
的下一周期。已知 熔点为2830℃;
熔点为2830℃; 熔点为1750℃,
熔点为1750℃, 熔点更高的原因为
熔点更高的原因为_______ 。
(4)黄铜常被用于制造阀门,它是 与
与 的合金,铜和锌的第二电离能大小关系为:
的合金,铜和锌的第二电离能大小关系为: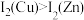 ,原因是
,原因是_______ 。
(5)磷锡青铜是有名的弹性材料,广泛用于仪器仪表中的耐磨零件和抗磁元件等。磷锡青铜晶胞结构如图所示。 代表阿伏加德罗常数的值,铜、磷原子最近距离为
代表阿伏加德罗常数的值,铜、磷原子最近距离为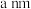 。
。
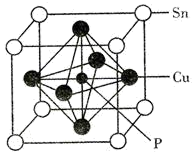
①磷锡青铜的化学式为_______ 。
②磷锡青铜晶体密度为_______  (列出计算式即可)。
(列出计算式即可)。
(1)铬是一种硬而脆、抗腐蚀性强的金属,常用于电镀和制造特种钢。基态
 原子中,电子占据最高能层的符号为
原子中,电子占据最高能层的符号为(2)
 可用于去头皮屑,常温下为白色晶体,熔点340~350℃,则
可用于去头皮屑,常温下为白色晶体,熔点340~350℃,则 的晶体类型为
的晶体类型为 的分子构型为
的分子构型为 分子中
分子中 的杂化类型是
的杂化类型是 互为等电子体的阴离子
互为等电子体的阴离子(3)我国科学家最新研制成功的一种纳米半导体材料可以高效实现光化学转换,该种材料主要成分为硫化镉和硫化锌。
 与
与 位于同一副族,且在
位于同一副族,且在 的下一周期。已知
的下一周期。已知 熔点为2830℃;
熔点为2830℃; 熔点为1750℃,
熔点为1750℃, 熔点更高的原因为
熔点更高的原因为(4)黄铜常被用于制造阀门,它是
 与
与 的合金,铜和锌的第二电离能大小关系为:
的合金,铜和锌的第二电离能大小关系为: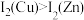 ,原因是
,原因是(5)磷锡青铜是有名的弹性材料,广泛用于仪器仪表中的耐磨零件和抗磁元件等。磷锡青铜晶胞结构如图所示。
 代表阿伏加德罗常数的值,铜、磷原子最近距离为
代表阿伏加德罗常数的值,铜、磷原子最近距离为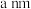 。
。
①磷锡青铜的化学式为
②磷锡青铜晶体密度为
 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
解题方法
3 . 海洋是元素的摇篮,海水中含有的大量元素在生产、生活、科学研究等多方面具有重要作用。回答下列问题。
(1)写出基态溴原子的价电子排布式_______ ,氟、氯、溴、氧四种元素中,电负性由大到小的顺序为_____ (填元素符号) 。
(2) Mg、Al的氟化物晶格能分别是2957 kJ•mol-1、5492 kJ•mol-1,二者相差很大的原因是______ 。
(3) X射线衍射测定等发现,I3AsF6中存在I 离子。I
离子。I 离子的几何构型为
离子的几何构型为_____ ,中心原子的杂化类型为_____ 。
(4) C原子可以形成多种有机物,如图所示是一种吡啶和一种嘌呤的结构,两种分子中所有原子都在一个平面上。

①1mol吡啶分子中含有σ键数目是___________ NA。
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因___________ 。
③分子中的大π键可以用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为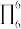 )。该吡啶和嘌呤中都含有大π键,则该吡啶中的大π键表示为
)。该吡啶和嘌呤中都含有大π键,则该吡啶中的大π键表示为___________ 。
(5) CaF2可用于冶金、化工和建材等很多行业,为立方晶胞,结构如下图所示:
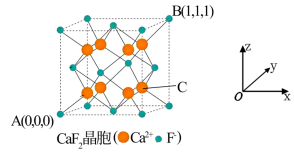
①“ 原子坐标参数”可表示晶胞内部各原子的相对位置,已知A、B两点的原子坐标参数如图所示,则C点的“原子坐标参数”为(________ ,_______ , )
)
②已知晶胞参数为0.5462 nm,阿伏加德罗常数的值为NA,则其密度为____ g•cm-3 (列出计算式即可) 。
(1)写出基态溴原子的价电子排布式
(2) Mg、Al的氟化物晶格能分别是2957 kJ•mol-1、5492 kJ•mol-1,二者相差很大的原因是
(3) X射线衍射测定等发现,I3AsF6中存在I
 离子。I
离子。I 离子的几何构型为
离子的几何构型为(4) C原子可以形成多种有机物,如图所示是一种吡啶和一种嘌呤的结构,两种分子中所有原子都在一个平面上。

①1mol吡啶分子中含有σ键数目是
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因
③分子中的大π键可以用符号
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为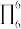 )。该吡啶和嘌呤中都含有大π键,则该吡啶中的大π键表示为
)。该吡啶和嘌呤中都含有大π键,则该吡啶中的大π键表示为(5) CaF2可用于冶金、化工和建材等很多行业,为立方晶胞,结构如下图所示:

①“ 原子坐标参数”可表示晶胞内部各原子的相对位置,已知A、B两点的原子坐标参数如图所示,则C点的“原子坐标参数”为(
 )
)②已知晶胞参数为0.5462 nm,阿伏加德罗常数的值为NA,则其密度为
您最近一年使用:0次
解题方法
4 . Cu2O广泛应用于太阳能电池领域。以CuSO4、NaOH和抗坏血酸为原料,可制备Cu2O。
(1)基态Cu原子的外围电子排布式为__ ,其最高能级的电子云为__ 形。
(2)SO 的空间构型为
的空间构型为___ (用文字描述);Cu2+与OH-反应能生成[Cu(OH)4]2-,Cu2+与之间OH-的化学键类型为___ ,[Cu(OH)4]2-中配位数为__ 。
(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为__ ,手性碳原子的数量为___ 个,由其结构推测,抗坏血酸__ 溶于水(填“难”或“易”),请解释原因__ 。

(4)Cu2O的晶胞如图2所示,则Cu原子的配位数为__ 。若NA为阿伏加德罗常数,晶体密度为ρg•cm-3,求Cu2O的晶胞边长a=__ cm。
(1)基态Cu原子的外围电子排布式为
(2)SO
 的空间构型为
的空间构型为(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为

(4)Cu2O的晶胞如图2所示,则Cu原子的配位数为
您最近一年使用:0次
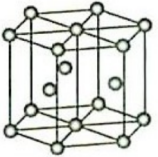
5 .  均为元素周期表第II A族元素。回答下列问题:
均为元素周期表第II A族元素。回答下列问题:
(1)基态 原子L能层有
原子L能层有______ 个运动状态不同的电子, 的第一电离能
的第一电离能______ (填“大于”或“小于”) 的第一电离能。
的第一电离能。
(2) 和
和 位于同一周期,且核外最外层电子排布相同,但金属
位于同一周期,且核外最外层电子排布相同,但金属 的熔、沸点等都比金属
的熔、沸点等都比金属 的高,原因是
的高,原因是______ 。
(3)氯气与熟石灰反应制漂白粉时会生成副产物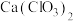 ,
,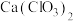 中电负性最小的元素是
中电负性最小的元素是______ (填元素符号); 的空间构型是
的空间构型是______ ; 原子的杂化方式为
原子的杂化方式为______ 。
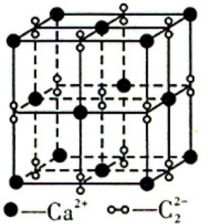
(4)离子化合物 的晶体结构如图所示。
的晶体结构如图所示。 中的作用力为
中的作用力为______ ,从钙离子看该晶体属于______ 堆积,一个晶胞中含有的π键有______ 个。
(5)镁单质晶体中原子的堆积模型如图,已知图中底边长为 ,高为
,高为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则镁的密度为
,则镁的密度为______ (用含 、a、b的计算式表示)。
、a、b的计算式表示)。
 均为元素周期表第II A族元素。回答下列问题:
均为元素周期表第II A族元素。回答下列问题:(1)基态
 原子L能层有
原子L能层有 的第一电离能
的第一电离能 的第一电离能。
的第一电离能。(2)
 和
和 位于同一周期,且核外最外层电子排布相同,但金属
位于同一周期,且核外最外层电子排布相同,但金属 的熔、沸点等都比金属
的熔、沸点等都比金属 的高,原因是
的高,原因是(3)氯气与熟石灰反应制漂白粉时会生成副产物
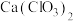 ,
,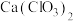 中电负性最小的元素是
中电负性最小的元素是 的空间构型是
的空间构型是 原子的杂化方式为
原子的杂化方式为(4)离子化合物
 的晶体结构如图所示。
的晶体结构如图所示。 中的作用力为
中的作用力为
(5)镁单质晶体中原子的堆积模型如图,已知图中底边长为
 ,高为
,高为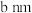 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则镁的密度为
,则镁的密度为 、a、b的计算式表示)。
、a、b的计算式表示)。
您最近一年使用:0次
2021-02-04更新
|
385次组卷
|
2卷引用:贵州省黔东南州2021届高三下学期3月高考模拟考试理综化学试题
6 . [2016·新课标I]锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]_______________ ,有__________ 个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是______________________________ 。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因______________________________ 。
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是______________________________ 。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_______________ ,微粒之间存在的作用力是_______________ 。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为( ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为_______________ 。_____ g·cm−3(列出计算式即可)。
(1)基态Ge原子的核外电子排布式为[Ar]
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | −49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(
 ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为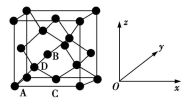
您最近一年使用:0次
2016-12-09更新
|
7026次组卷
|
32卷引用:贵州省威宁县第八中学2021-2022学年高三上学期第一次月考化学试题
贵州省威宁县第八中学2021-2022学年高三上学期第一次月考化学试题贵州省三都水族自治县高级中学2019-2020学年高三上学期期末考试理综化学试题贵州省剑河县第二中学2019-2020学年高三上学期期末考试化学试题吉林省松原市前郭尔罗斯蒙古族自治县第五中学2021届高三下学期5月月考化学试题广东省深圳市罗湖区2022届高三上学期第一次质量检测化学试题陕西省武功县2021-2022学年高三上学期第二次质量检测理科综合化学试题 2016年全国普通高等学校招生统一考试化学(新课标1卷精编版)2015-2016学年云南省德宏州芒一中高二下学期期末化学试卷河南省郑州市八校2016-2017学年高二下学期期中联考化学试题2017届山东省潍坊市实验中学高三下学期第四次单元过关测试理科综合化学试卷云南民族大学附属中学2017-2018学年高二下学期第一次月考化学试题(已下线)《考前20天终极攻略》5月30日 物质结构与性质(已下线)解密21 物质的结构与性质(教师版)——备战2018年高考化学之高频考点解密云南省澄江县第一中学2019届高三9月月考理科综合化学试题云南省玉溪市峨山一中2019届高三9月上学期月考化学试题云南省玉溪市新平县第一中学2019届高三第一次月考理综化学试题云南省新平一中2019届高三上学期12月考试化学试题2016年全国普通高等学校招生统一考试化学(全国1卷参考版)广东省深圳外国语学校2019届高三第一次月考理综化学试题鲁科版高中化学选修3模块综合测评卷新疆乌鲁木齐县柴窝堡林场中学2019届高三四月调研考试理综化学试题百所名校联考-物质结构与性质云南省玉溪市江川二中2019-2020学年高三上学期期中考试化学试题宁夏石嘴山市第三中学2019-2020学年高二下学期期中考试化学试题湖南省衡阳市2020年高中毕业班教学质量监测卷理科综合化学宁夏海原县第一中学2019-2020学年高二下学期第一次月考化学试题云南省陆良县2019届高三毕业班第二次教学质量摸底考化学试题陕西省汉中市2022届高三下学期第五次校级联考理科综合化学试题云南省曲靖市宣威市第七中学2021-2022学年高三下学期3月考试化学试题湖南省岳阳市汨罗市第二中学2022届高三下学期期中考试化学试题山东省德州市2021-2022学年高二下学期物质结构与性质模块综合测评化学试题山东省青岛一中2023-2024学年高二下学期第二次月考化学试卷



