解题方法
1 . 高锰酸钾(KMnO4)被广泛用作氧化剂、消毒剂、水处理剂等。回答下列问题:
(1)基态锰原子的价电子排布式是_________ ,含有_________ 个未成对电子。
(2)高锰酸钾中各元素电负性的大小顺序为_________ 。
(3)已知元素Mn与Fe的第三电离能分别为:I3(Mn)=3248kJ/mol、I3(Fe)=2957kJ/mol,I3(Mn)>I3(Fe)的原因是_________ 。
(4)氧与硫位于相同主族,它们的最简单氢化物的沸点较高的是_________ ,其原因是_________ 。过氧化氢中氧原子的杂化方式为_________ 。
(5)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,如图所示。晶胞中K、I、O分别处于顶角、体心、面心位置,晶胞参数为a=0.446nm。

①距离K最近且距离相等的O有_________ 个;
②与I距离最近的O形成的空间构型为_________ 。
③已知A坐标(0,0,0),B坐标(1,1,1),则I的坐标为_________ ;
④与I距离最近的钾为_________ nm(已知 =1.732,计算结果保留小数点后三位有效数字)。
=1.732,计算结果保留小数点后三位有效数字)。
(1)基态锰原子的价电子排布式是
(2)高锰酸钾中各元素电负性的大小顺序为
(3)已知元素Mn与Fe的第三电离能分别为:I3(Mn)=3248kJ/mol、I3(Fe)=2957kJ/mol,I3(Mn)>I3(Fe)的原因是
(4)氧与硫位于相同主族,它们的最简单氢化物的沸点较高的是
(5)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,如图所示。晶胞中K、I、O分别处于顶角、体心、面心位置,晶胞参数为a=0.446nm。

①距离K最近且距离相等的O有
②与I距离最近的O形成的空间构型为
③已知A坐标(0,0,0),B坐标(1,1,1),则I的坐标为
④与I距离最近的钾为
 =1.732,计算结果保留小数点后三位有效数字)。
=1.732,计算结果保留小数点后三位有效数字)。
您最近一年使用:0次
解题方法
2 . 研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为_______ 。元素Mn与O中,第一电离能较大的是_______ ,基态原子核外未成对电子数较多的是_______ 。
(2)CO2和CH3OH分子中C原子的杂化形式分别为_______ 和_______ 。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为_______
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在_______ 。
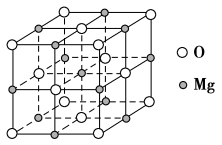
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为_______ nm。MnO也属于NaCl型结构,晶胞参数为a′=0.448 nm,则r(Mn2+)为_______ nm。
(1)Co基态原子核外电子排布式为
(2)CO2和CH3OH分子中C原子的杂化形式分别为
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为

您最近一年使用:0次
名校
3 . 已知A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素,E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子。G元素最大能层符号为N,有4个单电子。
(1)基态E原子的价电子排布图___________ 。
(2)B、C、D三元素第一电离能由大到小的顺序为___________ (用元素符号表示)。
(3) 中心原子为
中心原子为___________ 杂化,空间构型为___________ ,键角___________  (用“>、<、=”填空)。
(用“>、<、=”填空)。
(4) 与C2为等电子体结构相似,1mol
与C2为等电子体结构相似,1mol 中含有
中含有 键的数目为
键的数目为___________ 。
(5)D、E元素最简单氢化物的稳定性___________ (填化学式)。
(6)基态G2+离子的电子排布式为:___________ 。
(1)基态E原子的价电子排布图
(2)B、C、D三元素第一电离能由大到小的顺序为
(3)
 中心原子为
中心原子为 (用“>、<、=”填空)。
(用“>、<、=”填空)。(4)
 与C2为等电子体结构相似,1mol
与C2为等电子体结构相似,1mol 中含有
中含有 键的数目为
键的数目为(5)D、E元素最简单氢化物的稳定性
(6)基态G2+离子的电子排布式为:
您最近一年使用:0次
4 . 四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4∶1,其d轨道中的电子数与最外层电子数之比为5∶1。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是___________ 、___________ ;杂化轨道分别是___________ 、___________ ;a分子的立体结构是___________ 。
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是___________ 晶体,___________ 晶体。
(3)Y与Z比较,电负性较大的___________ 。
(4)W元素的化学式为___________ ,其+2价离子的核外电子排布式是___________ 。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是
(3)Y与Z比较,电负性较大的
(4)W元素的化学式为
您最近一年使用:0次
解题方法
5 . 研究发现,过量摄入铝元素能损害人的脑细胞。适当地补充碘元素可预防甲状腺肿大,但摄入过多也会导致甲状腺病变。试回答下列问题:
(1)Fe也是人体需要补充的元素之一,写出Fe3+的核外电子排布式:___________ 。
(2)与Al同一周期的Na、Mg元素也是人体所需元素,Na、Mg、Al基态原子第一电离能由大到小的顺序是___________ 。
(3)氯化铝的熔点是194℃,氧化铝的熔点是2054℃,但是工业上获取铝单质不是电解熔融氯化铝,而是电解熔融氧化铝,原因是___________ ;为降低熔点和增强导电性,电解熔融氧化铝时通常要加入Na3AlF6(冰晶石),Na3AlF6中含有的化学键类型有___________ (填字母)。
A.离子键 B.金属键 C.氢键 D.配位键
(4)F与I是同一主族的元素,BF3与H3O+都是由四个原子构成的粒子,两种粒子的中心原子B和O的杂化方式分别为___________ 、___________ ,BF3的空间构型是___________ ,H3O+的空间构型是___________ 。
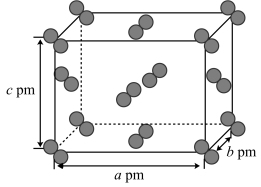
(5)I2晶体的晶胞结构如图所示,该晶胞中含有I原子的数目为___________ ,已知该晶胞的晶胞参数为apm、bpm和cpm,则I2晶体的密度是___________ g/cm3。(列出最简表达式,用NA表示阿伏加德罗常数的值)
(1)Fe也是人体需要补充的元素之一,写出Fe3+的核外电子排布式:
(2)与Al同一周期的Na、Mg元素也是人体所需元素,Na、Mg、Al基态原子第一电离能由大到小的顺序是
(3)氯化铝的熔点是194℃,氧化铝的熔点是2054℃,但是工业上获取铝单质不是电解熔融氯化铝,而是电解熔融氧化铝,原因是
A.离子键 B.金属键 C.氢键 D.配位键
(4)F与I是同一主族的元素,BF3与H3O+都是由四个原子构成的粒子,两种粒子的中心原子B和O的杂化方式分别为
(5)I2晶体的晶胞结构如图所示,该晶胞中含有I原子的数目为

您最近一年使用:0次
名校
解题方法
6 . (NH4)2Fe(SO4)2·6H2O,俗名为莫尔盐,是一种重要的化工原料,可用于医药、冶金、电镀等。回答下列问题:
(1)NH 离子中N的
离子中N的_______ 轨道与H的s轨道重叠形成σ键; 的空间构型为
的空间构型为_______ ,其O-S-O的键角比 中O-S-O的键角
中O-S-O的键角_______ (填“大”或“小”)。
(2)Fe与S形成的一种化合物晶体的晶胞结构及其纵向投影如图所示,该物质的化学式为_______ 。已知:晶体密度为ρg/cm3,阿伏加德罗常数的值为NA,晶胞六棱柱底面边长为apm,则该晶胞的高c=_______ pm(列出计算式)。

(1)NH
 离子中N的
离子中N的 的空间构型为
的空间构型为 中O-S-O的键角
中O-S-O的键角(2)Fe与S形成的一种化合物晶体的晶胞结构及其纵向投影如图所示,该物质的化学式为

您最近一年使用:0次
解题方法
7 . 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2,元素Y基态原子的3p轨道上有4个电子。元素Z的原子最外层电子数是其内层的3倍。
(1)X与Y所形成化合物晶体的晶胞如图所示。

①在1个晶胞中,X离子的数目为___________ 。
②该化合物的化学式为___________ 。
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是___________ 。H2Y分子的立体构型为___________ 。
(3)Y与Z可形成YZ ,YZ
,YZ 的立体构型为
的立体构型为___________ (用文字描述)。
(1)X与Y所形成化合物晶体的晶胞如图所示。

①在1个晶胞中,X离子的数目为
②该化合物的化学式为
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是
(3)Y与Z可形成YZ
 ,YZ
,YZ 的立体构型为
的立体构型为
您最近一年使用:0次
名校
解题方法
8 . 由S、Cl及Fe、Co、Ni等过渡元素组成的新型材料有着广泛的用途,回答下列问题:
(1)钴元素基态原子的价电子排布式为____ ,P、S、Cl的第一电离能由大到小顺序为_____ 。
(2)SCl2分子中的中心原子杂化轨道类型是____ ,该分子空间构型为____ 。
(3)Fe、Co、Ni等过渡元素易与CO形成配合物,化学式遵循18电子规则:中心原子的价电子数加上配体提供的电子数之和等于18,如Ni与CO形成配合物化学式为Ni(CO)4,则Fe与CO形成配合物化学式为_____ 。
(4)已知NiO的晶体结构如图1所示。

①NiO的晶体结构可描述为:氧原子位于面心和顶点,氧原子可形成正八面体空隙和正四面体空隙,镍原子填充在氧原子形成的空隙中。则NiO晶体中镍原子填充在氧原子形成的_______ 体空隙中。
②已知MgO与NiO的晶体结构相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm。则熔点:MgO_______ NiO(填“>”、“<"或“=”)
③一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充O2-形成的正三角形空隙中(如图2,已知O2-的半径为a米,每平方米面积上分散的NiO的质量为_______ g。(用a、NA表示)
(1)钴元素基态原子的价电子排布式为
(2)SCl2分子中的中心原子杂化轨道类型是
(3)Fe、Co、Ni等过渡元素易与CO形成配合物,化学式遵循18电子规则:中心原子的价电子数加上配体提供的电子数之和等于18,如Ni与CO形成配合物化学式为Ni(CO)4,则Fe与CO形成配合物化学式为
(4)已知NiO的晶体结构如图1所示。

①NiO的晶体结构可描述为:氧原子位于面心和顶点,氧原子可形成正八面体空隙和正四面体空隙,镍原子填充在氧原子形成的空隙中。则NiO晶体中镍原子填充在氧原子形成的
②已知MgO与NiO的晶体结构相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm。则熔点:MgO
③一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充O2-形成的正三角形空隙中(如图2,已知O2-的半径为a米,每平方米面积上分散的NiO的质量为
您最近一年使用:0次
名校
解题方法
9 . 新材料的出现改变了人们的生活,对新材料的研究越来越重要。
(1)硫化锌在荧光体、光导体材料、涂料、颜料等行业中应用广泛。其晶胞结构如图所示,a位置是S2-、b位置Zn2+,则此晶胞中含有_______ 个S2-,Zn2+的配位数为_______ 。

(2)最近发现一种钛原子和碳原子构成的气态团簇分子,如图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式为_______ 。

(3)由甲烷分子,在一定条件下可以得到“碳正离子”CH ,和“碳负离子”CH
,和“碳负离子”CH ,CH
,CH 中C-H键键角是
中C-H键键角是_______ ;CH 的空间构型是
的空间构型是_______ 。
(4)某金属材料的结构如图I所示,属于面心立方的结构,晶胞结构如图Ⅱ所示。若金属的原子半径为apm,金属的摩尔质量为Mg/mol,NA是阿伏加德罗常数的值。金属的密度为ρ=_______ g/cm3

(5)Zn与Cu的第一电离能:Zn_______ (填“>”“<”或“=”)Cu,其理由是_______ 。
(1)硫化锌在荧光体、光导体材料、涂料、颜料等行业中应用广泛。其晶胞结构如图所示,a位置是S2-、b位置Zn2+,则此晶胞中含有

(2)最近发现一种钛原子和碳原子构成的气态团簇分子,如图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式为

(3)由甲烷分子,在一定条件下可以得到“碳正离子”CH
 ,和“碳负离子”CH
,和“碳负离子”CH ,CH
,CH 中C-H键键角是
中C-H键键角是 的空间构型是
的空间构型是(4)某金属材料的结构如图I所示,属于面心立方的结构,晶胞结构如图Ⅱ所示。若金属的原子半径为apm,金属的摩尔质量为Mg/mol,NA是阿伏加德罗常数的值。金属的密度为ρ=

(5)Zn与Cu的第一电离能:Zn
您最近一年使用:0次
10 . 根据报道,贵州发现的超大型锰矿区资源量已超两亿吨。锰矿是继铁矿、铝矿之后,排在第三位的金属矿产,属国家紧缺战略矿产之一,在电池、磁性新材料等方面都有广泛应用。中国是全球最大的锰矿石和锰系材料生产、消费大国,请回答下列问题:
(1)基态锰原子的价层电子排布式为_______ 。
(2)铜锰氧化物(CuMn2O4)能在常温下催化氧化一氧化碳和甲醛(HCHO)。
①CO和N2互为等电于体。CO分子中σ键和π键数目之比为_______ 。
②HCHO分子的H—C—H键角_______ (填“大于”“小于”或“等于”)CO2的键角,理由是_______ 。
③向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。 的立体构型是
的立体构型是_______ 。
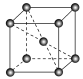
(3)锰晶胞如图所示。已知锰晶胞参数为anm。设锰晶胞中两个锰原子核之间最短距离为dnm,则d=_______ 。锰晶胞中Mn的密度=_______ 。
(1)基态锰原子的价层电子排布式为
(2)铜锰氧化物(CuMn2O4)能在常温下催化氧化一氧化碳和甲醛(HCHO)。
①CO和N2互为等电于体。CO分子中σ键和π键数目之比为
②HCHO分子的H—C—H键角
③向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
 的立体构型是
的立体构型是(3)锰晶胞如图所示。已知锰晶胞参数为anm。设锰晶胞中两个锰原子核之间最短距离为dnm,则d=

您最近一年使用:0次



