解题方法
1 . Na3OCl是一种良好的离子导体,具有反钙钛矿晶体结构。回答下列问题:
(1)Ca小于Ti的是_______ ,Ti原子的核外电子排布式是_______ 。
A.最外层电子数 B.未成对电子数 C.原子半径 D.第三电离能
(2)由O、Cl元素可组成不同的单质和化合物,其中Cl2O2能破坏臭氧层。
①Cl2O2的沸点比H2O2低,原因是_______ ;
②O3分子中心原子杂化类型为_______ ;O3是极性分子,理由是_______ 。
(3)Na3OCl晶体属于立方晶系,其晶胞结构如图所示。已知:晶胞边长为a nm,密度为d g·cm-3。
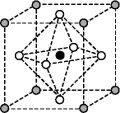
①Na3OCl晶胞中,Cl位于各顶点位置,Na位于_______ 位置,两个Na之间的最短距离为_______ nm。
②用a、d表示阿伏加德罗常数的值NA=_______ (列计算式)。
(1)Ca小于Ti的是
A.最外层电子数 B.未成对电子数 C.原子半径 D.第三电离能
(2)由O、Cl元素可组成不同的单质和化合物,其中Cl2O2能破坏臭氧层。
①Cl2O2的沸点比H2O2低,原因是
②O3分子中心原子杂化类型为
(3)Na3OCl晶体属于立方晶系,其晶胞结构如图所示。已知:晶胞边长为a nm,密度为d g·cm-3。

①Na3OCl晶胞中,Cl位于各顶点位置,Na位于
②用a、d表示阿伏加德罗常数的值NA=
您最近一年使用:0次
名校
解题方法
2 . KMnO4是一种高效氧化剂,可用来氧化吸附有机异味物,也可以与水中的杂质如二价铁、锰、硫、氰、酚等反应。实验室常用Na2C2O4标准溶液标定未知浓度的KMnO4溶液,发生反应:5C2O +2MnO
+2MnO +16H++4H2O=2[Mn(H2O)6]2++10CO2↑。根据以上信息,完成下列问题:
+16H++4H2O=2[Mn(H2O)6]2++10CO2↑。根据以上信息,完成下列问题:
(1)基态Mn2+的核外电子排布式可表示为___ 。
(2)1mol[Mn(H2O)6]2+中所含有的共价键数目为___ (用NA表示阿伏加德罗常数的值)。
(3)基态C原子的核外电子中占据最高能级的电子云轮廓图为___ 。C2O 中碳原子的轨道杂化类型是
中碳原子的轨道杂化类型是___ 。
(4)同主族元素氧、硫、硒对应最简单氢化物的沸点:H2O>H2Se>H2S,原因是___ 。
(5)β—MnSe的结构中Se为面心立方最密堆积,晶胞结构如图所示。

①β—MnSe中Mn的配位数为___ 。
②若该晶体的晶胞参数为apm,阿伏加德罗常数的值为NA。则距离最近的两个锰原子之间的距离为___ pm。
 +2MnO
+2MnO +16H++4H2O=2[Mn(H2O)6]2++10CO2↑。根据以上信息,完成下列问题:
+16H++4H2O=2[Mn(H2O)6]2++10CO2↑。根据以上信息,完成下列问题:(1)基态Mn2+的核外电子排布式可表示为
(2)1mol[Mn(H2O)6]2+中所含有的共价键数目为
(3)基态C原子的核外电子中占据最高能级的电子云轮廓图为
 中碳原子的轨道杂化类型是
中碳原子的轨道杂化类型是(4)同主族元素氧、硫、硒对应最简单氢化物的沸点:H2O>H2Se>H2S,原因是
(5)β—MnSe的结构中Se为面心立方最密堆积,晶胞结构如图所示。

①β—MnSe中Mn的配位数为
②若该晶体的晶胞参数为apm,阿伏加德罗常数的值为NA。则距离最近的两个锰原子之间的距离为
您最近一年使用:0次
名校
3 . 金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
(1)基态镍原子价电子排布式为___________ 。金属镍的原子堆积方式如图所示,则金属镍的晶胞俯视图为___________ (填字母)。

a. B.
B. C.
C. D.
D.
(2)丁二酮肟( )是检验Ni2+的灵敏试剂,常与Ni2+形成图I所示的配合物,图II是硫代氧的结果:
)是检验Ni2+的灵敏试剂,常与Ni2+形成图I所示的配合物,图II是硫代氧的结果:


①下列说法正确的有___________ (填字母)。
A.在I中N元素的电负性最大
B.在I中C-C-C键角是180°
C.在II中-SH上的S原子采取sp3杂化
D.在II中存在σ键、Π键与配位键
②化合物I的熔、沸点高于化合物II的原因是___________ 。
(3)工业上选用硫酸和硝酸的混酸与Ni反应制备NiSO4。SO 的立体构型为
的立体构型为___________ 。Fe、Co、Ni三种元素二价离子的硫酸盐晶体的晶胞类型相同,其熔点由高到低的顺序为___________ 。
(4)Ni和La的合金是目前使用广泛的储氢材料。该合金的晶胞结构如图所示。

①该晶胞中粒子个数比La∶Ni=___________ 。设该合金的密度为dg/cm3,则该晶胞的体积为___________ cm3(用含d的代数式表示)
②该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子时比较稳定。已知:a=500pm,c=400pm;标准状况下氢气的密度为9.00×10-5g/cm3; 储氢能力= 。若忽略储氢前后晶胞的体积变化,则该合金的储氢能力为
。若忽略储氢前后晶胞的体积变化,则该合金的储氢能力为___________ (已知sin60°≈0.87;结果保留整数)。
(1)基态镍原子价电子排布式为

a.
 B.
B. C.
C. D.
D.
(2)丁二酮肟(
 )是检验Ni2+的灵敏试剂,常与Ni2+形成图I所示的配合物,图II是硫代氧的结果:
)是检验Ni2+的灵敏试剂,常与Ni2+形成图I所示的配合物,图II是硫代氧的结果:

①下列说法正确的有
A.在I中N元素的电负性最大
B.在I中C-C-C键角是180°
C.在II中-SH上的S原子采取sp3杂化
D.在II中存在σ键、Π键与配位键
②化合物I的熔、沸点高于化合物II的原因是
(3)工业上选用硫酸和硝酸的混酸与Ni反应制备NiSO4。SO
 的立体构型为
的立体构型为(4)Ni和La的合金是目前使用广泛的储氢材料。该合金的晶胞结构如图所示。

①该晶胞中粒子个数比La∶Ni=
②该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子时比较稳定。已知:a=500pm,c=400pm;标准状况下氢气的密度为9.00×10-5g/cm3; 储氢能力=
 。若忽略储氢前后晶胞的体积变化,则该合金的储氢能力为
。若忽略储氢前后晶胞的体积变化,则该合金的储氢能力为
您最近一年使用:0次
2021-10-19更新
|
164次组卷
|
2卷引用:甘肃省高台县第一中学2021-2022学年高三上学期期中考试化学(理)试题
名校
4 . 第Ⅷ族元素铁、钴、镍的单质及其化合物在生产、生活中有广泛应用。请回答下列问题:
(1)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态铁原子,其自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态铁原子,其自旋磁量子数的代数和为____ 。
(2)Fe、Co的第四电离能分别为5290kJ·mol-1、4950kJ·mol-1,铁的第四电离能大于钴的第四电离能的主要原因是___ 。
(3)维生素B12的结构如图所示。
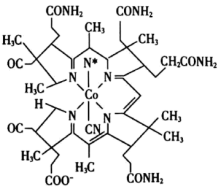
①钴的配位数为___ 。
②CN-与Co3+形成配位键时CN-中C提供孤电子对,而不是N提供孤电子对,其主要原因可能是___ 。
(4)Ni(NH3)2Cl2有两种空间结构,中心离子为___ (填离子符号),则[Ni(CN)4]2-立体结构为___ (填“正四面体”或“平面正方形)。
(5)Fe2+与环戊二烯基形成化合物Fe(C5H5)2,称为二茂铁,二茂铁为橙黄色固体,易溶于乙醚、苯、乙醇等有机溶剂,其熔点为446K。由此推知,二茂铁晶体类型是___ (填“离子晶体”或“分子晶体”)。
(6)由K+、Fe2+、Fe3+、CN-组成的一种立方晶胞如图所示(K+未画出)。
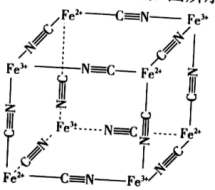
①在该晶胞中碳原子杂化类型为___ 。
②该晶胞内含有的K+数目为___ 。
③已知NA代表阿伏加德罗常数的值,晶胞边长为anm,则该晶体密度为__ g·cm-3。(只列计算式)
(1)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+
 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态铁原子,其自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态铁原子,其自旋磁量子数的代数和为(2)Fe、Co的第四电离能分别为5290kJ·mol-1、4950kJ·mol-1,铁的第四电离能大于钴的第四电离能的主要原因是
(3)维生素B12的结构如图所示。

①钴的配位数为
②CN-与Co3+形成配位键时CN-中C提供孤电子对,而不是N提供孤电子对,其主要原因可能是
(4)Ni(NH3)2Cl2有两种空间结构,中心离子为
(5)Fe2+与环戊二烯基形成化合物Fe(C5H5)2,称为二茂铁,二茂铁为橙黄色固体,易溶于乙醚、苯、乙醇等有机溶剂,其熔点为446K。由此推知,二茂铁晶体类型是
(6)由K+、Fe2+、Fe3+、CN-组成的一种立方晶胞如图所示(K+未画出)。

①在该晶胞中碳原子杂化类型为
②该晶胞内含有的K+数目为
③已知NA代表阿伏加德罗常数的值,晶胞边长为anm,则该晶体密度为
您最近一年使用:0次
2021-10-10更新
|
173次组卷
|
2卷引用:甘肃省白银市靖远县第四中学2022届高三10月月考化学试题
5 . 回答下列问题:
(1)尖晶石型过渡金属硫化物CuCo2S4由于具有较高的导电能力,辉钼(MoS2)被认为是极有希望代替最佳析氢电催化剂Pt的廉价过渡金属基催化材料,CuCo2S4和MoS2复合有望提高其电子传导效率并提升电催化活性,得到CuCo2S4—MoS2被广泛用于电化学领域。
①基态Cu原子的价层电子排布式为___ 。Co在周期表中的位置为___ ;基态S原子电子占据最高能级的电子云轮廓图为___ 形。
②Mo位于周期表第五周期ⅥB族,基态Mo原子核外有___ 种不同运动状态的电子。MoS2纳米粒子具有类似于石墨的层状结构,具有优异的润滑性能,其原因是___ 。
③Co原子通常用光谱分析法来鉴定,其原理是___ 。
(2)2,6—二甲基吡啶的锰合物是有机化学中常见的催化剂,其结构如图所示,回答下列问题:

①在该配合物中,Mn提供___ 。
②写出CO的等电子体___ (写2种)。
③该配合物中N的杂化方式为___ 。
(1)尖晶石型过渡金属硫化物CuCo2S4由于具有较高的导电能力,辉钼(MoS2)被认为是极有希望代替最佳析氢电催化剂Pt的廉价过渡金属基催化材料,CuCo2S4和MoS2复合有望提高其电子传导效率并提升电催化活性,得到CuCo2S4—MoS2被广泛用于电化学领域。
①基态Cu原子的价层电子排布式为
②Mo位于周期表第五周期ⅥB族,基态Mo原子核外有
③Co原子通常用光谱分析法来鉴定,其原理是
(2)2,6—二甲基吡啶的锰合物是有机化学中常见的催化剂,其结构如图所示,回答下列问题:

①在该配合物中,Mn提供
②写出CO的等电子体
③该配合物中N的杂化方式为
您最近一年使用:0次
名校
6 . 锌是一种重要的金属,锌及其化合物在生产生活中有着十分广泛的应用。
(1)基态锌原子的核外电子排布式为[Ar]___ 。
(2)在“Zn-e-→Zn+”过程中会__ (填“吸收”或“释放”)能量。
(3)代森锌是一种广谱杀菌剂,广泛用于防治各种麦的锈病、马铃薯晚疫病等蔬菜病害,遇水可分解为NH2—(CH2)2—NH2、CS2、H2S和ZnO。代森锌的结构简式如图所示。

①代森锌中Zn、N、S、H四种元素的电负性由大到小的次序为___ ,C原子的杂化轨道类型为___ 。
②NH2—(CH2)2—NH2、CS2、H2S三种化合物中沸点最高的是NH2—(CH2)2—NH2,其主要原因是___ 。
(4)[Zn(CN)4]2-形成的化合物可用作甲醛去除剂,[Zn(CN)4]2-中Zn2+与CN-之间的配位键中提供孤电子对的成键原子是___ (填元素符号),[Zn(CN)4]2-中σ键与π键的个数之比为___ 。
(5)化合物ZnS的晶胞结构如图,晶胞中部分离子的分数坐标如表所示,则ZnS晶胞结构中位置A的微粒为__ (填Zn2+或S2-),一个S2-周围等距离且最近的Zn2+构成的空间构型为___ ;已知ZnS晶体的密度为ρg·cm-3,则ZnS晶胞中的晶胞参数a=___ 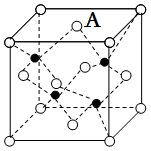
pm(用NA表示阿伏加德罗常数的值,列出计算式即可)。
(1)基态锌原子的核外电子排布式为[Ar]
(2)在“Zn-e-→Zn+”过程中会
(3)代森锌是一种广谱杀菌剂,广泛用于防治各种麦的锈病、马铃薯晚疫病等蔬菜病害,遇水可分解为NH2—(CH2)2—NH2、CS2、H2S和ZnO。代森锌的结构简式如图所示。

①代森锌中Zn、N、S、H四种元素的电负性由大到小的次序为
②NH2—(CH2)2—NH2、CS2、H2S三种化合物中沸点最高的是NH2—(CH2)2—NH2,其主要原因是
(4)[Zn(CN)4]2-形成的化合物可用作甲醛去除剂,[Zn(CN)4]2-中Zn2+与CN-之间的配位键中提供孤电子对的成键原子是
(5)化合物ZnS的晶胞结构如图,晶胞中部分离子的分数坐标如表所示,则ZnS晶胞结构中位置A的微粒为

pm(用NA表示阿伏加德罗常数的值,列出计算式即可)。
| 坐标 | x | y | z |
| S2- | 0.25 | 0.25 | 0.25 |
| Zn2+ | 0 | 0 | 1 |
您最近一年使用:0次
2021-09-26更新
|
80次组卷
|
2卷引用:甘肃省兰州市第二十七中学2022届高三上学期8月月考化学试题
解题方法
7 . 铬锆铜(CuCrZr)合金具有优良性能,广泛应用于机械制造工业的焊接。已知锆(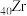 )位于第ⅣB族,根据要求回答下列问题:
)位于第ⅣB族,根据要求回答下列问题:
(1)铜元素在元素周期表的位置为_______ ,基态Cr原子的价电子排布式为_______ 。
(2)形成铬锆铜合金的元素中,基态原子的第一电离能最大的是_______ (填元素符号)。下表是Fe与Cu的部分电离能数据, (Cu)大于
(Cu)大于 (Fe)的主要原因是
(Fe)的主要原因是_______ 。
(3)配合物 中的配体是
中的配体是_______ ,该配合物中N、O的杂化轨道类型分别为_______ 、_______ 。
(4)硝酸铜[ ]是一种重要的工业原料,写出其阴离子(
]是一种重要的工业原料,写出其阴离子( )的空间构型:
)的空间构型:_______ 。
(5)铜与氯形成晶体的晶胞如图所示,该晶体的化学式为_______ ;已知晶胞边长为a nm, 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为_______  。
。

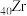 )位于第ⅣB族,根据要求回答下列问题:
)位于第ⅣB族,根据要求回答下列问题:(1)铜元素在元素周期表的位置为
(2)形成铬锆铜合金的元素中,基态原子的第一电离能最大的是
 (Cu)大于
(Cu)大于 (Fe)的主要原因是
(Fe)的主要原因是| 元素 | Fe | Cu |
第一电离能 | 759 | 746 |
第二电离能 | 1561 | 1958 |
(3)配合物
 中的配体是
中的配体是(4)硝酸铜[
 ]是一种重要的工业原料,写出其阴离子(
]是一种重要的工业原料,写出其阴离子( )的空间构型:
)的空间构型:(5)铜与氯形成晶体的晶胞如图所示,该晶体的化学式为
 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为 。
。
您最近一年使用:0次
20-21高三下·全国·阶段练习
名校
解题方法
8 . 我国科研工作者合成了含钼氧氟八面体的亚硒(碲)酸盐类二阶非线性光学晶体M[Ba(MoO2F)2(XO3)2(X=Se、Te)]和一种尖晶石结构多元金属(含Ag、Sn、In)硫族化合物半导体材料,并探索了材料的光电性质。回答下列问题:
(1)Mo是第五周期第ⅥB族元素,基态Mo2+价电子的自旋状态___________ (填“相同”或“相反”)。
(2)晶体M中非金属元素的电负性由大到小的顺序是___________ ,SeO 中Se的杂化方式为
中Se的杂化方式为___________ ,H2Te分子的立体构型为___________ 。
(3)氢键的本质是缺电子的氢原子和富电子的原子或原子团(比如大π键)之间的一种弱的电性作用,氯仿(CHCl3)易溶于苯是因为二者分子间形成了氢键,形成氢键的条件是___________ 。
(4)已知Ba、Mo的氯化物沸点信息如下表所示。二者沸点差异的原因是___________ 。
(5)NH3分子中H-N-H键角为107°,在[Ag(NH3)2]+中,H-N-H键角近似109.5°,键角变大的原因是___________ 。
(6)某多元金属硫族化合物的晶胞结构如图所示,其中In、Sn、S位于晶胞内,Ag有6个原子位于面心。
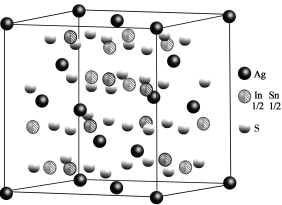
则该物质的化学式为___________ ,已知该晶胞的晶胞参数为a pm,阿伏加德罗常数值为NA,则密度=___________ g·cm−3(用含NA和a的计算式表示)。
(1)Mo是第五周期第ⅥB族元素,基态Mo2+价电子的自旋状态
(2)晶体M中非金属元素的电负性由大到小的顺序是
 中Se的杂化方式为
中Se的杂化方式为(3)氢键的本质是缺电子的氢原子和富电子的原子或原子团(比如大π键)之间的一种弱的电性作用,氯仿(CHCl3)易溶于苯是因为二者分子间形成了氢键,形成氢键的条件是
(4)已知Ba、Mo的氯化物沸点信息如下表所示。二者沸点差异的原因是
| 氯化物 | 沸点 |
| BaCl2 | 1560 ℃ |
| MoCl5 | 268 ℃ |
(6)某多元金属硫族化合物的晶胞结构如图所示,其中In、Sn、S位于晶胞内,Ag有6个原子位于面心。

则该物质的化学式为
您最近一年使用:0次
2021-04-13更新
|
870次组卷
|
7卷引用:甘肃省武威第六中学2021届高三下学期第五次诊断考试化学试题
甘肃省武威第六中学2021届高三下学期第五次诊断考试化学试题(已下线)化学-学科网2021年高三3月大联考(新课标Ⅲ卷)(含考试版+全解全析+参考答案+答题卡)(已下线)化学-学科网2021年高三3月大联考(新课标Ⅱ卷)(含考试版+全解全析+参考答案+答题卡)(已下线)学科网2021年高三3月大联考(新课标Ⅰ卷)学科网2021年高三3月大联考(新课标Ⅰ卷)湖南省长沙市第一中学2021届高三第一次模拟考试化学试题黑龙江省大庆铁人中学2021届高三下学期5月第三次模拟考试理综化学试题
名校
解题方法
9 . 日前新合成的砷化镉(Cd3As2)三维材料具有超强导电性,这种材料的电气性能与石墨烯相当,可代替石墨烯使用。
(1)Cd与Zn同族且相邻,若Zn基态原子将次外层1个d电子激发进入最外层的np能级,则该激发态原子的外围电子排布式为_______________ 。
(2)与砷(As)同主族的N、P两种元素的氢化物水溶液的碱性:NH3_____ PH3(填“>”或“<”),原因是__________________________ 。
(3)As与Ge、Se同周期且相邻,它们的第一电离能由大到小的顺序为_________ (用元素符号表示),原因是______________
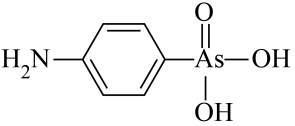
(4)含砷有机物“对氨基苯胂酸”的结构简式如图,As原子轨道杂化类型为_____ ,1mol对氨基苯胂酸含σ键数目为_______ 。
(5)砷化镉可以看作是石墨烯的3D版,其晶胞结构如图,As为面心立方堆积,Cd占据As围成的四面体空隙,空隙占有率75%,故Cd为“具有两个真空的立方晶格”,如图“①”和“②”位是“真空”。
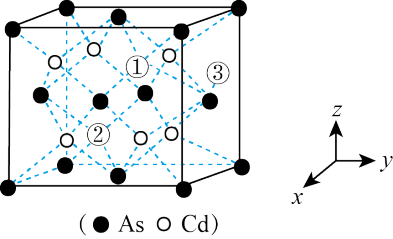
建立如图的原子坐标系,①号位的坐标为( ,
, ,
, ),则③号位原子坐标参数为
),则③号位原子坐标参数为_____ 。晶胞参数为apm,阿伏加德罗常数的值为NA,砷化镉的摩尔质量为M g·mol-1,则该晶胞的密度为_____________ g·cm-3(列计算式即可)。
(1)Cd与Zn同族且相邻,若Zn基态原子将次外层1个d电子激发进入最外层的np能级,则该激发态原子的外围电子排布式为
(2)与砷(As)同主族的N、P两种元素的氢化物水溶液的碱性:NH3
(3)As与Ge、Se同周期且相邻,它们的第一电离能由大到小的顺序为
(4)含砷有机物“对氨基苯胂酸”的结构简式如图,As原子轨道杂化类型为

(5)砷化镉可以看作是石墨烯的3D版,其晶胞结构如图,As为面心立方堆积,Cd占据As围成的四面体空隙,空隙占有率75%,故Cd为“具有两个真空的立方晶格”,如图“①”和“②”位是“真空”。

建立如图的原子坐标系,①号位的坐标为(
 ,
, ,
, ),则③号位原子坐标参数为
),则③号位原子坐标参数为
您最近一年使用:0次
2021-04-09更新
|
609次组卷
|
5卷引用:甘肃省民乐一中2021届高三5月第二次诊断考试理综化学试题
10 . Ⅰ.新型储氢材料是开发利用氢能的重要研究方向。
(1)Ti(BH4)3 是一种储氢材料,可由 TiCl4和 LiBH4反应制得。
①基态Ti3+的电子排布式为___________ ;基态 Cl 原子中,电子占据的最高能层符号为___________ ,该能层具有的原子轨道数为___________
②LiBH4由 Li+和 BH 构成,BH
构成,BH 的立体结构是
的立体结构是___________
(2)金属氢化物是具有良好发展前景的储氢材料。LiH 中,离子半径:Li+___________ H-(填“>”、“=”或“<”)
(3)氨硼烷(NH3BH3)含氢量高、热稳定性好,也是一种具有潜力的固体储氢材料。在 NH3BH3分子中,N—B化学键称为___________ 键,其电子对由___________ 提供。氨硼烷在催化剂作用下水解释放氢气:3NH3BH3+6H2O = 3NH3+ B3O +9H2, B3O
+9H2, B3O 的结构如图所示:
的结构如图所示: ;在该反应中,B 原子的杂化轨道类型由
;在该反应中,B 原子的杂化轨道类型由___________ 变为___________
Ⅱ.Cu2O 广泛应用于太阳能电池领域。以 CuSO4、NaOH和抗坏血酸为原料,可制备 Cu2O。
(1)Cu2+与 OH−反应能生成[Cu(OH)4]2−,[Cu(OH)4]2−中的配位原子为___________ (填元素符号)
(2)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为___________ ;推测抗坏血酸在水中的溶解性:___________ (填“难溶于水”或“易溶于水”)。

(1)Ti(BH4)3 是一种储氢材料,可由 TiCl4和 LiBH4反应制得。
①基态Ti3+的电子排布式为
②LiBH4由 Li+和 BH
 构成,BH
构成,BH 的立体结构是
的立体结构是(2)金属氢化物是具有良好发展前景的储氢材料。LiH 中,离子半径:Li+
(3)氨硼烷(NH3BH3)含氢量高、热稳定性好,也是一种具有潜力的固体储氢材料。在 NH3BH3分子中,N—B化学键称为
 +9H2, B3O
+9H2, B3O 的结构如图所示:
的结构如图所示: ;在该反应中,B 原子的杂化轨道类型由
;在该反应中,B 原子的杂化轨道类型由Ⅱ.Cu2O 广泛应用于太阳能电池领域。以 CuSO4、NaOH和抗坏血酸为原料,可制备 Cu2O。
(1)Cu2+与 OH−反应能生成[Cu(OH)4]2−,[Cu(OH)4]2−中的配位原子为
(2)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为

您最近一年使用:0次
2021-04-06更新
|
139次组卷
|
4卷引用:甘肃省兰州市第一中学2020-2021学年高二下学期4月月考化学试题
甘肃省兰州市第一中学2020-2021学年高二下学期4月月考化学试题(已下线)3.4 配合物与超分子(B级能力练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)内蒙古霍林郭勒市第一中学2021-2022学年高二下学期第一次月考化学试题内蒙古通辽市重点学校2022-2023学年高二下学期3月质量检测化学试题



