名校
解题方法
1 . 青铜器是我国古代瑰宝。目前,在工业上用磷化铜(Cu3P2)制造磷青铜,磷青铜是含少量钪、锡磷的铜合金,主要用作耐磨零件和弹性合金原件。
(1)基态Sc原子的核外电子排布式为____ ;其价电子中未成对电子数与成对电子数之比为___ 。
(2)①PH4I中的P原子的杂化方式是___ 。
②P与N同主族,气态氢化物的沸点:NH3____ PH3(填“>”或“<”),说明理由:___ 。
(3)磷青铜中的锡、磷两种元素电负性的大小为Sn___ P(填“>”“<”或“=”)。
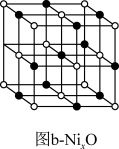
(4)某磷青铜晶胞结构如图所示。
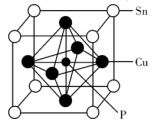
①则其化学式为____ 。
②该晶体中距离Sn原子最近的Cu原子有___ 个。
③若晶体密度为ρg/cm3,最近的Cu原子核间距为____ pm(用含ρ、NA的代数式表示)。
(1)基态Sc原子的核外电子排布式为
(2)①PH4I中的P原子的杂化方式是
②P与N同主族,气态氢化物的沸点:NH3
(3)磷青铜中的锡、磷两种元素电负性的大小为Sn
(4)某磷青铜晶胞结构如图所示。

①则其化学式为
②该晶体中距离Sn原子最近的Cu原子有
③若晶体密度为ρg/cm3,最近的Cu原子核间距为
您最近一年使用:0次
名校
2 . 回答下列各小题
(1)现代化学中,常利用_________ 上的特征谱线来鉴定元素。基态氮原子价电子排布图不是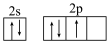 ,是因为该排布方式违背了
,是因为该排布方式违背了__________________ 。
(2)元素硒的基态原子的电子排布式简写为_________ ,第四周期中,与硒原子未成对电子数相同的金属元素有_________ 种。
(3)金属A的原子只有3个电子层,其第一至第四电离能如下:
则A原子的价层电子排布式为__________________ 。
(4)元素铜的第二电离能_________ (填“大于”“小于”或“等于”)锌的第二电离能。
(5) 、
、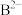 、
、 、D、E、
、D、E、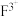 分别表示含10个电子的六种粒子(离子或分子)。其中:
分别表示含10个电子的六种粒子(离子或分子)。其中:
a. 、
、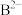 、
、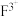 核外电子层结构相同 b.C是由两种元素组成的
核外电子层结构相同 b.C是由两种元素组成的
c.D是两种元素组成的四原子分子 d.E在常温下是无色液体
e.往含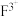 的溶液中滴加含
的溶液中滴加含 的溶液至过量,先有白色沉淀生成,后沉淀消失
的溶液至过量,先有白色沉淀生成,后沉淀消失
①D的空间构型为__________________ ;
②上述粒子中所含元素原子的第一电离能由大到小的顺序为_________ (用元素符号表示);
③用电子式表示 的形成过程
的形成过程____________________________________ ;
④与C组成元素相同且含18个电子的分子M中,孤电子对与 键的数目之比为
键的数目之比为_________ 。
(1)现代化学中,常利用
 ,是因为该排布方式违背了
,是因为该排布方式违背了(2)元素硒的基态原子的电子排布式简写为
(3)金属A的原子只有3个电子层,其第一至第四电离能如下:
电离能( ) ) |  |  |  |  |
| A | 932 | 1821 | 15390 | 21771 |
(4)元素铜的第二电离能
(5)
 、
、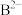 、
、 、D、E、
、D、E、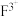 分别表示含10个电子的六种粒子(离子或分子)。其中:
分别表示含10个电子的六种粒子(离子或分子)。其中:a.
 、
、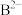 、
、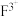 核外电子层结构相同 b.C是由两种元素组成的
核外电子层结构相同 b.C是由两种元素组成的c.D是两种元素组成的四原子分子 d.E在常温下是无色液体
e.往含
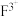 的溶液中滴加含
的溶液中滴加含 的溶液至过量,先有白色沉淀生成,后沉淀消失
的溶液至过量,先有白色沉淀生成,后沉淀消失①D的空间构型为
②上述粒子中所含元素原子的第一电离能由大到小的顺序为
③用电子式表示
 的形成过程
的形成过程④与C组成元素相同且含18个电子的分子M中,孤电子对与
 键的数目之比为
键的数目之比为
您最近一年使用:0次
名校
3 . 由于钒的化合物颜色鲜艳而多彩,因此以神话中斯堪的纳维亚女神“Vanadis"的名字命名。钒有多种化合价,如:+2、+3、+4、+5等,其化合物具有广泛的用途。请回答下列问题:
(1)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ ,表示,与之相反的用 -
,表示,与之相反的用 - 表示,称为电子的自旋磁量子数,则基态V3+核外电子的自旋磁量子数之和为
表示,称为电子的自旋磁量子数,则基态V3+核外电子的自旋磁量子数之和为___________ 。
(2)钒的一种配合物的结构简式为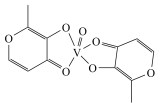 ,该配合物的组成元素的电负性由大到小的顺序是
,该配合物的组成元素的电负性由大到小的顺序是_______ (用元素符号表示),氧原子的杂化轨道类型为__________ ,该配合物分子中含有的化学键类型有________ (填标号)。
A.离子键 B.极性键 C.非极性键 D.配位键
(3)钒的含氧酸有正钒酸(H3VO4)、偏钒酸(HVO3)等,正钒酸、偏钒酸的酸性由强到弱的顺序是_____________ (用分子式表示),原因为________ 。
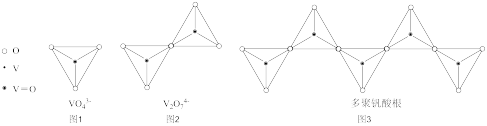
(4)钒的多种含氧酸根离子的结构如图所示,图3为一种无限长单链结构的多聚钒酸根,其化学式为__ 。
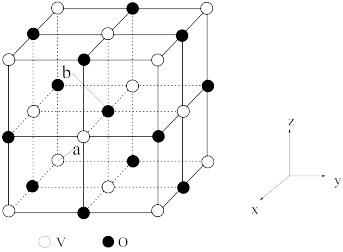
(5)钒的某种氧化物的立方晶胞如图所示,该氧化物的化学式为________________________ ;以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,若a点原子的分数坐标为(0,0,0),则b点原子的分数坐标为____________________ ;钒原子构成的八面体空隙与氧原子构成的八 面体空隙的数量比为_________________________ ;已知该氧化物晶体的密度为ρg·cm-3。则晶胞中距离最近的两个氧原子的核间距为_________________ pm(用NA表示阿伏加德罗常数的值,列出计算式即可)。
(1)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+
 ,表示,与之相反的用 -
,表示,与之相反的用 - 表示,称为电子的自旋磁量子数,则基态V3+核外电子的自旋磁量子数之和为
表示,称为电子的自旋磁量子数,则基态V3+核外电子的自旋磁量子数之和为(2)钒的一种配合物的结构简式为
 ,该配合物的组成元素的电负性由大到小的顺序是
,该配合物的组成元素的电负性由大到小的顺序是A.离子键 B.极性键 C.非极性键 D.配位键
(3)钒的含氧酸有正钒酸(H3VO4)、偏钒酸(HVO3)等,正钒酸、偏钒酸的酸性由强到弱的顺序是
(4)钒的多种含氧酸根离子的结构如图所示,图3为一种无限长单链结构的多聚钒酸根,其化学式为

(5)钒的某种氧化物的立方晶胞如图所示,该氧化物的化学式为

您最近一年使用:0次
名校
解题方法
4 . 铜是人类广泛使用的第一种金属,含铜物质在生产生活中有着广泛应用。回答下列问题:
(1)基态 原子最高能层的电子排布式为
原子最高能层的电子排布式为___________ 。
(2) 稀溶液中存在
稀溶液中存在 。已知d轨道也可以参与杂化,则
。已知d轨道也可以参与杂化,则 中
中 的杂化方式为___________(填选项字母)。
的杂化方式为___________(填选项字母)。
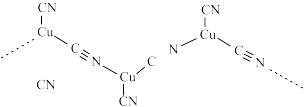
(3) 与
与 形成长链结构的阴离子如图所示,该阴离子中
形成长链结构的阴离子如图所示,该阴离子中 键与
键与 键数目之比为
键数目之比为___________ 。
(4)铜能与拟卤素 反应。拟卤素
反应。拟卤素 对应的酸有两种,理论上异硫氰酸
对应的酸有两种,理论上异硫氰酸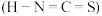 的沸点高于硫氰酸
的沸点高于硫氰酸 ,其原因为
,其原因为___________ ;写出一种与 互为等电子体的分子式
互为等电子体的分子式___________ 。
(5) 可形成
可形成 ,其中
,其中 代表
代表 。
。
①该化合物分子中, 模型为四面体或正四面体的非金属原子共有
模型为四面体或正四面体的非金属原子共有___________ 个。
②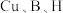 的电负性由大到小的顺序为
的电负性由大到小的顺序为___________ 。
(6)一种由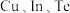 组成的高熵合金具有优良的热电性能,其四方晶胞如图所示:
组成的高熵合金具有优良的热电性能,其四方晶胞如图所示:
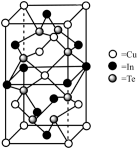
① 的配位数为
的配位数为___________ ;晶体中 原子填充在
原子填充在 、
、 围成的四面体空隙中,则四面体空隙的占有率为
围成的四面体空隙中,则四面体空隙的占有率为___________ 。
②若晶胞底边的边长均为 ,高为
,高为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,设晶体的最简式的式量为
,设晶体的最简式的式量为 ,则该晶体的密度为
,则该晶体的密度为___________  (列出计算式)。
(列出计算式)。
(1)基态
 原子最高能层的电子排布式为
原子最高能层的电子排布式为(2)
 稀溶液中存在
稀溶液中存在 。已知d轨道也可以参与杂化,则
。已知d轨道也可以参与杂化,则 中
中 的杂化方式为___________(填选项字母)。
的杂化方式为___________(填选项字母)。A. | B. | C. | D. |
 与
与 形成长链结构的阴离子如图所示,该阴离子中
形成长链结构的阴离子如图所示,该阴离子中 键与
键与 键数目之比为
键数目之比为
(4)铜能与拟卤素
 反应。拟卤素
反应。拟卤素 对应的酸有两种,理论上异硫氰酸
对应的酸有两种,理论上异硫氰酸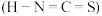 的沸点高于硫氰酸
的沸点高于硫氰酸 ,其原因为
,其原因为 互为等电子体的分子式
互为等电子体的分子式(5)
 可形成
可形成 ,其中
,其中 代表
代表 。
。①该化合物分子中,
 模型为四面体或正四面体的非金属原子共有
模型为四面体或正四面体的非金属原子共有②
 的电负性由大到小的顺序为
的电负性由大到小的顺序为(6)一种由
 组成的高熵合金具有优良的热电性能,其四方晶胞如图所示:
组成的高熵合金具有优良的热电性能,其四方晶胞如图所示:
①
 的配位数为
的配位数为 原子填充在
原子填充在 、
、 围成的四面体空隙中,则四面体空隙的占有率为
围成的四面体空隙中,则四面体空隙的占有率为②若晶胞底边的边长均为
 ,高为
,高为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,设晶体的最简式的式量为
,设晶体的最简式的式量为 ,则该晶体的密度为
,则该晶体的密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
2021-12-03更新
|
1003次组卷
|
5卷引用:河北省石家庄市2021-2022学年高三上学期毕业班教学质量检测(一)化学试题
河北省石家庄市2021-2022学年高三上学期毕业班教学质量检测(一)化学试题河北省石家庄市2022届高三上学期教学质量检测(一)化学试题(已下线)备战2022年高考化学精准检测卷【全国卷】20(已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)广东省佛山市李兆基中学、郑裕彤中学两校2021-2022学年高三下学期3月联考化学试题
名校
5 . 硼及其化合物广泛应用于开发新型储氢材料、超导材料、复合材料等高新材料领域。回答下列问题:
(1)硼单质有晶体硼和无定形硼两种,区分二者最可靠的方法为___ 。
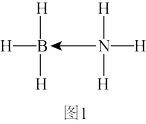
(2)氨硼烷(NH3BH3)是一种新型储氢材料,其分子中与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),结构式如图1。氨硼烷分子含元素中电负性最小的元素是____ (填元素符号,下同)。
(3)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。
①1molNH4BF4含有___ mol配位键。
②NH4BF4中BF 的空间构型为
的空间构型为___ 。
(4)硼酸(H3BO3)是一种结构为片层状的白色晶体。层内的H3BO3分子间通过氢键相连(如图2),H3BO3分子中B的杂化轨道类型为___ ,0.6molH3BO3晶体中有___ mol氢键。硼酸晶体在冷水中溶解度很小,但在热水中溶解度很大原因是___ 。
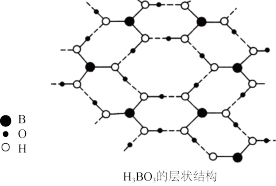
图2
(5)硼氢化钠是一种常用的还原剂,其晶胞结构如图3。
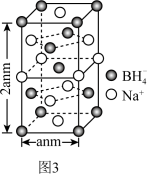
①该晶体中BH 的配位数为
的配位数为___ 。
②设NA为阿伏加德罗常数的值,则硼氢化钠晶体的密度ρ=___ (用含a、NA的最简式表示)g·cm-3。
(1)硼单质有晶体硼和无定形硼两种,区分二者最可靠的方法为
(2)氨硼烷(NH3BH3)是一种新型储氢材料,其分子中与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),结构式如图1。氨硼烷分子含元素中电负性最小的元素是

(3)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。
①1molNH4BF4含有
②NH4BF4中BF
 的空间构型为
的空间构型为(4)硼酸(H3BO3)是一种结构为片层状的白色晶体。层内的H3BO3分子间通过氢键相连(如图2),H3BO3分子中B的杂化轨道类型为

图2
(5)硼氢化钠是一种常用的还原剂,其晶胞结构如图3。

①该晶体中BH
 的配位数为
的配位数为②设NA为阿伏加德罗常数的值,则硼氢化钠晶体的密度ρ=
您最近一年使用:0次
名校
6 . 2019年10月1日,在庆祝中华人民共和国成立70周年的阅兵仪式上,最后亮相的DF-31A洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料中包含了 、
、 、
、 、
、 、B、P等多种元素。回答下列问题:
、B、P等多种元素。回答下列问题:
(1) 价电子轨道表示式为
价电子轨道表示式为_______ 。
(2)与 同周期且基态原子最外层电子数相同的元素,可能位于周期表中的
同周期且基态原子最外层电子数相同的元素,可能位于周期表中的_______ 区。
(3)铁元素能与 形成
形成 。羰基铁[
。羰基铁[ ]可用作催化剂、汽油抗爆剂等。1
]可用作催化剂、汽油抗爆剂等。1
 分子中σ键与π键的数目比为
分子中σ键与π键的数目比为_______ ,其中配位原子为_______ 。
(4)早在西汉时期的《淮南万毕术》中记载“曾青得铁则化为铜”,这是有关“湿法炼铜”最早文献记录。若向盛有硫酸铜的试管里加入氨水,首先生成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液。
①写出蓝色沉淀溶解的离子方程式_______ ;
②若向该深蓝色透明溶液中加入极性较小的溶剂(如乙醇),将有深蓝色晶体析出,写出该晶体的化学式_______ 。
(5)储氢合金能有效解决氢气的贮存和运输,对大规模使用氢能具有重要的意义。可用 和
和 处理储氢合金电极。
处理储氢合金电极。
① 中阴离子的空间构型是
中阴离子的空间构型是_______ ,写出一种与该阴离子互为等电子体的微粒_______ 。
② 中电负性最小的元素为
中电负性最小的元素为_______ 。 阴离子的中心原子的杂化类型是
阴离子的中心原子的杂化类型是_______ 。
(6) 晶体结构与
晶体结构与 相似,在氧气中加热,部分
相似,在氧气中加热,部分 被氧化为
被氧化为 ,成为
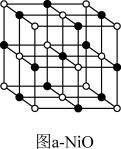
,成为 (
( ),出现晶体空位。氧化过程如图,图a中
),出现晶体空位。氧化过程如图,图a中 的配位数为
的配位数为_______ ,图b中x为_______ ,
_______ (最简整数比)。图b中,晶胞参数为428 ,则晶体密度为
,则晶体密度为_______  (
( 表示阿伏加德罗常数的值,列出表达式)。
表示阿伏加德罗常数的值,列出表达式)。

 、
、 、
、 、
、 、B、P等多种元素。回答下列问题:
、B、P等多种元素。回答下列问题:(1)
 价电子轨道表示式为
价电子轨道表示式为(2)与
 同周期且基态原子最外层电子数相同的元素,可能位于周期表中的
同周期且基态原子最外层电子数相同的元素,可能位于周期表中的(3)铁元素能与
 形成
形成 。羰基铁[
。羰基铁[ ]可用作催化剂、汽油抗爆剂等。1
]可用作催化剂、汽油抗爆剂等。1
 分子中σ键与π键的数目比为
分子中σ键与π键的数目比为(4)早在西汉时期的《淮南万毕术》中记载“曾青得铁则化为铜”,这是有关“湿法炼铜”最早文献记录。若向盛有硫酸铜的试管里加入氨水,首先生成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液。
①写出蓝色沉淀溶解的离子方程式
②若向该深蓝色透明溶液中加入极性较小的溶剂(如乙醇),将有深蓝色晶体析出,写出该晶体的化学式
(5)储氢合金能有效解决氢气的贮存和运输,对大规模使用氢能具有重要的意义。可用
 和
和 处理储氢合金电极。
处理储氢合金电极。①
 中阴离子的空间构型是
中阴离子的空间构型是②
 中电负性最小的元素为
中电负性最小的元素为 阴离子的中心原子的杂化类型是
阴离子的中心原子的杂化类型是(6)
 晶体结构与
晶体结构与 相似,在氧气中加热,部分
相似,在氧气中加热,部分 被氧化为
被氧化为 ,成为
,成为 (
( ),出现晶体空位。氧化过程如图,图a中
),出现晶体空位。氧化过程如图,图a中 的配位数为
的配位数为
 ,则晶体密度为
,则晶体密度为 (
( 表示阿伏加德罗常数的值,列出表达式)。
表示阿伏加德罗常数的值,列出表达式)。


您最近一年使用:0次
7 . 如表为四种短周期元素的相关信息
回答下列问题(注:涉及元素的均要用对应元素的元素符号书写作答)
(1)Y元素的最简单氢化物的空间构型是___ 。
(2)Z、Q、R相比,其原子半径由大到小的顺序是___ 。
(3)最高价的R与Z元素组成的化合物中R原子的杂化方式为___ ,其中R在周期表中的位置是__ ,R的基态原子电子排布式为___ 。
(4)与O3分子互为等电子体的一种分子为___ ,阴离子为__ 。
(5)Y与R相比,非金属性较强的是___ ,能证明这一结论的事实是___ 。(用化学方程式表示)
| 元素 | 元素的相关信息 |
| Y | 原子最外层电子数是次外层电子数的2倍 |
| Z | 地壳中含量最多的元素 |
| Q | 短周期中金属性最强 |
| R | 常温下,R的单质是淡黄色固体,常在火山喷口附近沉积 |
(1)Y元素的最简单氢化物的空间构型是
(2)Z、Q、R相比,其原子半径由大到小的顺序是
(3)最高价的R与Z元素组成的化合物中R原子的杂化方式为
(4)与O3分子互为等电子体的一种分子为
(5)Y与R相比,非金属性较强的是
您最近一年使用:0次
解题方法
8 . 回答下列问题
(1)C、N、O元素的第一电离能大小为:_________ 。
(2)Cu的价电子排布式 为___________ ,基态Fe原子有_____ 个未成对电子,Fe3+的价电子排布图 为________ 。
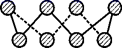
(3)基态硫原子中,核外占据最高能级电子的电子云轮廓图形状为_________ 。硫的一种同素异形体分子式为S8,其结构如图所示,其中S原子的杂化轨道类型为______ 。
(4)Se(元素周期表中位于S正下方)原子序数为___ ,其核外M层电子的排布式为_________ ;
(5)H2Se的稳定性比H2S_____________ (填“强”或“弱”)。SeO3分子的立体构型为______ 。
(6)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从原子核外电子结构角度来看,Fe2+ 易被氧化成Fe3+的原因是___________ 。
(1)C、N、O元素的第一电离能大小为:
(2)Cu的
(3)基态硫原子中,核外占据最高能级电子的电子云轮廓图形状为

(4)Se(元素周期表中位于S正下方)原子序数为
(5)H2Se的稳定性比H2S
(6)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从原子核外电子结构角度来看,Fe2+ 易被氧化成Fe3+的原因是
您最近一年使用:0次
名校
解题方法
9 . 将金属元素Al掺杂到TiN多层膜中,能有效地改善纳米多层膜的耐磨性。回答下列问题:
(1)下列状态的N原子或离子在跃迁时,用光谱仪可捕捉到发射光谱的是___________ (填序号,下同),未成对电子最多的是___________ 。
a. ls22s22p3 b. 1s22s2 c. 1s22s12p4 d. 1s22s12p3
(2)Ti元素位于元素周期表的第四周期第___________ 族,基态Ti原子的次外层电子数为___________ 。
(3)第二周期元素中,第一电离能比N大的元素有___________ 。(填元素符号)
(4)叠氮酸根N 的几何构型为
的几何构型为___________ ,而1 mol亚硝酸根NO 中含有的价层电子对数目为
中含有的价层电子对数目为___________ 。
(5)Mg的熔点是648℃,而Al的熔点是660℃,分析熔点更高的原因是___________ 。
(6)用Al掺杂TiN后(晶胞结构中只是铝原子部分代替钛原子),其晶胞结构如图所示,距离Ti最近的Al有___________ 个、掺杂Al后的晶体密度是 TiN晶体的___________ 倍,已知掺杂后的晶体密度为ρ g/cm3,阿伏加德罗常数的值为NA,原子①与原子②距离为___________ nm。

(1)下列状态的N原子或离子在跃迁时,用光谱仪可捕捉到发射光谱的是
a. ls22s22p3 b. 1s22s2 c. 1s22s12p4 d. 1s22s12p3
(2)Ti元素位于元素周期表的第四周期第
(3)第二周期元素中,第一电离能比N大的元素有
(4)叠氮酸根N
 的几何构型为
的几何构型为 中含有的价层电子对数目为
中含有的价层电子对数目为(5)Mg的熔点是648℃,而Al的熔点是660℃,分析熔点更高的原因是
(6)用Al掺杂TiN后(晶胞结构中只是铝原子部分代替钛原子),其晶胞结构如图所示,距离Ti最近的Al有

您最近一年使用:0次
名校
解题方法
10 . 半导体砷化硼具有超高的导热系数,有助于电子器件降温散热。回答下列问题:
(1)基态砷原子的电子排布式为_______ 。
(2)实验测得,砷原子的第一电离能大于硒原子的第一电离能,原因是_______ 。
(3)三氧化二砷的分子结构如图所示,分子中砷原子的杂化方式是_______ ,氧原子的杂化方式是_______ 。

(4) 分子中,与N原子相连的H呈正电性(
分子中,与N原子相连的H呈正电性( ),与B原子相连的H呈负电性(
),与B原子相连的H呈负电性(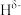 ),则H、B、N电负性大小顺序是
),则H、B、N电负性大小顺序是_______ 。
(5)已知:
①亚磷酸的结构式为_______ 。
②硼酸溶于水的电离方程式为_______ 。
(6)砷化硼的晶胞结构如图(a)所示,图(b)中矩形AA′CC′是沿晶胞对角面取得的截图。

①若晶胞的边长均为apm,阿伏加德罗常数的值为 ,晶体的密度为
,晶体的密度为_______  (列出计算表达式)。
(列出计算表达式)。
②晶胞中各原子在矩形AA′CC′的位置为_______ (填标号)。
A. B.
B. C.
C. D.
D.
(1)基态砷原子的电子排布式为
(2)实验测得,砷原子的第一电离能大于硒原子的第一电离能,原因是
(3)三氧化二砷的分子结构如图所示,分子中砷原子的杂化方式是

(4)
 分子中,与N原子相连的H呈正电性(
分子中,与N原子相连的H呈正电性(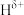 ),与B原子相连的H呈负电性(
),与B原子相连的H呈负电性(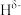 ),则H、B、N电负性大小顺序是
),则H、B、N电负性大小顺序是(5)已知:
| 名称 | 硼酸 | 亚砷酸 | 亚磷酸 |
| 分子式 |  |  |  |
| 结构式 |  |  | |
| 类型 | 一元弱酸 | 三元弱酸 | 二元弱酸 |
①亚磷酸的结构式为
②硼酸溶于水的电离方程式为
(6)砷化硼的晶胞结构如图(a)所示,图(b)中矩形AA′CC′是沿晶胞对角面取得的截图。

①若晶胞的边长均为apm,阿伏加德罗常数的值为
 ,晶体的密度为
,晶体的密度为 (列出计算表达式)。
(列出计算表达式)。②晶胞中各原子在矩形AA′CC′的位置为
A.
 B.
B. C.
C. D.
D.
您最近一年使用:0次
2021-10-29更新
|
326次组卷
|
6卷引用:河北省唐山市2021-2022学年高三上学期开学摸底考试化学试题
河北省唐山市2021-2022学年高三上学期开学摸底考试化学试题河北省石家庄市第二十二中学2022届高三10月月考化学试题湖南省益阳市沅江市第一中学2022届高三下学期期中考试化学试题(已下线)押新高考卷15题 物质结构与性质综合题-备战2022年高考化学临考题号押题(新高考通版)山东省济宁市邹城市孟子湖中学2021-2022学年高三下学期开学考试化学试题(已下线)专题02 物质结构专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)



