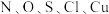 五种元素的单质及其化合物在现代工业生产中有着广泛应用。请回答下列问题:
五种元素的单质及其化合物在现代工业生产中有着广泛应用。请回答下列问题:(1)第一电离能:N
(2)
 极易溶于水的原因是
极易溶于水的原因是 属于
属于 含有
含有 的键为
的键为 。
。(3)
 的空间构型是
的空间构型是 的中心原子的杂化方式为
的中心原子的杂化方式为(4)与
 互为等电子体的微粒有
互为等电子体的微粒有(5)
 与
与 形成化合物的晶胞如图所示。
形成化合物的晶胞如图所示。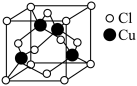
该晶体的化学式为
 原子和
原子和 原子之间的最短距离为
原子之间的最短距离为 ,且恰好为体对角线的
,且恰好为体对角线的 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶体的密度为
,则该晶体的密度为 。
。
相似题推荐
(1)基态Fe 的价电子排布图为
(2)已知Al 的第一电离能为 578kJ/mol、第二电离能为 1817 kJ/mol、第三电离能为 2745 kJ/mol、第四电离能为 11575 kJ/mol。 请解释其第二电离能增幅较大的原因
(3)已知氯化铝熔点为 194℃, 熔融状态下不导电且容易升华,由此可判断氯化铝属于
(4)铁系元素能与 CO 形成 Fe(CO)5、Ni(CO)4等金属羰基配合物。 与 CO 互为等电子体的分子和离子分别为
(5)往硫酸铜溶液中加入过量氨水,可形成[Cu(NH3)4]SO4溶液,该溶液可用于溶解纤维素。在[Cu(NH3)4]SO4中,配离子所含有的化学键为
(6)碳酸亚铁中所含非金属元素的电负性由大到小的顺序为
(7)当温度升高到 912℃,铁转变为面心立方堆积方式
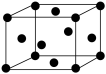 ,距离一个顶点铁原子最近的铁原子有
,距离一个顶点铁原子最近的铁原子有【推荐2】铁系元素是人体必需的微量元素, Fe3+可以与KSCN溶液、苯酚等发生显色作用。镁元素也是人体所必需的阳离子元素之一,它能够维持核酸结构的稳定性,调节机体免疫功能,对人体抵抗新冠病毒等病毒侵袭起着重要作用。
(1)Fe3+的基态核外电子排布式为
(2)与SCN−互为等电子体且为非极性分子的化学式为
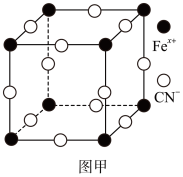
(3)普鲁士蓝俗称铁蓝,晶胞如图甲所示(K+未画出),平均每两个晶胞立方体中含有一个K+,又知该晶体中铁元素有+2价和+3价两种,则Fe3+与Fe2+的个数比为
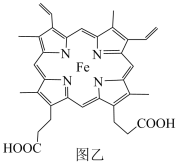
(4)血红素铁(图乙)用作铁强化剂,其吸收率比一般铁剂高3倍,在图乙中画出Fe2+与N原子间的化学键(若是配位键,需要用箭头加以表示)
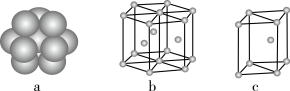
(5)镁单质晶体中原子的堆积模型如图,它的堆积模型名称为
(1)金属铁的紧密堆积方式为
(2)HCN 分子的结构式为
(3)K2CO3中阴离子的空间构型为
(4)配合物K4Fe(CN)6的中心离子的电子排布式为
(5)上述化学方程式中C、N、O的第一电离能由小到大的顺序为
(6)冰的晶体结构模型如图1,它的晶胞与金刚石的晶胞相似,如图2,水分子之间以氢键相连接,在一个晶胞中有
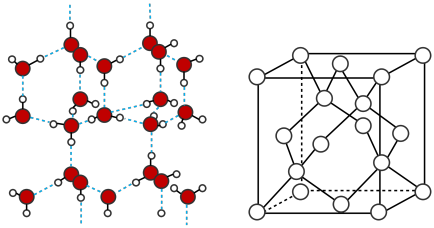
图1 图2
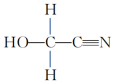
(1)基态Zn2+核外电子排布式为
(2)1molHCHO分子中含有σ键为
(3)HOCH2CN分子中碳原子轨道的杂化类型是
II.M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(4)Z位于元素周期表
(5)X氢化物的沸点低于与其组成相似的M的氢化物,其原因是
(6)X与M形成的XM3分子的空间结构是
(一)如
 ,是新型锂离子电池的电极材料,可采用
,是新型锂离子电池的电极材料,可采用 、
、 、LiC1和苯胺等作为原料制备。
、LiC1和苯胺等作为原料制备。(1)基态铁原子的价电子排布式为
 中,除氢元素外,其余三种元素第一电离能最大的是
中,除氢元素外,其余三种元素第一电离能最大的是(2)
 的熔点为306℃,沸点为315℃,
的熔点为306℃,沸点为315℃, 的晶体类型是
的晶体类型是(3)苯胺(
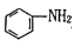 )和
)和 中的N原子杂化方式分别为
中的N原子杂化方式分别为(4)苯胺和甲苯相对分子质量接近,但苯胺熔点比甲苯的高,原因是
(二)。氮、磷、砷、锑等第ⅤA族元素及其化合物在生产、生活中用途广泛。
(5)白磷在氯气中燃烧可得到
 和
和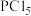 ,气态
,气态 分子的立体构型为
分子的立体构型为(6)锑酸亚铁晶胞如图所示,其晶胞参数分别为a nm、b nm、c nm,
 ,
,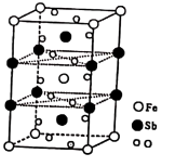
①锑酸亚铁的化学式为
②晶体的密度为
 (设
(设 为阿伏加德罗常数的值)。(1nm=10-7cm)
为阿伏加德罗常数的值)。(1nm=10-7cm)
(1)基态硫原子价层电子的轨道表达式(电子排布图)为
(2)与硫同族的硒元素有两种常见的二元含氧酸,请比较它们酸性强弱
(3)H2S的键角
(4)Cu3N的晶胞结构如图,N3-的配位数为

| A | |||||||||||||||||
| C | D | E | F | ||||||||||||||
| G | H | I | J | K | |||||||||||||
| L | M | N | B | ||||||||||||||
试回答下列问题:
(1)请写出元素M的价电子排布式
(2)B在周期表中的位置
(3)E,G,H简单离子半径由大到小的顺序(用离子符号表示)
(4)由A、C、E形成的CA2E分子结构式为
(5)LK2熔点高于IK3的原因
(6)在基态N中,电子占据的最高能层符号为
(7)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是
(1)与
 互为等电子体的微粒有
互为等电子体的微粒有(2)H2O的沸点比H2S高的原因是
(3)Cu与Cl形成化合物的晶胞如图所示。
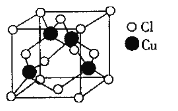
该晶体的化学式为
 ,阿伏加德罗常数为NA,则该晶体的密度为
,阿伏加德罗常数为NA,则该晶体的密度为(1)X的单质叫做
(2)Y的氢化物属于
(3)Z元素位于周期表的第
(4)X与Z形成的化合物可用电子式表示为
(1)K和Cr属于同一周期,基态Cr原子的价电子排布式为
(2)单质钾比铬的熔点
(3)硼砂的阴离子结构如图1,1mol该离子含有配位键数目为
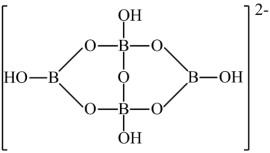
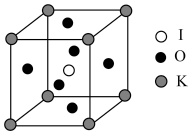
图1 图2
(4)KIO3晶体的晶胞为立方体,棱长为anm,晶胞中K、I、O分别处于顶点、体心,面心位置,如图2。两个氧原子的最短距离为
(1)Cr3+电子排布式为
(2)翡翠中主要成分为硅酸铝钠,四种元素的第一电离能由大到小的顺序
(3)锰的一种化合物的化学式为Mn(BH4)2(THF)3,THT的结构简式如图所示:
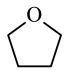
①THF中C原子的杂化轨道类型为
③NaBH4所含化学键类型有
A、离子键 B、共价键 C、氢键 D、配位键
(4)MnO的熔点(1660℃)比MnS的熔点(1610℃)高,原因
(5)Ni可以形成多种氧化物,其中一种NixO晶体的晶胞结构为NaCl型,由于晶体缺陷,x为0.88,且晶体中Ni的存在形式为Ni2+、Ni3+,则晶体中N i2+和Ni3+最简整数比为
(1)硅酸盐中Si元素一般显+4价,如下图所示是一种无限长单键的多聚硅酸根离子的结构,其中“
 ”表示Si原子,“o”表示氧原子,则该长链硅酸根离子的通式为
”表示Si原子,“o”表示氧原子,则该长链硅酸根离子的通式为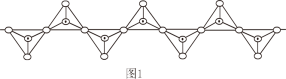
 )。
)。①Na2GeO3中锗原子的杂化方式是
②推测1mol
 中含有的σ键的数目是
中含有的σ键的数目是 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。(3)氯化铝熔点194℃,会升华,熔融态不易导电。实验测得气态氯化铝分子组成式为Al2Cl6,其结构式为
A.离子键 B.配位键 C.氢键 D.范德华力 E.金属键 F.非极性共价键
(4)利用离子液体
 可电沉积还原金属Ge,其熔点只有7℃,其中
可电沉积还原金属Ge,其熔点只有7℃,其中 结构如图所示。
结构如图所示。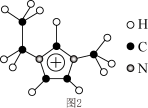
②
 中组成元素的电负性由小到大的顺序是
中组成元素的电负性由小到大的顺序是③[AlCl4]-的空间构型为
(5)石墨晶体的二维平面结构如图3所示,晶胞结构如图4所示。试回答:
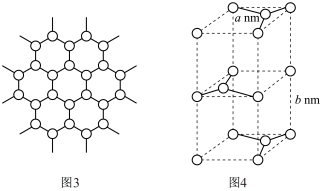
②根据图4计算石墨晶体的密度是
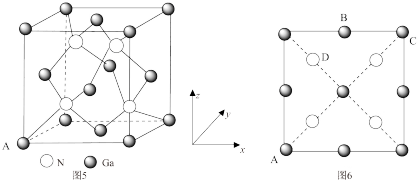
(6)氮化镓是一种重要的半导体材料,其晶胞结构如图5所示,已知晶胞边长为apm,图6为甲图的俯视图,A点坐标为(0,0,0),B点坐标为
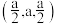 ,则D点坐标为
,则D点坐标为 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值 为
为