2021·全国·模拟预测
1 . 元素及其化合物在生产、生活中用途广泛。
(1)①P4S3常用于制造火柴,P和S的第一电离能较大的是___________ 。
②As4S4俗称雄黄,其中基态As原子的核外电子排布式为[Ar]___________ ,有___________ 个未成对电子。
③NH3、PH3、AsH3中沸点最高的是___________ ,其主要原因是___________ 。
(2)①Fe、Co、Ni能与Cl2反应,其中Co和Ni均生成二氯化物,由此推断FeCl3、CoCl3和Cl2的氧化性由强到弱的顺序为_____ 。
②研究发现固态PCl5和PBr5均为离子晶体,但其结构分别为[PCl4]+[PCl6]-和[PBr4]+Br-,分析PCl5和PBr5结构存在差异的原因是____ 。
(3)锑酸亚铁晶胞如图所示,其晶胞参数分别为anm、bnm、cnm,α=β=γ=90°,则:
①锑酸亚铁的化学式为___________ 。
②晶体的密度为___________ g•cm-3.(设NA为阿伏加德罗常数的值)

(1)①P4S3常用于制造火柴,P和S的第一电离能较大的是
②As4S4俗称雄黄,其中基态As原子的核外电子排布式为[Ar]
③NH3、PH3、AsH3中沸点最高的是
(2)①Fe、Co、Ni能与Cl2反应,其中Co和Ni均生成二氯化物,由此推断FeCl3、CoCl3和Cl2的氧化性由强到弱的顺序为
②研究发现固态PCl5和PBr5均为离子晶体,但其结构分别为[PCl4]+[PCl6]-和[PBr4]+Br-,分析PCl5和PBr5结构存在差异的原因是
(3)锑酸亚铁晶胞如图所示,其晶胞参数分别为anm、bnm、cnm,α=β=γ=90°,则:
①锑酸亚铁的化学式为
②晶体的密度为

您最近一年使用:0次
解题方法
2 . 镍及其化合物用途广泛,可用作催化剂、合金、电器元件等。回答下列问题:
(1)基态 原子价电子的轨道表示式为
原子价电子的轨道表示式为___________ 。
(2) 是制取镍盐、碱性蓄电池的原料。
是制取镍盐、碱性蓄电池的原料。 与异乙腈(
与异乙腈( )可发生生成单质镍的配合物:
)可发生生成单质镍的配合物: 。
。 (结构简式为
(结构简式为 )分子中碳原子的杂化方式为
)分子中碳原子的杂化方式为___________ ;设 为阿伏加德罗常数的值,则
为阿伏加德罗常数的值,则 中σ键的数目为
中σ键的数目为___________ 。
(3) 常温下呈液态,其空间构型为正四面体。解释其易溶于
常温下呈液态,其空间构型为正四面体。解释其易溶于 、苯等有机溶剂的原因:
、苯等有机溶剂的原因:___________ 。
(4)在镍的催化作用下,3-甲基呋喃与氨在高温下反应得到3-甲基吡咯。

①C、N、O的第一电离能由大到小顺序为___________ 。
②3-甲基吡咯的熔、沸点高于3-甲基呋喃的原因是___________ 。
(5)镍的氧化物也常用作催化剂, 的晶胞结构如图所示,其中阴离子采用面心立方最密堆积方式,则该晶体的密度为
的晶胞结构如图所示,其中阴离子采用面心立方最密堆积方式,则该晶体的密度为___________ 
___________ nm。

(1)基态
 原子价电子的轨道表示式为
原子价电子的轨道表示式为(2)
 是制取镍盐、碱性蓄电池的原料。
是制取镍盐、碱性蓄电池的原料。 与异乙腈(
与异乙腈( )可发生生成单质镍的配合物:
)可发生生成单质镍的配合物: 。
。 (结构简式为
(结构简式为 )分子中碳原子的杂化方式为
)分子中碳原子的杂化方式为 为阿伏加德罗常数的值,则
为阿伏加德罗常数的值,则 中σ键的数目为
中σ键的数目为(3)
 常温下呈液态,其空间构型为正四面体。解释其易溶于
常温下呈液态,其空间构型为正四面体。解释其易溶于 、苯等有机溶剂的原因:
、苯等有机溶剂的原因:(4)在镍的催化作用下,3-甲基呋喃与氨在高温下反应得到3-甲基吡咯。

①C、N、O的第一电离能由大到小顺序为
②3-甲基吡咯的熔、沸点高于3-甲基呋喃的原因是
(5)镍的氧化物也常用作催化剂,
 的晶胞结构如图所示,其中阴离子采用面心立方最密堆积方式,则该晶体的密度为
的晶胞结构如图所示,其中阴离子采用面心立方最密堆积方式,则该晶体的密度为

您最近一年使用:0次
名校
3 . 含氟化合物在生产、生活和科研中应用广泛。回答下列问题:
(1)我国自主研发的氟硼铍酸钾(KBe2BO3F2)晶体用于制造深紫外固体激光器,可用于高温超导、催化剂等领域研究。
①基态F原子核外电子的空间运动状态有__ 种。
②B、O、F的第一电子亲和能(指元素的一个基态的气态原子得到一个电子形成-1价气态阴离子时所放出的能量)由大到小的顺序为__ (填元素符号)。
③BeCl2中的化学键具有明显的共价性,可形成双聚或多聚分子,其中双聚分子的结构式为__ ,多聚分子的链节中Be的配位数为__ 。
(2)NaF、KF的晶体结构相似,两者中熔点较高的是__ ,其原因是__ 。
(3)X射线衍射等测定发现,I3AsF6中存在I 和AsF
和AsF 离子。根据价层电子对互斥理论,AsF
离子。根据价层电子对互斥理论,AsF 离子中As的价层电子对数为
离子中As的价层电子对数为__ ,判断中心原子As的杂化形式并预测AsF 离子的几何构型分别为
离子的几何构型分别为__ (填标号)。
A.sp2、平面正三角形 B.sp3、正四面体 C.sp3d、三角双锥 D.sp3d2、正八面体
(4)β—KrF2晶胞属于四方晶系(晶胞参数:a=b≠c, =β=γ=90°),其结构如图所示(顶角上分子轴线与x轴或y轴夹角为45°)。该晶胞中含
=β=γ=90°),其结构如图所示(顶角上分子轴线与x轴或y轴夹角为45°)。该晶胞中含___ 个KrF2;若中心位置的氪原子(A)与顶角的氪原子(B)的核间距为dpm,顶面上的两个氟原子的核间距为271pm,Kr—F键长为189pm,则晶胞参数c=__ pm(列出计算式即可)。

(1)我国自主研发的氟硼铍酸钾(KBe2BO3F2)晶体用于制造深紫外固体激光器,可用于高温超导、催化剂等领域研究。
①基态F原子核外电子的空间运动状态有
②B、O、F的第一电子亲和能(指元素的一个基态的气态原子得到一个电子形成-1价气态阴离子时所放出的能量)由大到小的顺序为
③BeCl2中的化学键具有明显的共价性,可形成双聚或多聚分子,其中双聚分子的结构式为
(2)NaF、KF的晶体结构相似,两者中熔点较高的是
(3)X射线衍射等测定发现,I3AsF6中存在I
 和AsF
和AsF 离子。根据价层电子对互斥理论,AsF
离子。根据价层电子对互斥理论,AsF 离子中As的价层电子对数为
离子中As的价层电子对数为 离子的几何构型分别为
离子的几何构型分别为A.sp2、平面正三角形 B.sp3、正四面体 C.sp3d、三角双锥 D.sp3d2、正八面体
(4)β—KrF2晶胞属于四方晶系(晶胞参数:a=b≠c,
 =β=γ=90°),其结构如图所示(顶角上分子轴线与x轴或y轴夹角为45°)。该晶胞中含
=β=γ=90°),其结构如图所示(顶角上分子轴线与x轴或y轴夹角为45°)。该晶胞中含
您最近一年使用:0次
4 . 主族元素 、
、 、
、 、
、 、
、 等的某些化合物对工农业生产意义重大,回答下列问题:
等的某些化合物对工农业生产意义重大,回答下列问题:
(1) 、
、 、
、 电负性由大到小的顺序为
电负性由大到小的顺序为___________ , 的第一电离能比
的第一电离能比 的第一电离能大的原因为
的第一电离能大的原因为___________ 。
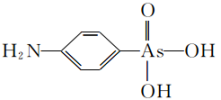
(2)阿散酸(如图)是一种饲料添加剂,能溶于 溶液中,常含有
溶液中,常含有 、
、 等杂质,该结构中
等杂质,该结构中 的杂化方式为
的杂化方式为___________ , 的空间构型为
的空间构型为___________ 。
(3)液氨可作制冷剂,汽化时吸收大量的热的原因是___________ 。
(4) 能与
能与 、
、 形成配位数为6的配合物,且相应两种配体的物质的量之比为
形成配位数为6的配合物,且相应两种配体的物质的量之比为 ,
, 该配合物溶于水,加入足量的硝酸银溶液可得
该配合物溶于水,加入足量的硝酸银溶液可得 白色沉淀,则该配合物的化学式为
白色沉淀,则该配合物的化学式为___________ 。
(5) 的结构中
的结构中 为面心立方最密堆积,晶胞结构如图所示。
为面心立方最密堆积,晶胞结构如图所示。

① 中
中 的配位数为
的配位数为___________ 。
②若该晶体的晶胞参数为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 的密度
的密度
___________ (列出表达式) 。
。
 、
、 、
、 、
、 、
、 等的某些化合物对工农业生产意义重大,回答下列问题:
等的某些化合物对工农业生产意义重大,回答下列问题:(1)
 、
、 、
、 电负性由大到小的顺序为
电负性由大到小的顺序为 的第一电离能比
的第一电离能比 的第一电离能大的原因为
的第一电离能大的原因为(2)阿散酸(如图)是一种饲料添加剂,能溶于
 溶液中,常含有
溶液中,常含有 、
、 等杂质,该结构中
等杂质,该结构中 的杂化方式为
的杂化方式为 的空间构型为
的空间构型为
(3)液氨可作制冷剂,汽化时吸收大量的热的原因是
(4)
 能与
能与 、
、 形成配位数为6的配合物,且相应两种配体的物质的量之比为
形成配位数为6的配合物,且相应两种配体的物质的量之比为 ,
, 该配合物溶于水,加入足量的硝酸银溶液可得
该配合物溶于水,加入足量的硝酸银溶液可得 白色沉淀,则该配合物的化学式为
白色沉淀,则该配合物的化学式为(5)
 的结构中
的结构中 为面心立方最密堆积,晶胞结构如图所示。
为面心立方最密堆积,晶胞结构如图所示。
①
 中
中 的配位数为
的配位数为②若该晶体的晶胞参数为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 的密度
的密度
 。
。
您最近一年使用:0次
名校
5 . 铜是人类最早使用的金属之一,其用黄铜矿(主要成分为CuFeS2)生产粗铜的反应原理如下:回答下列问题:

(1)Cu在周期表中的位置是___________ , 其晶体中原子堆积方式为__________ , 晶胞空间利用率为______ (用含π的式子表示)。
(2)反应①、②中都会生成气体SO2,S和O相比,第一电离能较小的是_____ ;SO2分子中心原子的杂化方式为_________ ,与之互为等电子体的分子有_____ (写一种)。
(3)已知Cu2O的熔点为1235°C, Cu2S 的熔点为1130°C, 请解释Cu2O熔点较高的原因是_____ 。
(4)工业上常用铜氨溶液制造人造丝,某学生做了如下实验: CuSO4溶液 蓝色沉淀
蓝色沉淀 深蓝色溶液,蓝色沉淀溶于氨水的离子方程式为
深蓝色溶液,蓝色沉淀溶于氨水的离子方程式为_____ 。
(5)Cu2O的晶胞结构如图所示,B代表的是_____ (选填Cu或O) ;若原子坐标参数A为(0,0,0), B为( ,
, ,
, ),则C原子的坐标参数为
),则C原子的坐标参数为_____ 。若该晶体的密度为dg/cm3,阿伏加德罗常数的值为NA,则该晶胞中Cu原子与O原子之间的距离为_____ pm。(用含d和NA的式子表示)。


(1)Cu在周期表中的位置是
(2)反应①、②中都会生成气体SO2,S和O相比,第一电离能较小的是
(3)已知Cu2O的熔点为1235°C, Cu2S 的熔点为1130°C, 请解释Cu2O熔点较高的原因是
(4)工业上常用铜氨溶液制造人造丝,某学生做了如下实验: CuSO4溶液
 蓝色沉淀
蓝色沉淀 深蓝色溶液,蓝色沉淀溶于氨水的离子方程式为
深蓝色溶液,蓝色沉淀溶于氨水的离子方程式为(5)Cu2O的晶胞结构如图所示,B代表的是
 ,
, ,
, ),则C原子的坐标参数为
),则C原子的坐标参数为
您最近一年使用:0次
名校
6 . 已知A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素,E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子。G元素最大能层符号为N,有4个单电子。
(1)基态E原子的价电子排布图___________ 。
(2)B、C、D三元素第一电离能由大到小的顺序为___________ (用元素符号表示)。
(3) 中心原子为
中心原子为___________ 杂化,空间构型为___________ ,键角___________  (用“>、<、=”填空)。
(用“>、<、=”填空)。
(4) 与C2为等电子体结构相似,1mol
与C2为等电子体结构相似,1mol 中含有
中含有 键的数目为
键的数目为___________ 。
(5)D、E元素最简单氢化物的稳定性___________ (填化学式)。
(6)基态G2+离子的电子排布式为:___________ 。
(1)基态E原子的价电子排布图
(2)B、C、D三元素第一电离能由大到小的顺序为
(3)
 中心原子为
中心原子为 (用“>、<、=”填空)。
(用“>、<、=”填空)。(4)
 与C2为等电子体结构相似,1mol
与C2为等电子体结构相似,1mol 中含有
中含有 键的数目为
键的数目为(5)D、E元素最简单氢化物的稳定性
(6)基态G2+离子的电子排布式为:
您最近一年使用:0次
解题方法
7 . W、X、Y、Z、M、Q是元素周期表中前四周期的元素,原子序数依次增大,其有关信息如表所示:
回答下列问题:
(1)X核外电子的运动状态有___________ 种。
(2)M基态原子的电子排布式为___________ 。
(3)基态Q2+的价电子轨道表示式为___________ 。
(4)M的第一电离能___________ (填“大于”或“小于”)Q的第一电离能,原因为___________ 。
(5)[Q(Y2W4)2(Y3)2]n是一种应用广泛的配合物,其结构式为 ,其中Y2W4、Y
,其中Y2W4、Y 是两种配体,中心Q离子的配位数为
是两种配体,中心Q离子的配位数为___________ 。Y2W4的电子式为___________ 。Y 中心原子的杂化类型为
中心原子的杂化类型为___________ 。
(6)Y的简单氢化物极易溶于Z的简单氢化物的原因与氢键有关,所形成的化合物分子合理的结构式为___________ ,理由是___________ 。
| 元素 | 相关信息 |
| W | 核外电子数与其电子层数相同 |
| X | 最外层电子数是核外电子总数的一半 |
| Y | 原子核外p电子数比s电子数少1 |
| Z | Z2−与Ne具有相同的电子层结构 |
| M | 原子序数为X、Y、Z三者原子序数之和 |
| Q | 过渡元素,基态原子核外没有未成对电子 |
(1)X核外电子的运动状态有
(2)M基态原子的电子排布式为
(3)基态Q2+的价电子轨道表示式为
(4)M的第一电离能
(5)[Q(Y2W4)2(Y3)2]n是一种应用广泛的配合物,其结构式为
 ,其中Y2W4、Y
,其中Y2W4、Y 是两种配体,中心Q离子的配位数为
是两种配体,中心Q离子的配位数为 中心原子的杂化类型为
中心原子的杂化类型为(6)Y的简单氢化物极易溶于Z的简单氢化物的原因与氢键有关,所形成的化合物分子合理的结构式为
您最近一年使用:0次
名校
8 . A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型:C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是___________ (填元素符号)
(2)C和D反应可生成组成比为1∶3的化合物E,E的立体构型为___________ ,中心原子的杂化轨道类型为___________ 。
(3)单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为___________ 。
(4)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为___________ ;晶胞中A原子的配位数为___________ ;列式计算晶体F的密度(g·cm-3)___________ 。

(1)四种元素中电负性最大的是
(2)C和D反应可生成组成比为1∶3的化合物E,E的立体构型为
(3)单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为
(4)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为

您最近一年使用:0次
9 . “掺杂”和“包覆”是改善电极性能的重要手段。工业上以Li2CO3为原料制备锂离子电池的正极材料NCM811(LiNi0.8Co0.1Mn0.1O2)。
回答下列问题:
(1)基态氧原子价电子轨道表示式为___ ;Mn属于__ 区元素;基态Co原子核外电子有__ 种运动状态。
(2)与Li2CO3的阴离子互为等电子体的分子有__ (填化学式);Li2CO3阴离子的中心原子采取了__ 杂化方式,Li2CO3热稳定性__ (填“>”或“<”)其同族其他元素的碳酸盐。
(3)“掺杂”能够提高电极的电导率和结构稳定性。MgF2是常用的掺杂剂,其熔点高于MgCl2熔点的原因为___ 。
(4)TiO2形成的表面包覆材料,能够明显提高NCM811的性能。已知:NA为阿伏加德罗常数的值。TiO2的晶胞如图所示(α=β=γ=90°)。TiO2晶体中O原子的配位数为__ ,TiO2晶胞的密度为__ g•cm-3(用含NA、a和b的式子表示)。

回答下列问题:
(1)基态氧原子价电子轨道表示式为
(2)与Li2CO3的阴离子互为等电子体的分子有
(3)“掺杂”能够提高电极的电导率和结构稳定性。MgF2是常用的掺杂剂,其熔点高于MgCl2熔点的原因为
(4)TiO2形成的表面包覆材料,能够明显提高NCM811的性能。已知:NA为阿伏加德罗常数的值。TiO2的晶胞如图所示(α=β=γ=90°)。TiO2晶体中O原子的配位数为

您最近一年使用:0次
10 . 钇(Y)是第一种被发现的稀土元素,位于元素周期表的第 5 周期第 IIIB 族,其在电子、激光、超导等领域均有广泛应用。回答下列问题:
(1)基态 Y 原子的价电子排布式为___________ 。
(2)Y(NO3)3与水杨酸甲酯( )反应,可制得配合物同时生成 HNO3,其中配合物能用于捕获 NO。
)反应,可制得配合物同时生成 HNO3,其中配合物能用于捕获 NO。
①Y(NO3)3中所含三种元素的第一电离能由大到小的顺序为______ (用元素符号表示);NO 的立体构型为
的立体构型为___________ 。
②lmol HNO3中含有σ键的数目为______ ,HNO3的酸性强于HNO2的原因为___________ 。
③水杨酸甲酯中 C 的杂化类型为___________ ,水杨酸甲酯沸点高于水杨酸( )的主要原因为
)的主要原因为___________ 。
④NO 分子中,N、O 原子间形成共价键的电子云对称形式包括镜面对称和___________ 。
(3)Y、Cu、Ba、O 形成的一种具有超导性的材料的晶胞结构如图所示。若 NA表示阿伏加德罗常数的值, =
= =
= ,则该晶体的密度ρ=
,则该晶体的密度ρ=___________ g•cm-3 (用含a、c、N A的代数式表示)。

(1)基态 Y 原子的价电子排布式为
(2)Y(NO3)3与水杨酸甲酯(
 )反应,可制得配合物同时生成 HNO3,其中配合物能用于捕获 NO。
)反应,可制得配合物同时生成 HNO3,其中配合物能用于捕获 NO。①Y(NO3)3中所含三种元素的第一电离能由大到小的顺序为
 的立体构型为
的立体构型为②lmol HNO3中含有σ键的数目为
③水杨酸甲酯中 C 的杂化类型为
 )的主要原因为
)的主要原因为④NO 分子中,N、O 原子间形成共价键的电子云对称形式包括镜面对称和
(3)Y、Cu、Ba、O 形成的一种具有超导性的材料的晶胞结构如图所示。若 NA表示阿伏加德罗常数的值,
 =
= =
= ,则该晶体的密度ρ=
,则该晶体的密度ρ=
您最近一年使用:0次



