2022高三·全国·专题练习
1 . 以 、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
(1)基态O原子的电子排布式_______ ,其中未成对电子有_______ 个。
(2)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是_______ 。
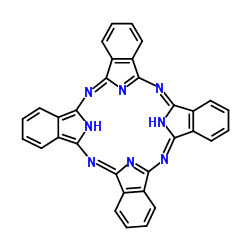
(3)酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取_______ 杂化。邻苯二甲酸酐( )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺(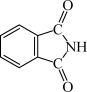 )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是_______ 。
(4)金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为_______ 。
(5)ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是_______ 。
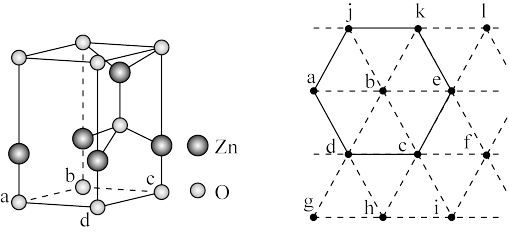
(6)下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。 为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面_______ 、_______ 。
 、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:(1)基态O原子的电子排布式
(2)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是
(3)酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取
 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺( )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是
(4)金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为
(5)ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是
(6)下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。
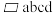 为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
您最近一年使用:0次
2022-07-04更新
|
9157次组卷
|
11卷引用:专题九 物质结构与性质-实战高考·二轮复习核心突破
(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破(已下线)专题17 物质结构与性质(综合题)-2022年高考真题模拟题分项汇编2022年海南省高考真题化学试题(已下线)第19练 物质结构与性质综合题难点突破-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)2022年海南省高考真题变式题15-19山西省晋中市祁县中学2022-2023学年高三上学期10月月考化学试题(已下线)热点情景汇编-专题十四 结构性质中的新材料(已下线)【知识图鉴】单元讲练测选择性必修2第三章03单元测(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)专题17 物质结构与性质综合题-2023年高考化学真题题源解密(新高考专用)
2 . 我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为“液态阳光”计划。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。回答下列问题:
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排布式为___________ ;单晶硅的晶体类型为___________ 。SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为___________ 。SiCl4可发生水解反应,机理如下:
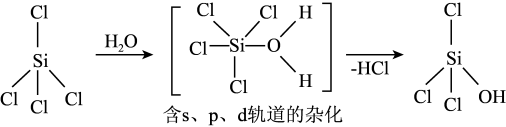
含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为___________ (填标号)。
(2)CO2分子中存在___________ 个 键和
键和___________ 个 键。
键。
(3)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是___________ 。
(4)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。四方ZrO2晶胞如图所示。Zr4+离子在晶胞中的配位数是___________ ,晶胞参数为a pm、a pm、c pm,该晶体密度为___________ g·cm-3(写出表达式)。在ZrO2中掺杂少量ZnO后形成的催化剂,化学式可表示为ZnxZr1-xOy,则y=___________ (用x表达)。

(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排布式为

含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为
(2)CO2分子中存在
 键和
键和 键。
键。(3)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是
(4)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。四方ZrO2晶胞如图所示。Zr4+离子在晶胞中的配位数是

您最近一年使用:0次
2021-06-11更新
|
21208次组卷
|
26卷引用:2021年高考全国甲卷化学真题
2021年高考全国甲卷化学真题北京首都师范大学附属中学2021-2022学年高三上学期10月月考化学试题(已下线)专题14 物质结构与性质-备战2022年高考化学学霸纠错(全国通用)(已下线)2021年高考全国甲卷化学试题变式题天津市静海区第一中学2020-2021学年高三下学期第三次模拟考试化学试题黑龙江省哈尔滨市第三中学校2021-2022学年高三上学期第四次验收考试理科综合化学试题2020年全国卷Ⅰ理综化学高考真题变式题(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题19 物质结构与性质-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-练习陕西省宝鸡市渭滨区2022届高考模拟(一)化学试题(已下线)回归教材重难点11 物质结构与性质(选考)-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)押全国卷理综第35题 物质结构与性质-备战2022年高考化学临考题号押题(课标全国卷)(已下线)专题18物质结构与性质(选修)-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题18物质结构与性质(选修)-五年(2018~2022)高考真题汇编(全国卷)(已下线)微专题50 分子的立体结构的判断-备战2023年高考化学一轮复习考点微专题江西省重点校联盟2022-2023学年高三上学期10月联考化学试题天津市咸水沽第一中学2022-2023学年高三上学期线上期末考试化学试题(已下线)第五章 物质结构与性质 元素周期律 第32讲 物质结构与性质综合题研究(已下线)第四部分 物质结构与性质 综合提能训练(已下线)专题02 物质结构专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)上海市实验学校2023-2024学年高三上学期第一次月考化学试题陕西省渭南市蒲城县尧山中学2023-2024学年高三下学期开学收心考试理综试题-高中化学
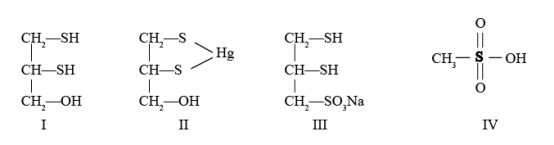
3 . 很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物Ⅱ。
(1)基态硫原子价电子排布式为_______ 。
(2)H2S、CH4、H2O的沸点由高到低顺序为_______ 。
(3)汞的原子序数为80,位于元素周期表第_______ 周期第ⅡB族。
(4)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有_______ 。
A. 在I中S原子采取sp3杂化
B. 在Ⅱ中S元素的电负性最大
C. 在Ⅲ中C-C-C键角是180°
D. 在Ⅲ中存在离子键与共价键
E. 在Ⅳ中硫氧键的键能均相等
(5)汞解毒剂的水溶性好,有利于体内 重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的是_______ 。
(6)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图9a所示)中部分Ge原子被Hg和Sb取代后形成。
②图9c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为_______ ;该晶胞中粒子个数比Hg:Ge:Sb = _______ 。
③设X的最简式的式量为Mr,则X晶体的密度为_______ g/cm3(列出算式)。

(1)基态硫原子价电子排布式为
(2)H2S、CH4、H2O的沸点由高到低顺序为
(3)汞的原子序数为80,位于元素周期表第
(4)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有
A. 在I中S原子采取sp3杂化
B. 在Ⅱ中S元素的电负性最大
C. 在Ⅲ中C-C-C键角是180°
D. 在Ⅲ中存在离子键与共价键
E. 在Ⅳ中硫氧键的键能均相等
(5)汞解毒剂的水溶性好,有利于体内 重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的是
(6)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图9a所示)中部分Ge原子被Hg和Sb取代后形成。

①图9b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是
②图9c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为
③设X的最简式的式量为Mr,则X晶体的密度为
您最近一年使用:0次
2021-06-11更新
|
11678次组卷
|
16卷引用:2021年新高考广东化学高考真题
2021年新高考广东化学高考真题(已下线)专题14 物质结构与性质-备战2022年高考化学学霸纠错(全国通用)2021年广东省高考化学试卷变式题11-21(已下线)第十一单元 物质结构与性质(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题19 物质结构与性质-2022年高考化学二轮复习重点专题常考点突破练重庆市实验中学校2021-2022学年高二下学期第一次月考化学试题(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-练习浙江金华第一中学2021-2022学年高一领军班下学期期中考试化学试题(已下线)押新高考卷15题 物质结构与性质综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)专题18 物质结构与性质(综合题)-三年(2020-2022)高考真题分项汇编河北鸡泽县第一中学2021-2022学年高二下学期开学考试化学试题(已下线)第五章 物质结构与性质 元素周期律 第32讲 物质结构与性质综合题研究(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)
真题
解题方法
4 . 非金属氟化物在生产、生活和科研中应用广泛。回答下列问题:
(1)基态F原子核外电子的运动状态有__ 种。
(2)O、F、Cl电负性由大到小的顺序为__ ;OF2分子的空间构型为__ ;OF2的熔、沸点__ (填“高于”或“低于”)Cl2O,原因是___ 。
(3)Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为___ ,下列对XeF2中心原子杂化方式推断合理的是___ (填标号)。
A.sp B.sp2 C.sp3 D.sp3d
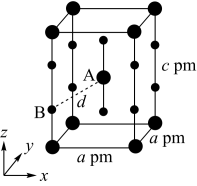
(4)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有__ 个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为( ,
, ,
, )。已知Xe—F键长为rpm,则B点原子的分数坐标为
)。已知Xe—F键长为rpm,则B点原子的分数坐标为___ ;晶胞中A、B间距离d=___ pm。
(1)基态F原子核外电子的运动状态有
(2)O、F、Cl电负性由大到小的顺序为
(3)Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为
A.sp B.sp2 C.sp3 D.sp3d
(4)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有
 ,
, ,
, )。已知Xe—F键长为rpm,则B点原子的分数坐标为
)。已知Xe—F键长为rpm,则B点原子的分数坐标为
您最近一年使用:0次
2021-06-29更新
|
11298次组卷
|
13卷引用:2021年新高考山东化学高考真题
2021年新高考山东化学高考真题(已下线)专题18 物质结构与性质综合-备战2022年高考化学真题及地市好题专项集训【山东专用】(已下线)专题14 物质结构与性质-备战2022年高考化学学霸纠错(全国通用)2021年山东高考化学试题变式题11-20山东省临沂市兰陵县第四中学2021-2022学年高三12月月考化学试题(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)回归教材重难点11 物质结构与性质-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)押新高考卷15题 物质结构与性质综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)第四部分 物质结构与性质 综合提能训练(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)
5 . 钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,回答下列问题:
(1)基态Ti原子的核外电子排布式为____________ 。
(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是____________ 。
(3)CaTiO3的晶胞如图(a)所示,其组成元素的电负性大小顺序是__________ ;金属离子与氧离子间的作用力为__________ ,Ca2+的配位数是__________ 。
(4)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I﹣和有机碱离子 ,其晶胞如图(b)所示。其中Pb2+与图(a)中
,其晶胞如图(b)所示。其中Pb2+与图(a)中__________ 的空间位置相同,有机碱 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是__________ ;若晶胞参数为a nm,则晶体密度为_________ g·cm-3(列出计算式)。_______ 、_______ 。
(1)基态Ti原子的核外电子排布式为
(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是
| 化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | ﹣24.12 | 38.3 | 155 |
(3)CaTiO3的晶胞如图(a)所示,其组成元素的电负性大小顺序是
(4)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I﹣和有机碱离子
 ,其晶胞如图(b)所示。其中Pb2+与图(a)中
,其晶胞如图(b)所示。其中Pb2+与图(a)中 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是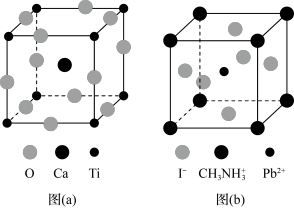
您最近一年使用:0次
2020-07-08更新
|
15471次组卷
|
21卷引用:专题11 物质结构与性质——备战2021年高考化学纠错笔记
(已下线)专题11 物质结构与性质——备战2021年高考化学纠错笔记(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)押全国卷理综第35题 物质结构与性质-备战2021年高考化学临考题号押题河南省开封市铁路中学2020-2021学年高二下学期期中考试化学试题北京一零一中学2021-2022学年高三上学期10月月考化学试题(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破2020年全国统一考试化学试题(新课标Ⅱ)(已下线)专题17 物质结构与性质(选修)-2020年高考真题和模拟题化学分项汇编(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)2020年全国卷Ⅱ化学真题变式题江西省九江市2022届第二次高考模拟统一考试理综化学试题(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)回归教材重难点11 物质结构与性质(选考)-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)押全国卷理综第35题 物质结构与性质-备战2022年高考化学临考题号押题(课标全国卷)(已下线)专题18物质结构与性质(选修)-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题18物质结构与性质(选修)-五年(2018~2022)高考真题汇编(全国卷)重庆市万州第二高级中学2021-2022学年高二下学期6月第三次质量检测化学试题贵州省罗甸县边阳中学2022届高三模拟测试化学试题(已下线)专题02 物质结构专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)(已下线)专题20 结构与性质四川省成都锦江区嘉祥外国语高级中学2023-2024学年高三下学期第一次诊断性考试理科综合试题-高中化学
真题
解题方法
6 . KH2PO4晶体具有优异的非线性光学性能。我国科学工作者制备的超大KH2PO4晶体已应用于大功率固体激光器,填补了国家战略空白。回答下列问题:
(1)在KH2PO4的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是__ (填离子符号)。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数.对于基态的磷原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数.对于基态的磷原子,其价电子自旋磁量子数的代数和为___ 。
(3)已知有关氮、磷的单键和三键的键能(kJ•mol-1)如表:
___ ,其中P采取___ 杂化方式。
(5)与PO 电子总数相同的等电子体的分子式为
电子总数相同的等电子体的分子式为__ 。
(6)磷酸通过分子间脱水缩合形成多磷酸,如:___ 。
(7)分别用○、●表示H2PO 和K+,KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是H2PO
和K+,KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是H2PO 、K+在晶胞xz面、yz面上的位置:
、K+在晶胞xz面、yz面上的位置:__ g•cm-3(写出表达式)。
②晶胞在x轴方向的投影图为__ (填标号)。
(1)在KH2PO4的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+
 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数.对于基态的磷原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数.对于基态的磷原子,其价电子自旋磁量子数的代数和为(3)已知有关氮、磷的单键和三键的键能(kJ•mol-1)如表:
| N—N | N≡N | P—P | P≡P |
| 193 | 946 | 197 | 489 |
从能量角度看,氮以N2、而白磷以P4(结构式可表示为 )形式存在的原因是
)形式存在的原因是
(5)与PO
 电子总数相同的等电子体的分子式为
电子总数相同的等电子体的分子式为(6)磷酸通过分子间脱水缩合形成多磷酸,如:

(7)分别用○、●表示H2PO
 和K+,KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是H2PO
和K+,KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是H2PO 、K+在晶胞xz面、yz面上的位置:
、K+在晶胞xz面、yz面上的位置:
②晶胞在x轴方向的投影图为
您最近一年使用:0次
2021-06-09更新
|
10150次组卷
|
12卷引用:2021年新高考河北化学高考真题
2021年新高考河北化学高考真题(已下线)专题14 物质结构与性质-备战2022年高考化学学霸纠错(全国通用)2021年河北省高考化学试卷变式题10-18题(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题19 物质结构与性质-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)回归教材重难点11 物质结构与性质-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)押新高考卷15题 物质结构与性质综合题-备战2022年高考化学临考题号押题(新高考通版)广东省广州市天河区2022届高三第三次模拟考试化学试题(已下线)专题18 物质结构与性质(综合题)-三年(2020-2022)高考真题分项汇编(已下线)专题20 结构与性质(已下线)专题20 结构与性质
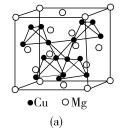
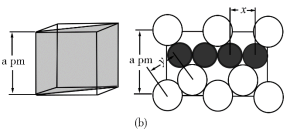
7 . 在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要材料。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是____________ (填标号)。
A. B.
B.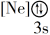 C.
C. D.
D.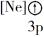
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是__________ 、__________ 。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是__________ ,其中与乙二胺形成的化合物稳定性相对较高的是__________ (填“Mg2+”或“Cu2+”)。
(3)一些氧化物的熔点如下表所示:
解释表中氧化物之间熔点差异的原因__________ 。
(4)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x=__________ pm,Mg原子之间最短距离y=__________ pm。设阿伏加 德罗常数的值为NA,则MgCu2的密度是__________ g·cm−3(列出计算表达式)。
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是
A.
 B.
B.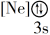 C.
C. D.
D.
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是
(3)一些氧化物的熔点如下表所示:
| 氧化物 | Li2O | MgO | P4O6 | SO2 |
| 熔点/°C | 1570 | 2800 | 23.8 | −75.5 |
(4)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x=


您最近一年使用:0次
2019-06-09更新
|
15879次组卷
|
13卷引用:专题11 物质结构与性质——备战2021年高考化学纠错笔记
(已下线)专题11 物质结构与性质——备战2021年高考化学纠错笔记(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)押全国卷理综第35题 物质结构与性质-备战2021年高考化学临考题号押题2019年全国统一考试化学试题(新课标Ⅰ)吉林省延边市第二中学2020届高三入学考试化学试题(已下线)专题6.4 物质结构与性质(选考)(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升2020年全国卷Ⅰ理综化学高考真题变式题(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)押全国卷理综第35题 物质结构与性质-备战2022年高考化学临考题号押题(课标全国卷)(已下线)专题18物质结构与性质(选修)-五年(2018~2022)高考真题汇编(全国卷)(已下线)专题20 结构与性质(已下线)T35-物质结构与性质
8 . 磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。回答下列问题:
(1)在周期表中,与Li的化学性质最相似的邻族元素是________ ,该元素基态原子核外M层电子的自旋状态_________ (填“相同”或“相反”)。
(2)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为________ ,其中Fe的配位数为_____________ 。
(3)苯胺 )的晶体类型是
)的晶体类型是__________ 。苯胺与甲苯(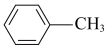 )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是
)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是___________ 。
(4)NH4H2PO4中,电负性最高的元素是______ ;P的_______ 杂化轨道与O的2p轨道形成_______ 键。
(5)NH4H2PO4和LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:
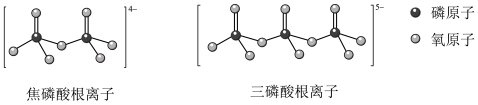
这类磷酸根离子的化学式可用通式表示为____________ (用n代表P原子数)。
(1)在周期表中,与Li的化学性质最相似的邻族元素是
(2)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为
(3)苯胺
 )的晶体类型是
)的晶体类型是 )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是
)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是(4)NH4H2PO4中,电负性最高的元素是
(5)NH4H2PO4和LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:

这类磷酸根离子的化学式可用通式表示为
您最近一年使用:0次
2019-06-09更新
|
13268次组卷
|
13卷引用:专题11 物质结构与性质——备战2021年高考化学纠错笔记
(已下线)专题11 物质结构与性质——备战2021年高考化学纠错笔记(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)押全国卷理综第35题 物质结构与性质-备战2021年高考化学临考题号押题(已下线)第2周 晚练题-备战2022年高考化学周测与晚练(新高考专用)2019年全国统一高考化学试题(新课标Ⅲ)2020届四川省成都市第七中学高三三月份网络教学质量监测卷化学试题(已下线)专题6.4 物质结构与性质(选考)(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押全国卷理综第35题 物质结构与性质-备战2022年高考化学临考题号押题(课标全国卷)(已下线)专题18物质结构与性质(选修)-五年(2018~2022)高考真题汇编(全国卷)(已下线)专题20 结构与性质(已下线)T35-物质结构与性质
9 . A.[物质结构与性质]
Cu2O广泛应用于太阳能电池领域。以CuSO4、NaOH和抗坏血酸为原料,可制备Cu₂O。
(1)Cu2+基态核外电子排布式为____ 。
(2) 的空间构型为
的空间构型为____ (用文字描述);Cu2+与OH−反应能生成[Cu(OH)4]2−,[Cu(OH)4]2−中的配位原子为____ (填元素符号)。
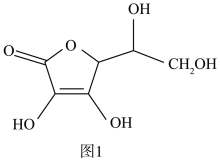
(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为____ ;推测抗坏血酸在水中的溶解性:____ (填“难溶于水”或“易溶于水”)。
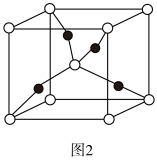
(4)一个Cu2O晶胞(见图2)中,Cu原子的数目为____ 。
Cu2O广泛应用于太阳能电池领域。以CuSO4、NaOH和抗坏血酸为原料,可制备Cu₂O。
(1)Cu2+基态核外电子排布式为
(2)
 的空间构型为
的空间构型为(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为


(4)一个Cu2O晶胞(见图2)中,Cu原子的数目为
您最近一年使用:0次
2019-06-10更新
|
4873次组卷
|
10卷引用:内蒙古赤峰市第四中学分校2021-2022学年高三上学期9月月考化学试题
内蒙古赤峰市第四中学分校2021-2022学年高三上学期9月月考化学试题2019年江苏省高考化学试题黑龙江省哈尔滨市第六中学2018-2019学年高二下学期期末考试化学试题天津市西青区2020届高三上学期期末考试化学试题(已下线)专题6.4 物质结构与性质(选考)(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升河北省唐山市路北区第十一中学2019-2020学年高二期中考试化学试题吉林省松原市油田第十一中学2021届高三第一次阶段考试化学试题(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-练习黑龙江省黑河市第九中学2022-2023学年高三上学期摸底考试化学试题(已下线)物质结构与性质
10 . 研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为_____________ 。元素Mn与O中,第一电离能较大的是_________ ,基态原子核外未成对电子数较多的是_________________ 。
(2)CO2和CH3OH分子中C原子的杂化形式分别为__________ 和__________ 。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为_________________ ,原因是______________________________ 。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在________ 。
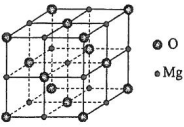
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为________ nm。MnO也属于NaCl型结构,晶胞参数为a' =0.448 nm,则r(Mn2+)为________ nm。
(1)Co基态原子核外电子排布式为
(2)CO2和CH3OH分子中C原子的杂化形式分别为
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为

您最近一年使用:0次
2017-08-08更新
|
8064次组卷
|
19卷引用:解密13 物质结构与性质(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练
(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练2017年全国普通高等学校招生统一考试理综化学(新课标Ⅲ卷精编版)广东省广州市执信中学2018届高三上学期期中考试理综化学试题(已下线)【中等生百日捷进提升系列-基础练测】专题2.17 物质结构与性质(已下线)【艺体生文化课百题突围系列-基础练测】专题2.17 物质结构与性质(选修)(已下线)《考前20天终极攻略》5月30日 物质结构与性质(已下线)解密21 物质的结构与性质(教师版)——备战2018年高考化学之高频考点解密步步为赢 高二化学暑假作业:作业十四 物质结构与性质(选修3)(已下线)2019年6月29日《每日一题》选修3—— 周末培优四川省南充市阆中中学2018-2019学年高二6月月考理科综合化学试题江西省临川一中2020届上学期第二次联合考试化学试题2020届湖南省湘潭市高三教学质量监测卷化学试题河北省衡水中学2020届高三下学期二月份网络教学质量监测理科综合化学试题宁夏海原县第一中学2019-2020学年高二下学期第一次月考化学试题陕西省榆林市绥德县绥德中学2020届高三第六次模拟考试化学试题贵州省铜仁市思南中学2021届高三上学期第二次月考化学试题河北省张家口市宣化区宣化第一中学2021届高三上学期10月月考化学试题陕西省西安市高新第一中学2020届高三教学质量监测理综化学试题云南省玉溪第三中学2021-2022学年高三下学期3月入学考试理综化学试题



