1 . K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,易溶于水,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室用莫尔盐[(NH4)2Fe(SO4)2·6H2O]制备K3[Fe(C2O4)3]·3H2O的流程如图所示。

回答下列问题:
(1)K3[Fe(C2O4)3]中铁离子的配位数为___ ,其配体C2O 中C原子的杂化方式为
中C原子的杂化方式为___ 。
(2)步骤②发生反应的化学方程式为___ 。
(3)步骤③将Fe(OH)3加入到KHC2O4溶液中,水浴加热,控制溶液pH为3.0~3.5,随反应进行需加入适量___ (已知:常温下KHC2O4溶液的pH约为3.5)。
(4)得到的三草酸合铁酸钾晶体依次用少量冰水、95%乙醇洗涤的目的是___ 。
(5)某研究小组将K3[Fe(C2O4)3]·3H2O在一定条件下加热分解,利用如图装置(可重复使用)验证所得气体产物中含有CO和CO2。

①按气流从左到右的方向,依次连接的合理顺序为___ (填装置序号)。
②确认气体产物中含CO的现象为___ 。
(6)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液,[Ni(NH3)6]SO4中配体的构型是___ ,阴离子的立体构型是___ 。

回答下列问题:
(1)K3[Fe(C2O4)3]中铁离子的配位数为
 中C原子的杂化方式为
中C原子的杂化方式为(2)步骤②发生反应的化学方程式为
(3)步骤③将Fe(OH)3加入到KHC2O4溶液中,水浴加热,控制溶液pH为3.0~3.5,随反应进行需加入适量
(4)得到的三草酸合铁酸钾晶体依次用少量冰水、95%乙醇洗涤的目的是
(5)某研究小组将K3[Fe(C2O4)3]·3H2O在一定条件下加热分解,利用如图装置(可重复使用)验证所得气体产物中含有CO和CO2。

①按气流从左到右的方向,依次连接的合理顺序为
②确认气体产物中含CO的现象为
(6)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液,[Ni(NH3)6]SO4中配体的构型是
您最近一年使用:0次
2 . 工业上常用尿素[CO(NH2)2]和NaClO溶液反应制备水合肼。水合肼(N2H4·H2O)可用作抗氧剂等。
已知:I.N2H4·H2O的结构如图(…表示氢键)。

II.N2H4·H2O沸点118℃,具有强还原性。
(1)将Cl2通入过量NaOH溶液中制备NaClO,得到溶液X,离子方程式是_______ 。
(2)制备水合肼:将溶液X滴入尿素水溶液中,控制一定温度,装置如下图(夹持及控温装置已略)。充分反应后,A中的溶液经蒸馏获得水合肼粗品后,剩余溶液再进一步处理还可获得副产品NaCl和Na2CO3·10H2O。

①A中反应的化学方程式是_______ 。
②冷凝管的作用是_______ 。
③若滴加NaClO溶液的速度较快时,水合肼的产率会下降,原因是_______ 。
(3)水合肼在溶液中可发生类似NH3·H2O的电离,呈弱碱性;其分子中与N原子相连的H原子易发生取代反应。
①水合肼和盐酸按物质的量之比1∶1反应的离子方程式是_______ 。
②碳酰肼(CH6N4O)是目前去除锅炉水中氧气的最先进材料,由水合肼与DEC( )发生取代反应制得。碳酰肼的结构简式是
)发生取代反应制得。碳酰肼的结构简式是_______ 。
(4)尿素还可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(III),化学式为[Fe(H2NCONH2)6](NO3)3。
①C、N、O三种元素的第一电离能由大到小的顺序是_______ 。
②尿素分子中C和N原子的杂化方式分别是_______ 、_______ 。
③[Fe(H2NCONH2)6](NO3)3中H2NCONH2与Fe(III)之间的作用力是_______ 。
④FeCl3溶液与KSCN溶液混合,得到含多种配合物的红色溶液,其中配位数为5的配合物的化学式是_______ 。
已知:I.N2H4·H2O的结构如图(…表示氢键)。

II.N2H4·H2O沸点118℃,具有强还原性。
(1)将Cl2通入过量NaOH溶液中制备NaClO,得到溶液X,离子方程式是
(2)制备水合肼:将溶液X滴入尿素水溶液中,控制一定温度,装置如下图(夹持及控温装置已略)。充分反应后,A中的溶液经蒸馏获得水合肼粗品后,剩余溶液再进一步处理还可获得副产品NaCl和Na2CO3·10H2O。

①A中反应的化学方程式是
②冷凝管的作用是
③若滴加NaClO溶液的速度较快时,水合肼的产率会下降,原因是
(3)水合肼在溶液中可发生类似NH3·H2O的电离,呈弱碱性;其分子中与N原子相连的H原子易发生取代反应。
①水合肼和盐酸按物质的量之比1∶1反应的离子方程式是
②碳酰肼(CH6N4O)是目前去除锅炉水中氧气的最先进材料,由水合肼与DEC(
 )发生取代反应制得。碳酰肼的结构简式是
)发生取代反应制得。碳酰肼的结构简式是(4)尿素还可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(III),化学式为[Fe(H2NCONH2)6](NO3)3。
①C、N、O三种元素的第一电离能由大到小的顺序是
②尿素分子中C和N原子的杂化方式分别是
③[Fe(H2NCONH2)6](NO3)3中H2NCONH2与Fe(III)之间的作用力是
④FeCl3溶液与KSCN溶液混合,得到含多种配合物的红色溶液,其中配位数为5的配合物的化学式是
您最近一年使用:0次
19-20高二下·江苏镇江·期中
解题方法
3 . 氧化镁在医药、建筑等行业应用广泛,硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:

(1) H2O2中O的杂化方式为___________ 。
(2)加入H2O2氧化时,发生反应的离子方程式为___________ 。
(3)加入NH3·H2O时控制低温的目的为___________ 。
(4)煅烧过程存在以下反应:
2MgSO4+C 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C MgO+S+3CO↑
MgO+S+3CO↑
利用如图装置对煅烧产生的气体进行分步吸收或收集。
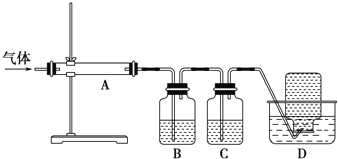
①根据等电子体原理写出与CO2互为等电子体的一种分子的电子式___________ 。
②B中盛放的溶液可以是___________ (填字母)。
a. NaOH溶液 b. Na2CO3溶液 c. 稀硝酸 d. KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:___________ 。

(1) H2O2中O的杂化方式为
(2)加入H2O2氧化时,发生反应的离子方程式为
(3)加入NH3·H2O时控制低温的目的为
(4)煅烧过程存在以下反应:
2MgSO4+C
 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑ MgSO4+C
 MgO+SO2↑+CO↑
MgO+SO2↑+CO↑MgSO4+3C
 MgO+S+3CO↑
MgO+S+3CO↑利用如图装置对煅烧产生的气体进行分步吸收或收集。

①根据等电子体原理写出与CO2互为等电子体的一种分子的电子式
②B中盛放的溶液可以是
a. NaOH溶液 b. Na2CO3溶液 c. 稀硝酸 d. KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:
您最近一年使用:0次



