1 . 工业上常用尿素[CO(NH2)2]和NaClO溶液反应制备水合肼。水合肼(N2H4·H2O)可用作抗氧剂等。
已知:I.N2H4·H2O的结构如图(…表示氢键)。

II.N2H4·H2O沸点118℃,具有强还原性。
(1)将Cl2通入过量NaOH溶液中制备NaClO,得到溶液X,离子方程式是_______ 。
(2)制备水合肼:将溶液X滴入尿素水溶液中,控制一定温度,装置如下图(夹持及控温装置已略)。充分反应后,A中的溶液经蒸馏获得水合肼粗品后,剩余溶液再进一步处理还可获得副产品NaCl和Na2CO3·10H2O。

①A中反应的化学方程式是_______ 。
②冷凝管的作用是_______ 。
③若滴加NaClO溶液的速度较快时,水合肼的产率会下降,原因是_______ 。
(3)水合肼在溶液中可发生类似NH3·H2O的电离,呈弱碱性;其分子中与N原子相连的H原子易发生取代反应。
①水合肼和盐酸按物质的量之比1∶1反应的离子方程式是_______ 。
②碳酰肼(CH6N4O)是目前去除锅炉水中氧气的最先进材料,由水合肼与DEC( )发生取代反应制得。碳酰肼的结构简式是
)发生取代反应制得。碳酰肼的结构简式是_______ 。
(4)尿素还可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(III),化学式为[Fe(H2NCONH2)6](NO3)3。
①C、N、O三种元素的第一电离能由大到小的顺序是_______ 。
②尿素分子中C和N原子的杂化方式分别是_______ 、_______ 。
③[Fe(H2NCONH2)6](NO3)3中H2NCONH2与Fe(III)之间的作用力是_______ 。
④FeCl3溶液与KSCN溶液混合,得到含多种配合物的红色溶液,其中配位数为5的配合物的化学式是_______ 。
已知:I.N2H4·H2O的结构如图(…表示氢键)。

II.N2H4·H2O沸点118℃,具有强还原性。
(1)将Cl2通入过量NaOH溶液中制备NaClO,得到溶液X,离子方程式是
(2)制备水合肼:将溶液X滴入尿素水溶液中,控制一定温度,装置如下图(夹持及控温装置已略)。充分反应后,A中的溶液经蒸馏获得水合肼粗品后,剩余溶液再进一步处理还可获得副产品NaCl和Na2CO3·10H2O。

①A中反应的化学方程式是
②冷凝管的作用是
③若滴加NaClO溶液的速度较快时,水合肼的产率会下降,原因是
(3)水合肼在溶液中可发生类似NH3·H2O的电离,呈弱碱性;其分子中与N原子相连的H原子易发生取代反应。
①水合肼和盐酸按物质的量之比1∶1反应的离子方程式是
②碳酰肼(CH6N4O)是目前去除锅炉水中氧气的最先进材料,由水合肼与DEC(
 )发生取代反应制得。碳酰肼的结构简式是
)发生取代反应制得。碳酰肼的结构简式是(4)尿素还可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(III),化学式为[Fe(H2NCONH2)6](NO3)3。
①C、N、O三种元素的第一电离能由大到小的顺序是
②尿素分子中C和N原子的杂化方式分别是
③[Fe(H2NCONH2)6](NO3)3中H2NCONH2与Fe(III)之间的作用力是
④FeCl3溶液与KSCN溶液混合,得到含多种配合物的红色溶液,其中配位数为5的配合物的化学式是
您最近一年使用:0次
名校
解题方法
2 . VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途
(1)O基态原子核外有___________ 种运动状态的电子,核外电子有___________ 对自旋相反的电子
(2)与O同周期相邻的元素的原子(包括氧),三种元素原子的第一电离能由大到小的顺序为___________ ,氧、硫、硒(Se)三种元素原子的电负性由大到小的顺序为___________ 。
(3)键长:H2Se___________ H2S(填“>”或“<”或“=”,下同),还原性:H2Se___________ H2S;
(4)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+易被氧化成Fe3+的原因是___________ 。
(5)碳是形成化合物种类最多的元素。
①C元素是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是___________ (填字母)。
a. b.CH4 c.CH2=CHCH3 d.CH3CH2C≡CH
b.CH4 c.CH2=CHCH3 d.CH3CH2C≡CH
(6)BF3能与NH3反应生成BF3·NH3.BF3·NH3中B原子的杂化轨道类型为___________ ,B与N之间形成___________ 键。硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质。[B(OH)4]-中B的空间构型为___________ ,不考虑空间构型,[B(OH)4]-的结构可用示意图表示为___________ 。
(7)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图所示。

该物质结构中,形成配位键的原子中,提供孤对电子的是___________ ,中心原子的配位数是___________ 。
(1)O基态原子核外有
(2)与O同周期相邻的元素的原子(包括氧),三种元素原子的第一电离能由大到小的顺序为
(3)键长:H2Se
(4)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+易被氧化成Fe3+的原因是
(5)碳是形成化合物种类最多的元素。
①C元素是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是
a.
 b.CH4 c.CH2=CHCH3 d.CH3CH2C≡CH
b.CH4 c.CH2=CHCH3 d.CH3CH2C≡CH(6)BF3能与NH3反应生成BF3·NH3.BF3·NH3中B原子的杂化轨道类型为
(7)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图所示。

该物质结构中,形成配位键的原子中,提供孤对电子的是
您最近一年使用:0次
解题方法
3 . 碳酰肼(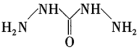 )具有强烈的还原性,可直接用作火箭炸药和推进剂的组分,也可用作锅炉水的除氧剂,是当今世界上用作锅炉水除氧的先进材料。
)具有强烈的还原性,可直接用作火箭炸药和推进剂的组分,也可用作锅炉水的除氧剂,是当今世界上用作锅炉水除氧的先进材料。
(1)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态的氮原子,其电子的自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的氮原子,其电子的自旋磁量子数的代数和为___________ 。
(2)H、C、N三种元素的电负性从大到小的顺序为___________ (填元素符号,下同);第二周期元素中,第一电离能比氮大的元素有___________ 。
(3)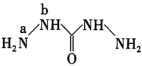 中a、b位置的N原子的杂化类型不同,a位置N原子的杂化类型为
中a、b位置的N原子的杂化类型不同,a位置N原子的杂化类型为___________ ,b位置N原子的价层电子对数目为___________ 。
(4)碳酰肼极易溶于水,其主要原因是___________ 。
(5)NH 的键角小于NH3的键角,请用价层电子对互斥规律解释原因:
的键角小于NH3的键角,请用价层电子对互斥规律解释原因:___________ 。
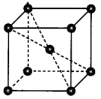
(6)造锅炉常用Q345R钢板,Q345R钢含有Mn、Si、Cu等元素。金属Mn晶体的晶胞如图所示,该堆积方式为___________ ;金属Mn原子的空间利用率为___________ (用含π的代数式表示)。
 )具有强烈的还原性,可直接用作火箭炸药和推进剂的组分,也可用作锅炉水的除氧剂,是当今世界上用作锅炉水除氧的先进材料。
)具有强烈的还原性,可直接用作火箭炸药和推进剂的组分,也可用作锅炉水的除氧剂,是当今世界上用作锅炉水除氧的先进材料。(1)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+
 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态的氮原子,其电子的自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的氮原子,其电子的自旋磁量子数的代数和为(2)H、C、N三种元素的电负性从大到小的顺序为
(3)
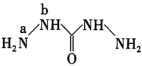 中a、b位置的N原子的杂化类型不同,a位置N原子的杂化类型为
中a、b位置的N原子的杂化类型不同,a位置N原子的杂化类型为(4)碳酰肼极易溶于水,其主要原因是
(5)NH
 的键角小于NH3的键角,请用价层电子对互斥规律解释原因:
的键角小于NH3的键角,请用价层电子对互斥规律解释原因:(6)造锅炉常用Q345R钢板,Q345R钢含有Mn、Si、Cu等元素。金属Mn晶体的晶胞如图所示,该堆积方式为

您最近一年使用:0次
解题方法
4 . 有色金属资源是全球各国工业发展的重要保证。铁、钴、镍、锰等有色金属及其化合物在机械制造磁性材料、新型电池和高效催化剂等许多领域都有着广泛的应用。请回答下列问题:
(1)Mn(BH4)2是一种储氢材料,Mn2+基态核外电子排布式为_______ ,Mn(BH4)2中B原子的杂化类型为_______ 。推测环硼氮六烷[(HNBH)3]在热水、CH3OH中的溶解性:_______ (填“难”或“易”)溶于热水、CH3OH。
(2)研究发现,在CO2低压合成甲醇反应(CO2+3H2⇌CH3OH+H2O)中,钴氧化物负载的纳米粒子催化剂具有高活性,显示出良好的应用前景。
①第二周期主族元素中,第一电离能比氧大的是_______ (填元素符号)。
②生成物H2O与CH3OH中,沸点较高的是_______ ,原因是_______ 。
③用KCN处理含Co2+的盐溶液,有红色的Co(CN)2析出,将它溶于过量的KCN溶液后,可生成紫色的[Co(CN)6]4-。[Co(CN)6]4-具有强还原性,在加热时能与水反应生成淡黄色的[Co(CN)6]3-,写出该反应的离子方程式:_______ 。[Co(CN)6]3-中所含σ键与π键数目之比为_______ 。
(3)YxNiyBzCw在临界温度15.6K时可实现超导,其晶胞结构如图1所示,则其化学式为_______ 。
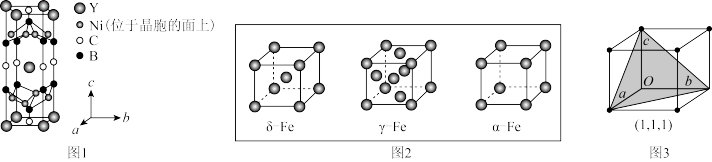
(4)①铁有δ、γ、α三种同素异形体(如图2),若Fe原子半径为rpm,NA表示阿伏加德罗常数的值,则γ-Fe单质的密度为_______ (列出计算式即可)g•cm-3
②在立方晶胞中与晶胞体对角线垂直的面在晶体学中称为(1,1,1)晶面,如图3,则α-Fe晶胞体中(1,1,1)晶面共有_______ 个
(1)Mn(BH4)2是一种储氢材料,Mn2+基态核外电子排布式为
(2)研究发现,在CO2低压合成甲醇反应(CO2+3H2⇌CH3OH+H2O)中,钴氧化物负载的纳米粒子催化剂具有高活性,显示出良好的应用前景。
①第二周期主族元素中,第一电离能比氧大的是
②生成物H2O与CH3OH中,沸点较高的是
③用KCN处理含Co2+的盐溶液,有红色的Co(CN)2析出,将它溶于过量的KCN溶液后,可生成紫色的[Co(CN)6]4-。[Co(CN)6]4-具有强还原性,在加热时能与水反应生成淡黄色的[Co(CN)6]3-,写出该反应的离子方程式:
(3)YxNiyBzCw在临界温度15.6K时可实现超导,其晶胞结构如图1所示,则其化学式为

(4)①铁有δ、γ、α三种同素异形体(如图2),若Fe原子半径为rpm,NA表示阿伏加德罗常数的值,则γ-Fe单质的密度为
②在立方晶胞中与晶胞体对角线垂直的面在晶体学中称为(1,1,1)晶面,如图3,则α-Fe晶胞体中(1,1,1)晶面共有
您最近一年使用:0次
解题方法
5 . 研究元素周期表右上角区域元素,有利于研发新型绿色农药,如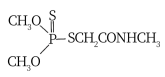
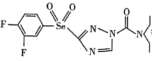 等。
等。
(1)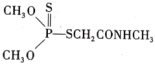 中所含元素H、O、P、S的电负性从大到小的顺序为
中所含元素H、O、P、S的电负性从大到小的顺序为_ ;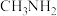 的沸点是
的沸点是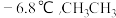 的沸点是
的沸点是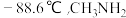 沸点远高于
沸点远高于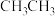 的原因是
的原因是___ 。
(2)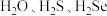 中最稳定的是
中最稳定的是_ (填化学式,下同),还原性最强的是_ ,键角最大的是__ 。
(3) 和
和 的混合气体经光解作用可生成一种新分子
的混合气体经光解作用可生成一种新分子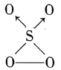 。
。
① 中S的
中S的____ 杂化轨道与O的 轨道重叠形成σ键。
轨道重叠形成σ键。
②下列分子中属于非极性分子的是___ (填字母)。
a. b.
b. c.
c. d.
d. e.
e.
(4)已知酸性: 。推测酸性:
。推测酸性: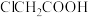
___ (填“>”或“<”) 。
。
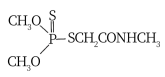
 等。
等。(1)
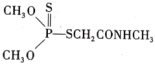 中所含元素H、O、P、S的电负性从大到小的顺序为
中所含元素H、O、P、S的电负性从大到小的顺序为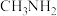 的沸点是
的沸点是 的沸点是
的沸点是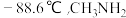 沸点远高于
沸点远高于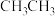 的原因是
的原因是(2)
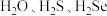 中最稳定的是
中最稳定的是(3)
 和
和 的混合气体经光解作用可生成一种新分子
的混合气体经光解作用可生成一种新分子 。
。①
 中S的
中S的 轨道重叠形成σ键。
轨道重叠形成σ键。②下列分子中属于非极性分子的是
a.
 b.
b. c.
c. d.
d.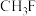 e.
e.
(4)已知酸性:
 。推测酸性:
。推测酸性: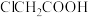
 。
。
您最近一年使用:0次
2021·全国·模拟预测
6 . 元素及其化合物在生产、生活中用途广泛。
(1)①P4S3常用于制造火柴,P和S的第一电离能较大的是___________ 。
②As4S4俗称雄黄,其中基态As原子的核外电子排布式为[Ar]___________ ,有___________ 个未成对电子。
③NH3、PH3、AsH3中沸点最高的是___________ ,其主要原因是___________ 。
(2)①Fe、Co、Ni能与Cl2反应,其中Co和Ni均生成二氯化物,由此推断FeCl3、CoCl3和Cl2的氧化性由强到弱的顺序为_____ 。
②研究发现固态PCl5和PBr5均为离子晶体,但其结构分别为[PCl4]+[PCl6]-和[PBr4]+Br-,分析PCl5和PBr5结构存在差异的原因是____ 。
(3)锑酸亚铁晶胞如图所示,其晶胞参数分别为anm、bnm、cnm,α=β=γ=90°,则:
①锑酸亚铁的化学式为___________ 。
②晶体的密度为___________ g•cm-3.(设NA为阿伏加德罗常数的值)

(1)①P4S3常用于制造火柴,P和S的第一电离能较大的是
②As4S4俗称雄黄,其中基态As原子的核外电子排布式为[Ar]
③NH3、PH3、AsH3中沸点最高的是
(2)①Fe、Co、Ni能与Cl2反应,其中Co和Ni均生成二氯化物,由此推断FeCl3、CoCl3和Cl2的氧化性由强到弱的顺序为
②研究发现固态PCl5和PBr5均为离子晶体,但其结构分别为[PCl4]+[PCl6]-和[PBr4]+Br-,分析PCl5和PBr5结构存在差异的原因是
(3)锑酸亚铁晶胞如图所示,其晶胞参数分别为anm、bnm、cnm,α=β=γ=90°,则:
①锑酸亚铁的化学式为
②晶体的密度为

您最近一年使用:0次
名校
7 . 第Ⅷ族元素Fe、Co、Ni性质相似,称为铁系元素,主要用于制造合金。回答下列问题:
(1)基态Ni原子核外有___ 种空间运动状态不同的电子,同周期元素中,基态原子未成对电子数与Ni相同的过渡元素为___ 。
(2)Fe3+与酚类物质的显色反应常用于其离子检验,已知Fe3+遇邻苯二酚( )和对苯二酚(
)和对苯二酚( )均显绿色。邻苯二酚中原子的杂化类型有
)均显绿色。邻苯二酚中原子的杂化类型有____ ,邻苯二酚的熔沸点比对苯二酚低,原因是____ 。
(3)有历史记载的第一个配合物是Fe4[Fe(CN)6]3 (普鲁士蓝),该配合物的内界为____ 。表中为Co2+、Ni2+不同配位数时对应的晶体场稳定化能(可衡量形成配合物时,总能量的降低)。由表可知,Ni2+比较稳定的配离子配位数是____ (填“4”或“6”)。Co3+性质活泼,易被还原,但形成[Co(NH3)6]3+]后氧化性降低,可能的原因是____ 。
(4)氧元素与Fe可形成低价态氧化物FeO。

①FeO立方晶胞结构如图所示,则Fe2+的配位数为___ ;与O2-紧邻的所有Fe2+构成的几何构型为____ 。
②若O2-与Fe2+之间最近距离为apm,则该晶体的密度计算式为___ g·cm-3。(用含a、NA的代数式表示,NA代表阿伏加德罗常数的值)
(1)基态Ni原子核外有
(2)Fe3+与酚类物质的显色反应常用于其离子检验,已知Fe3+遇邻苯二酚(
 )和对苯二酚(
)和对苯二酚( )均显绿色。邻苯二酚中原子的杂化类型有
)均显绿色。邻苯二酚中原子的杂化类型有(3)有历史记载的第一个配合物是Fe4[Fe(CN)6]3 (普鲁士蓝),该配合物的内界为
| 离子 | 配位数 | 晶体场稳定化能(Dq) |
| Co2+ | 6 | -8Dq+2p |
| 4 | -5.34Dq+2p | |
| Ni2+ | 6 | -12Dq+3p |
| 4 | -3.56Dq+3p |
(4)氧元素与Fe可形成低价态氧化物FeO。

①FeO立方晶胞结构如图所示,则Fe2+的配位数为
②若O2-与Fe2+之间最近距离为apm,则该晶体的密度计算式为
您最近一年使用:0次
2021-09-05更新
|
148次组卷
|
2卷引用:黑龙江省哈尔滨市第九中学校2022届高三上学期适应性考试化学试题
8 . 自然界中存在大量的钠、镁、铝、铁、铜等金属元素,氧、氮、硅、硫等非金属元素,它们的单质及其化合物在工农业生产中有着广泛的应用。
(1)请写出Cu的基态原子核外电子排布式_______
(2) 极易溶于水,其原因主要是
极易溶于水,其原因主要是_______ 。
(3)工业上常用醋酸二氨合铜溶液来吸收合成氨原料气体中的CO( 代表
代表 )则配合物
)则配合物 中心原子的配位数为
中心原子的配位数为____ 。在一定条件下 与
与 能合成尿素[
能合成尿素[ ],尿素中C原子轨道的杂化类型为
],尿素中C原子轨道的杂化类型为_____ 。
(4) 等颗粒物及扬尘等易引起雾霾,构成
等颗粒物及扬尘等易引起雾霾,构成 的四种元素电负性从大到小顺序为
的四种元素电负性从大到小顺序为_____ 。
(5)铜的化合物种类很多,如图是氯化亚铜的晶胞结构(黑色球表示Cu+,白色球表示 ),已知晶胞的棱长为anm,
),已知晶胞的棱长为anm, 表示阿伏加德罗常数,则氯化亚铜密度为ρ=
表示阿伏加德罗常数,则氯化亚铜密度为ρ=___  (列出计算式,不用化简)。
(列出计算式,不用化简)。

(6)已知反应:①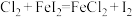
②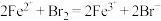
③ 。
。
则 、
、 、
、 氧化性虫强到弱为
氧化性虫强到弱为__ 。将少量氯气通入 溶液中,写出化学方程式
溶液中,写出化学方程式_ 。
(1)请写出Cu的基态原子核外电子排布式
(2)
 极易溶于水,其原因主要是
极易溶于水,其原因主要是(3)工业上常用醋酸二氨合铜溶液来吸收合成氨原料气体中的CO(
 代表
代表 )则配合物
)则配合物 中心原子的配位数为
中心原子的配位数为 与
与 能合成尿素[
能合成尿素[ ],尿素中C原子轨道的杂化类型为
],尿素中C原子轨道的杂化类型为(4)
 等颗粒物及扬尘等易引起雾霾,构成
等颗粒物及扬尘等易引起雾霾,构成 的四种元素电负性从大到小顺序为
的四种元素电负性从大到小顺序为(5)铜的化合物种类很多,如图是氯化亚铜的晶胞结构(黑色球表示Cu+,白色球表示
 ),已知晶胞的棱长为anm,
),已知晶胞的棱长为anm, 表示阿伏加德罗常数,则氯化亚铜密度为ρ=
表示阿伏加德罗常数,则氯化亚铜密度为ρ= (列出计算式,不用化简)。
(列出计算式,不用化简)。
(6)已知反应:①
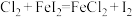
②
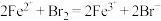
③
 。
。则
 、
、 、
、 氧化性虫强到弱为
氧化性虫强到弱为 溶液中,写出化学方程式
溶液中,写出化学方程式
您最近一年使用:0次
解题方法
9 . 过渡金属及其化合物在生产生活中有着广泛应用。锰钢异常坚硬,且具抗冲击性能,是制造枪栓、保险库、挖掘机械和铁路设施的理想材料;锰也是人体的重要微量元素。请根据所学知识,回答下列问题:
(1)铬、锰、铁称为黑色金属,位于同一周期的相邻位置。Mn基态原子的价层电子轨道表示式是___________ ;Cr基态原子的电子排布式为___________ 。
(2)下列状态的铁中,电离最外层的一个电子所需能量最大的是___________ (填编号)。
A.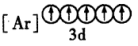 B.
B.
C.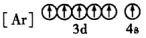 D.
D.
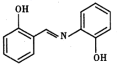
(3)水杨醛缩邻氨基苯酚又被称为“锰试剂”,可与 形成黄色的配合物。锰试剂的结构如图所示,其分子中可能与
形成黄色的配合物。锰试剂的结构如图所示,其分子中可能与 形成配位键的原子有
形成配位键的原子有___________ ;锰试剂___________ (填“能”或“不能”)形成分子内氢键。
(4)锰试剂分子中,原子采取的杂化方式不涉及___________ (填“ ”“
”“ ”或“
”或“ ”)杂化;分子中除氢以外的元素,第一电离能从小到大的顺序为
”)杂化;分子中除氢以外的元素,第一电离能从小到大的顺序为___________ (用元素符号表示)。
(5)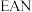 规则指的是配合物中心原子价电子数和配体提供的电子数之和为18,符合
规则指的是配合物中心原子价电子数和配体提供的电子数之和为18,符合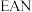 规则的配合物分子结构和化学性质都较稳定。已知
规则的配合物分子结构和化学性质都较稳定。已知 和
和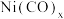 均符合
均符合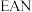 规则,性质稳定,而
规则,性质稳定,而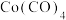 则容易在化学反应中表现氧化性。
则容易在化学反应中表现氧化性。
①x=___________ 。
②从结构角度解释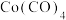 则容易在化学反应中表现氧化性的原因
则容易在化学反应中表现氧化性的原因___________ 。
(1)铬、锰、铁称为黑色金属,位于同一周期的相邻位置。Mn基态原子的价层电子轨道表示式是
(2)下列状态的铁中,电离最外层的一个电子所需能量最大的是
A.
 B.
B.
C.
 D.
D.
(3)水杨醛缩邻氨基苯酚又被称为“锰试剂”,可与
 形成黄色的配合物。锰试剂的结构如图所示,其分子中可能与
形成黄色的配合物。锰试剂的结构如图所示,其分子中可能与 形成配位键的原子有
形成配位键的原子有
(4)锰试剂分子中,原子采取的杂化方式不涉及
 ”“
”“ ”或“
”或“ ”)杂化;分子中除氢以外的元素,第一电离能从小到大的顺序为
”)杂化;分子中除氢以外的元素,第一电离能从小到大的顺序为(5)
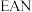 规则指的是配合物中心原子价电子数和配体提供的电子数之和为18,符合
规则指的是配合物中心原子价电子数和配体提供的电子数之和为18,符合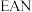 规则的配合物分子结构和化学性质都较稳定。已知
规则的配合物分子结构和化学性质都较稳定。已知 和
和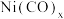 均符合
均符合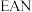 规则,性质稳定,而
规则,性质稳定,而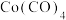 则容易在化学反应中表现氧化性。
则容易在化学反应中表现氧化性。①x=
②从结构角度解释
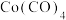 则容易在化学反应中表现氧化性的原因
则容易在化学反应中表现氧化性的原因
您最近一年使用:0次
名校
解题方法
10 . 银离子导体是发现最早的固体电解质,同时也是应用面最广的固体电解质,如制作库仑计、电子开关、压敏元件、气敏传感器、记忆元件、电容器等电化学器件。
回答以下问题:
(1)Ag+的价层电子排布式为4d10,写出Ag在周期表中的位置___ 。
(2)第三周期各元素的氯化物熔点、沸点数据如下:
请解释第三周期氯化物沸点从左到右变化的原因:___ 。
(3)偏高碘酸HIO4是无机非混合酸中氧化性极强的酸之一,可将Mn氧化为HMnO4,将Fe2+氧化为H2FeO4。HIO4的中心原子杂化形式是__ ,构成HIO4的三种元素电负性大小顺序是___ ,在HIO4晶体中存在___ (填字母)
A.离子键 B.极性共价键 C.非极性共价键 D.分子间作用力 E.σ键 F.π键
(4)室温下,AgI属于六方ZnS结构,其中S原子作六方密堆积,Zn原子填充在半数的四面体空隙中。则AgI晶体中I原子的配位数是___ 。
(5)400℃以上AgI固体的导电能力是室温的上万倍,可与电解质溶液媲美,经研究发现其在146℃以上转化为一种奇特结构:α—AgI,I-作体心立方堆积,而Ag+则选择性填入I-构成的三类孔隙中:八面体孔隙(O)、四面体孔隙(T)和三角形孔隙(Tr),则平均每个α—AgI晶胞中的Ag+数是___ ,I-与I-构成的三类孔隙堆积之比为I-:O:T:Tr=1:__ :__ :12。

回答以下问题:
(1)Ag+的价层电子排布式为4d10,写出Ag在周期表中的位置
(2)第三周期各元素的氯化物熔点、沸点数据如下:
| NaCl | MgCl2 | AlCl3 | SiCl4 | PCl3 | S2Cl2 | |
| 熔点/K | 1074 | 987 | 465 | 205 | 181 | 193 |
| 沸点/K | 1686 | 1691 | 453(升华) | 216 | 349 | 411 |
请解释第三周期氯化物沸点从左到右变化的原因:
(3)偏高碘酸HIO4是无机非混合酸中氧化性极强的酸之一,可将Mn氧化为HMnO4,将Fe2+氧化为H2FeO4。HIO4的中心原子杂化形式是
A.离子键 B.极性共价键 C.非极性共价键 D.分子间作用力 E.σ键 F.π键
(4)室温下,AgI属于六方ZnS结构,其中S原子作六方密堆积,Zn原子填充在半数的四面体空隙中。则AgI晶体中I原子的配位数是
(5)400℃以上AgI固体的导电能力是室温的上万倍,可与电解质溶液媲美,经研究发现其在146℃以上转化为一种奇特结构:α—AgI,I-作体心立方堆积,而Ag+则选择性填入I-构成的三类孔隙中:八面体孔隙(O)、四面体孔隙(T)和三角形孔隙(Tr),则平均每个α—AgI晶胞中的Ag+数是

您最近一年使用:0次
2021-05-18更新
|
648次组卷
|
3卷引用:宁夏银川一中等17校2021届高三下学期5月联考理综化学试题



