2021高三·全国·专题练习
1 . 已知运送卫星的火箭所需燃料除液态H2O2外,还有另一种液态氮氢化合物。已知该化合物中氢元素的质量分数为12.5%,相对分子质量为32,结构分析发现该化合物分子中只有单键。
(1)该氮氢化合物的电子式为___________ ,其中N原子采取___________ 杂化,该分子是___________ (填“极性”或“非极性”)分子。
(2)若该物质与液态H2O2反应,产生两种无毒又不污染环境的物质,在该反应的反应物和生成物中既含有极性键又含有非极性键的是___________ (填化学式,下同),只含有非极性键的是___________ ,只含有极性键的是___________ 。
(3)已知NH3分子中的N原子有一对孤电子对,能发生反应:NH3+HCl=NH4Cl。试写出将上述液态氮氢化合物加入足量盐酸中时,发生反应的化学方程式:___________ 。
(1)该氮氢化合物的电子式为
(2)若该物质与液态H2O2反应,产生两种无毒又不污染环境的物质,在该反应的反应物和生成物中既含有极性键又含有非极性键的是
(3)已知NH3分子中的N原子有一对孤电子对,能发生反应:NH3+HCl=NH4Cl。试写出将上述液态氮氢化合物加入足量盐酸中时,发生反应的化学方程式:
您最近一年使用:0次
名校
解题方法
2 . 2020年9月科学家发现金星上有磷化氢( ),实验室制备
),实验室制备 的常用方法有两种:
的常用方法有两种:
①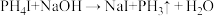
②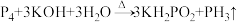
完成下列填空:
(1)P核外能量最高的电子具有相同的___________ (填写序号)。
A.轨道B.自旋方向C.电子云形状D.电子云伸展反应
(2)已知 与
与 的结构相似,
的结构相似, 的空间结构是
的空间结构是___________ 。 的分解温度比
的分解温度比
___________ (填“高”、“低”),判断的依据是___________ 。
(3)已知 为三元酸,其结构式为:
为三元酸,其结构式为: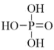 。
。
①次磷酸( 中的P的成键情况与
中的P的成键情况与 中的相同,则
中的相同,则 的结构式是
的结构式是___________ 。
②利用反应②制备 时,即使KOH过量,仍只生成
时,即使KOH过量,仍只生成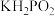 ,说明
,说明 是
是___________ 元酸。
(4)常温下, 在不同pH的溶液中,各种含磷微粒的质量分数如图所示。
在不同pH的溶液中,各种含磷微粒的质量分数如图所示。

①电离平衡常数与化学平衡常数意义相同,写出 第二步电离平衡常数表达式
第二步电离平衡常数表达式
___________ 。
(2)图中可推断 溶液呈
溶液呈___________ (填“酸”、“碱”、“中”)性,可能的原因是___________ 。 溶液中各含磷微粒以及
溶液中各含磷微粒以及 按浓度由大到小的顺序排列
按浓度由大到小的顺序排列___________ 。
 ),实验室制备
),实验室制备 的常用方法有两种:
的常用方法有两种:①
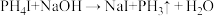
②
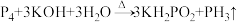
完成下列填空:
(1)P核外能量最高的电子具有相同的
A.轨道B.自旋方向C.电子云形状D.电子云伸展反应
(2)已知
 与
与 的结构相似,
的结构相似, 的空间结构是
的空间结构是 的分解温度比
的分解温度比
(3)已知
 为三元酸,其结构式为:
为三元酸,其结构式为: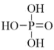 。
。①次磷酸(
 中的P的成键情况与
中的P的成键情况与 中的相同,则
中的相同,则 的结构式是
的结构式是②利用反应②制备
 时,即使KOH过量,仍只生成
时,即使KOH过量,仍只生成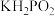 ,说明
,说明 是
是(4)常温下,
 在不同pH的溶液中,各种含磷微粒的质量分数如图所示。
在不同pH的溶液中,各种含磷微粒的质量分数如图所示。
①电离平衡常数与化学平衡常数意义相同,写出
 第二步电离平衡常数表达式
第二步电离平衡常数表达式
(2)图中可推断
 溶液呈
溶液呈 溶液中各含磷微粒以及
溶液中各含磷微粒以及 按浓度由大到小的顺序排列
按浓度由大到小的顺序排列
您最近一年使用:0次
2021-04-02更新
|
224次组卷
|
4卷引用:上海市杨浦区2020-2021学年度高三下学期高中等级考模拟质量调研(3月)化学试题
上海市杨浦区2020-2021学年度高三下学期高中等级考模拟质量调研(3月)化学试题上海市杨浦区2021届高三二模化学试题河北省张家口宣化一中2021届高三下学期阶段模拟(六)化学试题(已下线)二轮拔高卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(上海卷)
3 . 氢气的生产、存储是氢能应用的核心。目前较成熟的生产、存储路线之一为:利用CH3OH和H2O在某Cu/Zn-Al催化剂存在下生产H2,H2与Mg在一定条件下制得储氢物质X。
回答问题:。
(1)Al在周期表中的位置___________ 。基态Zn的价层电子排布式___________ 。
(2)水分了中氧原子的杂化轨道类型___________ 。
(3)键能是衡量共价键稳定性的参数之一、CH3OH键参数中有___________ 种键能数据。CH3OH可以与水以任意比例互溶的原因是__________ 。
(4)X的晶胞结构如图所示(晶胞参数:α =β =γ=90º,a=b=450.25 pm),密度为1.4 g·cm-3,X的储氢质量分数是___________ ,c= ___________ pm (列出计算式即可)。
(提示:晶胞结构,H-位于6个面上;Mg2+在立方体的中心和8个顶点)

回答问题:。
(1)Al在周期表中的位置
(2)水分了中氧原子的杂化轨道类型
(3)键能是衡量共价键稳定性的参数之一、CH3OH键参数中有
(4)X的晶胞结构如图所示(晶胞参数:α =β =γ=90º,a=b=450.25 pm),密度为1.4 g·cm-3,X的储氢质量分数是
(提示:晶胞结构,H-位于6个面上;Mg2+在立方体的中心和8个顶点)

您最近一年使用:0次
名校
解题方法
4 . Fe、Co、Ni是第四周期的重要的金属元素,回答下列问题:
(1)FeCoOx是一种新型光电催化剂,第四电离能大小关系是I4(Fe)_____ I4(Co)(填“>”“<”或“=”),原因是____________________ 。
(2)二茂铁是一种具有芳香族性质的有机过渡金属化合物。其在工业、农业、医药、航天、节能、环保等行业具有广泛的应用。环戊二烯可用于制备二茂铁。
①环戊二烯中碳原子的杂化方式为____________
②1mol环戊二烯中有__________ molσ键。
(3)①FeS2晶体的晶胞如图甲所示。已知其晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,晶胞边长__________ nm。
②该晶胞中Fe2+位于S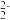 所形成的正八面体的体心,则正八面体的边长为
所形成的正八面体的体心,则正八面体的边长为______ nm
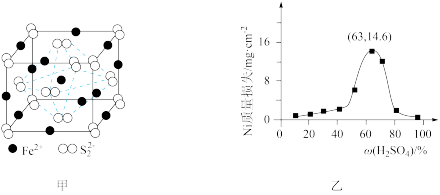
(4)基态Ni2+的价电子排布图为________ 。在一定温度下将Ni片与不同质量分数的硫酸反应,4h后的Ni的质量损失情况如图乙所示,发现当硫酸质量分数大于63%时Ni被腐蚀的速率逐渐降低,其可能原因为__________________ 。
(1)FeCoOx是一种新型光电催化剂,第四电离能大小关系是I4(Fe)
(2)二茂铁是一种具有芳香族性质的有机过渡金属化合物。其在工业、农业、医药、航天、节能、环保等行业具有广泛的应用。环戊二烯可用于制备二茂铁。
①环戊二烯中碳原子的杂化方式为
②1mol环戊二烯中有
(3)①FeS2晶体的晶胞如图甲所示。已知其晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,晶胞边长
②该晶胞中Fe2+位于S
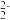 所形成的正八面体的体心,则正八面体的边长为
所形成的正八面体的体心,则正八面体的边长为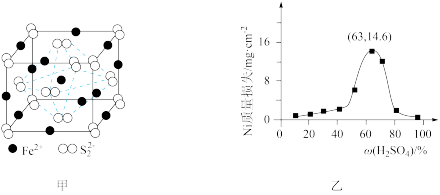
(4)基态Ni2+的价电子排布图为
您最近一年使用:0次
名校
5 . 已知A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素,E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子。G元素最大能层符号为N,有4个单电子。
(1)基态E原子的价电子排布图___________ 。
(2)B、C、D三元素第一电离能由大到小的顺序为___________ (用元素符号表示)。
(3) 中心原子为
中心原子为___________ 杂化,空间构型为___________ ,键角___________  (用“>、<、=”填空)。
(用“>、<、=”填空)。
(4) 与C2为等电子体结构相似,1mol
与C2为等电子体结构相似,1mol 中含有
中含有 键的数目为
键的数目为___________ 。
(5)D、E元素最简单氢化物的稳定性___________ (填化学式)。
(6)基态G2+离子的电子排布式为:___________ 。
(1)基态E原子的价电子排布图
(2)B、C、D三元素第一电离能由大到小的顺序为
(3)
 中心原子为
中心原子为 (用“>、<、=”填空)。
(用“>、<、=”填空)。(4)
 与C2为等电子体结构相似,1mol
与C2为等电子体结构相似,1mol 中含有
中含有 键的数目为
键的数目为(5)D、E元素最简单氢化物的稳定性
(6)基态G2+离子的电子排布式为:
您最近一年使用:0次
名校
解题方法
6 . 科学家研究制备各种元素形成的化合物,广泛应用在科研、军事、医疗等各个领域。以下是元家周期表前四周期元素R、X、Y、Z形成的某些物质的结构与性质,结合你所学习的化学知识回答下列问题:
(1)R元素的原子核外有7个运动状态不同的电子,请写出R元素基态原子的价层电子排布图:___________ 。R元素最高价含氧酸与硫酸酸性强度相近,原因是___________ 。
(2)下列说法错误的是___________(填序号)。
(3)氨硼烷 因其高储氢含量以及室温稳定等特性受到科学家们的关注,写出一种与氨硼烷互为等电子体的分子
因其高储氢含量以及室温稳定等特性受到科学家们的关注,写出一种与氨硼烷互为等电子体的分子___________ (填化学式)。
(4)X元素含有3个能级,且每个能级所含的电子数相同,其单质的一种同素异形体的晶胞如图所示,则一个晶胞中所含X原子数为___________ ;其中原子坐标参数a为 ,b为
,b为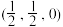 ,则c点原子的坐标参数为
,则c点原子的坐标参数为___________ 。

(5)Y元素是地壳中含量最多的元素,Z元素的正一价离子的3d能级为全充满,Z离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。向Z的硫酸盐溶液中通入过量的 可生成
可生成 ,该离子的结构式为
,该离子的结构式为___________ (用元素符号表示)。某化合物与 (Ⅰ表示化合价为+1价)结合形成图所示的离子,该离子中碳原子的杂化方式是
(Ⅰ表示化合价为+1价)结合形成图所示的离子,该离子中碳原子的杂化方式是___________ 。

(6)Y元素与Z元素形成离子个数比为1:1的化合物,晶胞与NaCl类似,Z离子的配位数是___________ ;设Y离子的半径为apm,Z离子的半径为bpm,求该晶胞的空间利用率:___________ 。(列出计算式即可)
(1)R元素的原子核外有7个运动状态不同的电子,请写出R元素基态原子的价层电子排布图:
(2)下列说法错误的是___________(填序号)。
A.二氧化硅的相对分子质量比二氧化碳的大,所以沸点: |
B.电负性顺序: |
C. 与CO为等电子体,结构相似,化学性质相似 与CO为等电子体,结构相似,化学性质相似 |
D.稳定性: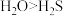 ,由于水分子间存在氢键 ,由于水分子间存在氢键 |
 因其高储氢含量以及室温稳定等特性受到科学家们的关注,写出一种与氨硼烷互为等电子体的分子
因其高储氢含量以及室温稳定等特性受到科学家们的关注,写出一种与氨硼烷互为等电子体的分子(4)X元素含有3个能级,且每个能级所含的电子数相同,其单质的一种同素异形体的晶胞如图所示,则一个晶胞中所含X原子数为
 ,b为
,b为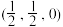 ,则c点原子的坐标参数为
,则c点原子的坐标参数为
(5)Y元素是地壳中含量最多的元素,Z元素的正一价离子的3d能级为全充满,Z离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。向Z的硫酸盐溶液中通入过量的
 可生成
可生成 ,该离子的结构式为
,该离子的结构式为 (Ⅰ表示化合价为+1价)结合形成图所示的离子,该离子中碳原子的杂化方式是
(Ⅰ表示化合价为+1价)结合形成图所示的离子,该离子中碳原子的杂化方式是
(6)Y元素与Z元素形成离子个数比为1:1的化合物,晶胞与NaCl类似,Z离子的配位数是
您最近一年使用:0次
7 . A、B、C、D、E是前四周期的五种元素,原子序数依次增大,只有B、C位于同一周期且位置相邻,其中C是地壳中含量最多的元素,D是其所处周期中电负性最强的元素,E为过渡元素,原子核外只有两个单电子,其余原子轨道均充满电子。回答下列问题
(1)B元素的基态原子电子的空间运动状态有_______ 种;E元素的价电子排布式_______ ,其基态原子有_______ 种能量不同的电子。
(2)B、C两种元素分别与A元素形成的两种10电子阳离子中,中心原子的杂化方式都是采用_______ 杂化,键角大的是_______ (填离子符号),原因是_______ 。
(3)D单质通入 中发生反应的离子方程式是
中发生反应的离子方程式是_______ :写出ADC的电子式_______ 。
(4) 的空间构型是
的空间构型是_______ ;第一电离能B_______ C(填“<”或“>”)。A、B、C三种元素电负性由大到小的顺序是_______ (用元素符号表示)。
(1)B元素的基态原子电子的空间运动状态有
(2)B、C两种元素分别与A元素形成的两种10电子阳离子中,中心原子的杂化方式都是采用
(3)D单质通入
 中发生反应的离子方程式是
中发生反应的离子方程式是(4)
 的空间构型是
的空间构型是
您最近一年使用:0次
解题方法
8 . 铝和硅在地壳中含量丰富,其单质和化合物具有广泛的应用价值。请回答下列问题:
(1)①基态Si原子的价电子排布式为___________ 。
②写出一种与SiCl4互为等电子体的离子的化学式___________ 。
(2)AlCl3的相对分子质量为133.5,178℃开始升华,易溶于水、四氯化碳等,熔融时生成可挥发的二聚物(Al2Cl6),结构如图所示:
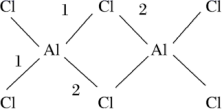
①二聚物中Al原子的杂化轨道类型为___________ 。
②从键的形成角度分析1键和2键的区别:___________ 。
(3)LiAlH4是一种特殊的还原剂,可将羧酸直接还原成醇。
CH3COOH CH3CH2OH
CH3CH2OH
①AlH 的VSEPR模型名称是
的VSEPR模型名称是___________ 。
②CH3COOH分子中π键和σ键的数目之比为___________
(4)铝和氮可形成一种具有四面体结构单元的高温结构陶瓷,其晶胞如图所示:

晶胞中Al的配位数是___________ ,若该晶胞的边长为a pm,则该晶体的密度为___________ g·cm-3.(用NA表示阿伏加德罗常数的值) 相对分子质量 Al-27 N-14
(1)①基态Si原子的价电子排布式为
②写出一种与SiCl4互为等电子体的离子的化学式
(2)AlCl3的相对分子质量为133.5,178℃开始升华,易溶于水、四氯化碳等,熔融时生成可挥发的二聚物(Al2Cl6),结构如图所示:

①二聚物中Al原子的杂化轨道类型为
②从键的形成角度分析1键和2键的区别:
(3)LiAlH4是一种特殊的还原剂,可将羧酸直接还原成醇。
CH3COOH
 CH3CH2OH
CH3CH2OH①AlH
 的VSEPR模型名称是
的VSEPR模型名称是②CH3COOH分子中π键和σ键的数目之比为
(4)铝和氮可形成一种具有四面体结构单元的高温结构陶瓷,其晶胞如图所示:

晶胞中Al的配位数是
您最近一年使用:0次
名校
解题方法
9 . 氧元素为地壳中含量最高的元素,可形成多种重要的单质和化合物。
(1)氧元素的价电子排布式为_______ ,第二周期元素中,第一电离能比氧大的有_______ 种。
(2) 可用于漂白草帽,
可用于漂白草帽, 的中心原子的杂化形式为
的中心原子的杂化形式为_______ 杂化,其分子的 模型为
模型为_______ 。
(3)含氧有机物中, 的沸点高于
的沸点高于 的原因为
的原因为_______ , 不能用无水
不能用无水 干燥是因为
干燥是因为 和
和 可形成
可形成 ,形成该配位离子提供空轨道的是
,形成该配位离子提供空轨道的是_______ ,提供孤电子的是_______ 。
(4)氧元素可分别与 和
和 形成低价态氧化物
形成低价态氧化物 和
和 。
。

① 立方晶胞结构如图1所示,则
立方晶胞结构如图1所示,则 的配位数为
的配位数为_______ ,与 紧邻的所有
紧邻的所有 构成的几何构型为
构成的几何构型为_______ 。
② 立方晶胞结构如图2所示,若
立方晶胞结构如图2所示,若 与
与 之间最近距离为
之间最近距离为 ,则该晶体的密度为
,则该晶体的密度为_______  (用a、
(用a、 列式表达,
列式表达, 代表阿伏加德罗常数的值)。
代表阿伏加德罗常数的值)。
(1)氧元素的价电子排布式为
(2)
 可用于漂白草帽,
可用于漂白草帽, 的中心原子的杂化形式为
的中心原子的杂化形式为 模型为
模型为(3)含氧有机物中,
 的沸点高于
的沸点高于 的原因为
的原因为 不能用无水
不能用无水 干燥是因为
干燥是因为 和
和 可形成
可形成 ,形成该配位离子提供空轨道的是
,形成该配位离子提供空轨道的是(4)氧元素可分别与
 和
和 形成低价态氧化物
形成低价态氧化物 和
和 。
。
①
 立方晶胞结构如图1所示,则
立方晶胞结构如图1所示,则 的配位数为
的配位数为 紧邻的所有
紧邻的所有 构成的几何构型为
构成的几何构型为②
 立方晶胞结构如图2所示,若
立方晶胞结构如图2所示,若 与
与 之间最近距离为
之间最近距离为 ,则该晶体的密度为
,则该晶体的密度为 (用a、
(用a、 列式表达,
列式表达, 代表阿伏加德罗常数的值)。
代表阿伏加德罗常数的值)。
您最近一年使用:0次
名校
解题方法
10 . A、B、C、D、E、F为原子序数依次增大的前四周期元素,A元素原子最外层电子数是其内层电子数的2.5倍,B元素是地壳中含量最高的元素,C元素的最高化合价和最低化合价的代数和等于0,D元素的单质可用于自来水消毒杀菌,E元素位于周期表的ⅥB族,F的基态原子中有4个未成对电子。
(1)A元素单质的结构式为_______ ;基态E元素原子价层电子排布图为_______ 。
(2)在A的氢化物A2H4分子中,A原子轨道的杂化类型是_______ ;A与B形成的A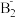 的立体构型为
的立体构型为_______ 。
(3)火箭推动剂由A2H4和H2B2组成,加热反应时有A元素的单质生成,写出该化学反应方程式:_______ 。
(4)写出酸性条件下,E元素的离子E2 和D元素的阴离子反应的离子方程式:
和D元素的阴离子反应的离子方程式:_______ 。
(5)基态F3+未成对电子数为_______ 个;F3+与SCN—络合得到多种配合物,其中配位数为5的配合物的阴离子为_______ (填化学式)。
(6)元素B与E形成的一种化合物广泛应用于录音磁带上,其晶胞如图所示。若晶胞参数为a pm,NA为阿伏加德罗常数的值,则该晶胞的密度为_______ g·cm-3。

(1)A元素单质的结构式为
(2)在A的氢化物A2H4分子中,A原子轨道的杂化类型是
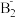 的立体构型为
的立体构型为(3)火箭推动剂由A2H4和H2B2组成,加热反应时有A元素的单质生成,写出该化学反应方程式:
(4)写出酸性条件下,E元素的离子E2
 和D元素的阴离子反应的离子方程式:
和D元素的阴离子反应的离子方程式:(5)基态F3+未成对电子数为
(6)元素B与E形成的一种化合物广泛应用于录音磁带上,其晶胞如图所示。若晶胞参数为a pm,NA为阿伏加德罗常数的值,则该晶胞的密度为

您最近一年使用:0次



