名校
1 . 超分子化学已逐渐扩展到化学的各个分支,还扩展到生命科学和物理学等领域。由Mo将2个 分子、2个p一甲酸丁酯吡啶分子及2个CO分子利用配位键自组装的超分子结构如图1所示。
分子、2个p一甲酸丁酯吡啶分子及2个CO分子利用配位键自组装的超分子结构如图1所示。
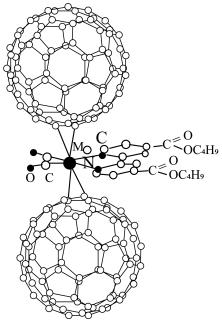
(1)Mo位于第5周期ⅥB族,基态原子核外电子排布与Cr相似,则基态Mo原子的价电子排布式为___________ 。
(2)该超分子中存在的化学键类型有___________(填字母)
(3)配体CO中提供孤电子对的原子是___________ (填元素符号);p—甲酸丁酯吡啶配体中C原子的杂化方式有___________ 。
(4)从电负性角度解释 的酸性强于
的酸性强于 的原因
的原因___________ 。
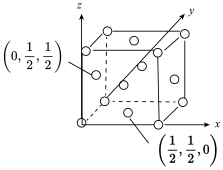
(5)已知:某晶胞中各原子的相对位置可用如图2所示的原子坐标表示,其中所有顶点原子坐标均为(0,0,0)。钼(Mo)的一种立方晶系的晶体结构中,每个晶胞有2个Mo原子,其中Mo原子坐标是(0,0,0)及( ,
, ,
, )。根据以上信息,推断该晶体的原子堆积方式是
)。根据以上信息,推断该晶体的原子堆积方式是___________ 。已知该晶体的密度是 ,Mo的摩尔质量是
,Mo的摩尔质量是 ,阿伏加德罗常数的值是NA,晶体中距离最近的Mo原子核之间的距离为
,阿伏加德罗常数的值是NA,晶体中距离最近的Mo原子核之间的距离为___________ pm。
(6) 与金刚石互为同素异形体,从结构与性质之间的关系解释
与金刚石互为同素异形体,从结构与性质之间的关系解释 的熔点远低于金刚石的原因是
的熔点远低于金刚石的原因是___________ 。金刚石晶胞含有___________ 个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=___________ a,列式表示碳原子在晶胞中的空间占有率___________ (列出表达式即可)。
 分子、2个p一甲酸丁酯吡啶分子及2个CO分子利用配位键自组装的超分子结构如图1所示。
分子、2个p一甲酸丁酯吡啶分子及2个CO分子利用配位键自组装的超分子结构如图1所示。
(1)Mo位于第5周期ⅥB族,基态原子核外电子排布与Cr相似,则基态Mo原子的价电子排布式为
(2)该超分子中存在的化学键类型有___________(填字母)
| A.σ键 | B.π键 | C.离子键 | D.氢键 |
(4)从电负性角度解释
 的酸性强于
的酸性强于 的原因
的原因(5)已知:某晶胞中各原子的相对位置可用如图2所示的原子坐标表示,其中所有顶点原子坐标均为(0,0,0)。钼(Mo)的一种立方晶系的晶体结构中,每个晶胞有2个Mo原子,其中Mo原子坐标是(0,0,0)及(
 ,
, ,
, )。根据以上信息,推断该晶体的原子堆积方式是
)。根据以上信息,推断该晶体的原子堆积方式是 ,Mo的摩尔质量是
,Mo的摩尔质量是 ,阿伏加德罗常数的值是NA,晶体中距离最近的Mo原子核之间的距离为
,阿伏加德罗常数的值是NA,晶体中距离最近的Mo原子核之间的距离为
(6)
 与金刚石互为同素异形体,从结构与性质之间的关系解释
与金刚石互为同素异形体,从结构与性质之间的关系解释 的熔点远低于金刚石的原因是
的熔点远低于金刚石的原因是
您最近一年使用:0次
名校
2 . 被称为“愚人金”的黄铜矿( )主要用作炼铜,其在野外很容易被误认为黄金。
)主要用作炼铜,其在野外很容易被误认为黄金。
(1)基态Cu原子中,核外电子占据最高能层的符号是___________ ,占据该能层电子的电子云轮廓图形状为___________ 。
(2)基态硫原子的价层电子排布图是___________ 。硫单质的一种结构称被为“王冠结构” ,分子中S原子的杂化方式为
,分子中S原子的杂化方式为___________ ,该物质___________ (填“可溶”或“难溶”)于水。
(3)S有+4和+6两种价态的氧化物,关于气态 和
和 的说法中,正确的是___________(填字母)。
的说法中,正确的是___________(填字母)。
(4)三种离子① 、②
、② 、③
、③ 键角由大到小的顺序是
键角由大到小的顺序是___________ (用序号表示)。
(5)分析比较沸点高低:
___________  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
 )主要用作炼铜,其在野外很容易被误认为黄金。
)主要用作炼铜,其在野外很容易被误认为黄金。(1)基态Cu原子中,核外电子占据最高能层的符号是
(2)基态硫原子的价层电子排布图是
 ,分子中S原子的杂化方式为
,分子中S原子的杂化方式为(3)S有+4和+6两种价态的氧化物,关于气态
 和
和 的说法中,正确的是___________(填字母)。
的说法中,正确的是___________(填字母)。| A.中心原子的价层电子对数目相等 | B.都含有极性键 |
| C.中心原子的孤电子对数目相等 | D.都是极性分子 |
 、②
、② 、③
、③ 键角由大到小的顺序是
键角由大到小的顺序是(5)分析比较沸点高低:

 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
您最近一年使用:0次
名校
解题方法
3 . 现有部分短周期元素的性质或原子结构如表:
回答下列问题:
(1)X的离子结构示意图为__ 。
(2)Z的简单气态氢化物的VSEPR模型为___ ,分子中的中心原子的杂化轨道类型为___ ,分子的空间结构为__ 。
(3)1个Z的单质分子中,含有__ 个σ键和__ 个π键。
(4)Y的最高价氧化物对应的水化物与KOH反应的化学方程式为__ 。
(5)元素T与氯元素相比,非金属性较强的是__ (填元素符号),下列表述中能证明这事实的是__ (填标号)。
a.常温下氯气的颜色比T单质的颜色深
b.T的单质通入氯化钠水溶液中不能置换出氯气
c.氯与T形成的化合物中,氯元素呈正价
| 元素 | 元素性质或原子结构 |
| T | 2p轨道上有5个电子 |
| X | L层p能级电子数比s能级电子数多2个 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | L层有3个未成对电子 |
回答下列问题:
(1)X的离子结构示意图为
(2)Z的简单气态氢化物的VSEPR模型为
(3)1个Z的单质分子中,含有
(4)Y的最高价氧化物对应的水化物与KOH反应的化学方程式为
(5)元素T与氯元素相比,非金属性较强的是
a.常温下氯气的颜色比T单质的颜色深
b.T的单质通入氯化钠水溶液中不能置换出氯气
c.氯与T形成的化合物中,氯元素呈正价
您最近一年使用:0次
2022-01-09更新
|
164次组卷
|
3卷引用:辽宁省辽河油田第二高级中学2021-2022学年高二上学期期中考试化学试题
辽宁省辽河油田第二高级中学2021-2022学年高二上学期期中考试化学试题(已下线)2.2 分子的空间结构(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)安徽省滁州市九校2021-2022学年高二下学期3月月考化学试题
4 . 二茂铁( )分子式为
)分子式为 ,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。
,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。
(1)Fe在周期表中的___________ 区,受热后Fe的1个4s电子会跃迁至4p轨道,写出Fe的该激发态电子排布式:[Ar]___________ 。
(2)二茂铁的衍生物可和H3O+等微粒产生静电作用,H、O和C的电负性由大到小的顺序为___________ ;H3O+中氧原子的杂化方式为___________ ,H3O+空间构型为___________ 。
(3)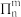 表示处于同一平面上的n个原子共用m个电子形成的大Π键,当
表示处于同一平面上的n个原子共用m个电子形成的大Π键,当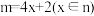 时,
时,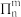 较稳定(又叫4x+2规则)。已知C5H5Θ中所有碳原子均共平面,写出C5H5Θ(
较稳定(又叫4x+2规则)。已知C5H5Θ中所有碳原子均共平面,写出C5H5Θ( )的大Π键:
)的大Π键:___________ , (C5H6)比
(C5H6)比 (C5H10)更易电离出H+的原因是
(C5H10)更易电离出H+的原因是___________ 。
(4)T-碳是碳的一种同素异形体,其晶体结构可以看成是金刚石晶体(如图甲)中每个碳原子被一个由四个碳原子组成的正四面体结构单元( )所取代(如图乙)。
)所取代(如图乙)。

一个T-碳晶胞中含有___________ 个碳原子,已知T-碳的密度约为金刚石的一半。则T-碳晶胞的边长和金刚石晶胞的边长之比为___________ 。
 )分子式为
)分子式为 ,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。
,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。(1)Fe在周期表中的
(2)二茂铁的衍生物可和H3O+等微粒产生静电作用,H、O和C的电负性由大到小的顺序为
(3)
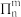 表示处于同一平面上的n个原子共用m个电子形成的大Π键,当
表示处于同一平面上的n个原子共用m个电子形成的大Π键,当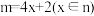 时,
时,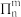 较稳定(又叫4x+2规则)。已知C5H5Θ中所有碳原子均共平面,写出C5H5Θ(
较稳定(又叫4x+2规则)。已知C5H5Θ中所有碳原子均共平面,写出C5H5Θ( )的大Π键:
)的大Π键: (C5H6)比
(C5H6)比 (C5H10)更易电离出H+的原因是
(C5H10)更易电离出H+的原因是(4)T-碳是碳的一种同素异形体,其晶体结构可以看成是金刚石晶体(如图甲)中每个碳原子被一个由四个碳原子组成的正四面体结构单元(
 )所取代(如图乙)。
)所取代(如图乙)。
一个T-碳晶胞中含有
您最近一年使用:0次
2022-01-07更新
|
398次组卷
|
2卷引用:四川省遂宁市2022届高三一诊理科综合化学试题
名校
解题方法
5 . KMnO4是一种高效氧化剂,可用来氧化吸附有机异味物,也可以与水中的杂质如二价铁、锰、硫、氰、酚等反应。实验室常用Na2C2O4标准溶液标定未知浓度的KMnO4溶液,发生反应:5C2O +2MnO
+2MnO +16H++4H2O=2[Mn(H2O)6]2++10CO2↑。根据以上信息,完成下列问题:
+16H++4H2O=2[Mn(H2O)6]2++10CO2↑。根据以上信息,完成下列问题:
(1)基态Mn2+的核外电子排布式可表示为___________ ,上述反应方程式中的各原子的电负性由大到小的关系是___________ 。
(2)1mol[Mn(H2O)6]2+中所含有的共价键数目为___________ 。
(3)CO2的电子式是___________ ,C2O 中碳原子的轨道杂化类型是
中碳原子的轨道杂化类型是___________ 。
(4)同主族元素氧、硫、硒对应最简单氢化物的沸点由高到低顺序是___________ ,原因是___________ 。
(5)β—MnSe的结构中Se为面心立方最密堆积,晶胞结构如图所示。
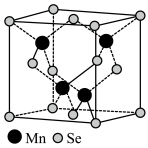
①β—MnSe中Mn的配位数为___________ 。
②若该晶体的晶胞参数为apm,阿伏加德罗常数的值为NA。则距离最近的两个锰原子之间的距离为___________ pm。
 +2MnO
+2MnO +16H++4H2O=2[Mn(H2O)6]2++10CO2↑。根据以上信息,完成下列问题:
+16H++4H2O=2[Mn(H2O)6]2++10CO2↑。根据以上信息,完成下列问题:(1)基态Mn2+的核外电子排布式可表示为
(2)1mol[Mn(H2O)6]2+中所含有的共价键数目为
(3)CO2的电子式是
 中碳原子的轨道杂化类型是
中碳原子的轨道杂化类型是(4)同主族元素氧、硫、硒对应最简单氢化物的沸点由高到低顺序是
(5)β—MnSe的结构中Se为面心立方最密堆积,晶胞结构如图所示。

①β—MnSe中Mn的配位数为
②若该晶体的晶胞参数为apm,阿伏加德罗常数的值为NA。则距离最近的两个锰原子之间的距离为
您最近一年使用:0次
名校
解题方法
6 . 过渡金属元素铬(Cr)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
(1)Cr 是第___________ 周期第___________ 族元素。
(2)基态 Cr 原子的核外电子有___________ 种空间运动状态,有___________ 个未成对电子。
(3)Cr3+能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中,中心离子的配位数为___________ 。
(4)[Cr(NH3)3(H2O)2Cl]2+的配体分子 NH3 中 N 的杂化轨道类型是___________ ,H2O 的键角小于 NH3,原因是___________ 。
(5)在金属材料中添加 AlCr2 颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2 具有体心四方结构,如下图所示,处于顶角位置的是___________ 原子。若 NA 表示阿伏加德罗常数的值,则该晶体的密度为___________ g∙cm−3(用含 a、c 和 NA 的代数式表示)。晶胞中长、宽为a nm,高为c nm。
(1)Cr 是第
(2)基态 Cr 原子的核外电子有
(3)Cr3+能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中,中心离子的配位数为
(4)[Cr(NH3)3(H2O)2Cl]2+的配体分子 NH3 中 N 的杂化轨道类型是
(5)在金属材料中添加 AlCr2 颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2 具有体心四方结构,如下图所示,处于顶角位置的是

您最近一年使用:0次
2022-01-07更新
|
350次组卷
|
3卷引用:天津市南开区2021-2022学年高三上学期期末考试化学试卷
名校
7 . 回答下列各小题
(1)现代化学中,常利用_________ 上的特征谱线来鉴定元素。基态氮原子价电子排布图不是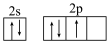 ,是因为该排布方式违背了
,是因为该排布方式违背了__________________ 。
(2)元素硒的基态原子的电子排布式简写为_________ ,第四周期中,与硒原子未成对电子数相同的金属元素有_________ 种。
(3)金属A的原子只有3个电子层,其第一至第四电离能如下:
则A原子的价层电子排布式为__________________ 。
(4)元素铜的第二电离能_________ (填“大于”“小于”或“等于”)锌的第二电离能。
(5) 、
、 、
、 、D、E、
、D、E、 分别表示含10个电子的六种粒子(离子或分子)。其中:
分别表示含10个电子的六种粒子(离子或分子)。其中:
a. 、
、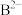 、
、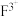 核外电子层结构相同 b.C是由两种元素组成的
核外电子层结构相同 b.C是由两种元素组成的
c.D是两种元素组成的四原子分子 d.E在常温下是无色液体
e.往含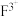 的溶液中滴加含
的溶液中滴加含 的溶液至过量,先有白色沉淀生成,后沉淀消失
的溶液至过量,先有白色沉淀生成,后沉淀消失
①D的空间构型为__________________ ;
②上述粒子中所含元素原子的第一电离能由大到小的顺序为_________ (用元素符号表示);
③用电子式表示 的形成过程
的形成过程____________________________________ ;
④与C组成元素相同且含18个电子的分子M中,孤电子对与 键的数目之比为
键的数目之比为_________ 。
(1)现代化学中,常利用
 ,是因为该排布方式违背了
,是因为该排布方式违背了(2)元素硒的基态原子的电子排布式简写为
(3)金属A的原子只有3个电子层,其第一至第四电离能如下:
电离能( ) ) |  |  |  |  |
| A | 932 | 1821 | 15390 | 21771 |
(4)元素铜的第二电离能
(5)
 、
、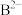 、
、 、D、E、
、D、E、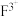 分别表示含10个电子的六种粒子(离子或分子)。其中:
分别表示含10个电子的六种粒子(离子或分子)。其中:a.
 、
、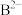 、
、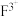 核外电子层结构相同 b.C是由两种元素组成的
核外电子层结构相同 b.C是由两种元素组成的c.D是两种元素组成的四原子分子 d.E在常温下是无色液体
e.往含
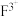 的溶液中滴加含
的溶液中滴加含 的溶液至过量,先有白色沉淀生成,后沉淀消失
的溶液至过量,先有白色沉淀生成,后沉淀消失①D的空间构型为
②上述粒子中所含元素原子的第一电离能由大到小的顺序为
③用电子式表示
 的形成过程
的形成过程④与C组成元素相同且含18个电子的分子M中,孤电子对与
 键的数目之比为
键的数目之比为
您最近一年使用:0次
名校
解题方法
8 . 2021年7月4日,“神舟十二号”航天员圆满完成出舱任务。“神舟十二号”制作材料中包含了 、
、 、
、 、
、 等多种元素。回答下列问题:
等多种元素。回答下列问题:
(1) 元素基态原子的外围电子排布式为
元素基态原子的外围电子排布式为___________ , 、
、 、
、 三种元素的第一电离能由大到小的顺序为
三种元素的第一电离能由大到小的顺序为___________ 。
(2) 位于元素周期表的
位于元素周期表的___________ (填“s”、“p”、“d”或“ds”)区, 催化烯烃硝化反应过程中会产生
催化烯烃硝化反应过程中会产生 。键角:
。键角:
___________  (填“<”或“>”),判断依据是
(填“<”或“>”),判断依据是___________ 。
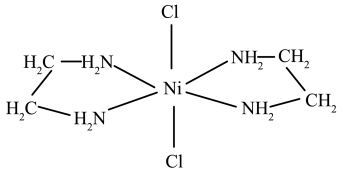
(3)含有两个或两个以上配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物称为螯合物。 的一种螯合物结构如图所示,
的一种螯合物结构如图所示, 该配合物中通过鳌合作用形成的配位键有
该配合物中通过鳌合作用形成的配位键有___________ 个,该整合物中C的杂化方式为___________ 。
 、
、 、
、 、
、 等多种元素。回答下列问题:
等多种元素。回答下列问题:
(1)
 元素基态原子的外围电子排布式为
元素基态原子的外围电子排布式为 、
、 、
、 三种元素的第一电离能由大到小的顺序为
三种元素的第一电离能由大到小的顺序为(2)
 位于元素周期表的
位于元素周期表的 催化烯烃硝化反应过程中会产生
催化烯烃硝化反应过程中会产生 。键角:
。键角:
 (填“<”或“>”),判断依据是
(填“<”或“>”),判断依据是(3)含有两个或两个以上配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物称为螯合物。
 的一种螯合物结构如图所示,
的一种螯合物结构如图所示, 该配合物中通过鳌合作用形成的配位键有
该配合物中通过鳌合作用形成的配位键有
您最近一年使用:0次
名校
解题方法
9 . 铜元素是重要的金属元素,例如:黄铜矿(主要成分为 )是一种天然矿石;钡和铜的硅酸盐(
)是一种天然矿石;钡和铜的硅酸盐(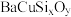 )可以人工合成“中国蓝”“中国紫”颜料。请回答下列问题:
)可以人工合成“中国蓝”“中国紫”颜料。请回答下列问题:
(1)基态Cu的价层电子排布式为___________ 。
(2)“中国蓝”“中国紫”中存在 ,其中Si原子采取的杂化类型为
,其中Si原子采取的杂化类型为___________ ;与 互为等电子体的离子是
互为等电子体的离子是___________ (写出一种化学式即可)。
(3)Si和C同主族,但 与
与 的熔沸点差异很大的原因为
的熔沸点差异很大的原因为___________ 。
(4) 在氨水溶液中可以形成
在氨水溶液中可以形成 ,
, 中含有的σ键数目为
中含有的σ键数目为___________ ;配体分子 键角大于
键角大于 的原因为
的原因为___________ 。
(5)四方晶系的 晶胞结构如图所示。
晶胞结构如图所示。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图中原子1的坐标为( ,
, ,
, ),则原子2的坐标为
),则原子2的坐标为___________ 。晶体中距离Fe最近的S有___________ 个。
②设阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为___________  (列出计算式即可)。
(列出计算式即可)。
 )是一种天然矿石;钡和铜的硅酸盐(
)是一种天然矿石;钡和铜的硅酸盐(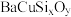 )可以人工合成“中国蓝”“中国紫”颜料。请回答下列问题:
)可以人工合成“中国蓝”“中国紫”颜料。请回答下列问题:(1)基态Cu的价层电子排布式为
(2)“中国蓝”“中国紫”中存在
 ,其中Si原子采取的杂化类型为
,其中Si原子采取的杂化类型为 互为等电子体的离子是
互为等电子体的离子是(3)Si和C同主族,但
 与
与 的熔沸点差异很大的原因为
的熔沸点差异很大的原因为(4)
 在氨水溶液中可以形成
在氨水溶液中可以形成 ,
, 中含有的σ键数目为
中含有的σ键数目为 键角大于
键角大于 的原因为
的原因为(5)四方晶系的
 晶胞结构如图所示。
晶胞结构如图所示。
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图中原子1的坐标为(
 ,
, ,
, ),则原子2的坐标为
),则原子2的坐标为②设阿伏加德罗常数的值为
 ,则该晶体的密度为
,则该晶体的密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
解题方法
10 . 过渡金属及其化合物在生产、生活中有重要的应用。
回答下列问题:
(1)基态Cu的价电子轨道表达式为___________ 。
(2)一种含Ti的催化剂X能催化乙烯、丙烯等的聚合,其结构如图甲所示。X中,C原子的杂化类型有___________ ,不含有的作用力类型是___________ (填序号)。

A. 键 B.
键 B. 键 C.配位键 D.离子键 E.共价键
键 C.配位键 D.离子键 E.共价键
(3)分子中的大 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数。
键的电子数。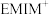 子由H、C、N三种元素组成,其结构如图乙所示,则
子由H、C、N三种元素组成,其结构如图乙所示,则 离子中的大
离子中的大 键应表示为
键应表示为___________ 。

(4)已知第三电离能数据: ,
,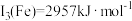 。锰的第三电离能大于铁的第三电离能,其主要原因是
。锰的第三电离能大于铁的第三电离能,其主要原因是___________ 。
(5)黄铜矿是提炼铜的主要原料,其主要成分的晶胞结构如图丙所示。

① 周围距离最近的
周围距离最近的 数为
数为___________ 。
②在高温下,黄铜矿的主要成分的晶体中金属离子可以发生迁移。若亚铁离子与铜离子发生完全无序的置换,可将它们视作等同的金属离子,在无序的高温型结构中,金属离子占据___________ (填“四面体空隙”或“八面体空隙”)。
③该晶胞上下底面均为正方形,侧面与底面垂直,晶胞参数如图所示,设NA为阿伏加德罗常数的值,请计算该晶体的密度
___________  。
。
回答下列问题:
(1)基态Cu的价电子轨道表达式为
(2)一种含Ti的催化剂X能催化乙烯、丙烯等的聚合,其结构如图甲所示。X中,C原子的杂化类型有

A.
 键 B.
键 B. 键 C.配位键 D.离子键 E.共价键
键 C.配位键 D.离子键 E.共价键(3)分子中的大
 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数。
键的电子数。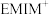 子由H、C、N三种元素组成,其结构如图乙所示,则
子由H、C、N三种元素组成,其结构如图乙所示,则 离子中的大
离子中的大 键应表示为
键应表示为
(4)已知第三电离能数据:
 ,
,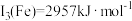 。锰的第三电离能大于铁的第三电离能,其主要原因是
。锰的第三电离能大于铁的第三电离能,其主要原因是(5)黄铜矿是提炼铜的主要原料,其主要成分的晶胞结构如图丙所示。

①
 周围距离最近的
周围距离最近的 数为
数为②在高温下,黄铜矿的主要成分的晶体中金属离子可以发生迁移。若亚铁离子与铜离子发生完全无序的置换,可将它们视作等同的金属离子,在无序的高温型结构中,金属离子占据
③该晶胞上下底面均为正方形,侧面与底面垂直,晶胞参数如图所示,设NA为阿伏加德罗常数的值,请计算该晶体的密度

 。
。
您最近一年使用:0次



