名校
解题方法
1 . X、Y、Z、R、W为前四周期元素,且原子序数依次增大。YZ2是红棕色气体,X、Y形成YX3,基态R原子M层与K层电子数相等,W2+的3d轨道中有9个电子,上述元素中仅有Y、Z位于同一周期。回答下列问题;
(1)基态R原子的价层轨道表示式为___________ ,
(2) 的空间结构为
的空间结构为___________ ,其中心原子的杂化方式为___________ 。
(3)稳定性:Y2___________ (填“>”、“<”或“=”)Z2,原因为___________ 。
(4)仅由X、Y两种元素可形成18电子的分子,该分子为___________ (填化学式)。
(5)仅由X、Y、Z三种元素可形成一种离子化合物,该化合物所含共价键的类型有___________ 。
(6)将W单质的粉末加入YX3的浓溶液,通入Z2,充分反应后溶液呈深蓝色,该反应的离子方程式为___________ ,从结构的角度,解释该反应可以发生的原因:___________ 。
(1)基态R原子的价层轨道表示式为
(2)
 的空间结构为
的空间结构为(3)稳定性:Y2
(4)仅由X、Y两种元素可形成18电子的分子,该分子为
(5)仅由X、Y、Z三种元素可形成一种离子化合物,该化合物所含共价键的类型有
(6)将W单质的粉末加入YX3的浓溶液,通入Z2,充分反应后溶液呈深蓝色,该反应的离子方程式为
您最近一年使用:0次
名校
解题方法
2 .  是一种常见催化剂,能催化臭氧(
是一种常见催化剂,能催化臭氧( )与烟气(
)与烟气( 、
、 )的反应。回答下列问题:
)的反应。回答下列问题:
(1)写出 和
和 原子基态价电子排布式:
原子基态价电子排布式:___________ 、___________ 。
(2) 和
和 的中心原子轨道的杂化类型为
的中心原子轨道的杂化类型为___________ 、___________ 。
(3) 和
和 中所含元素的第一电离能由大到小的顺序是
中所含元素的第一电离能由大到小的顺序是___________ 。两种微粒的空间构型分别为___________ 、___________ 。
(4) 与
与 生成的
生成的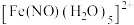 ,画出生成的
,画出生成的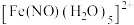 的结构简式,并用“
的结构简式,并用“ ”标出所有配位键:
”标出所有配位键:___________ 。
(5)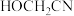 分子中含有的
分子中含有的 键和
键和 键的数目之比为
键的数目之比为___________ 。
(6)一种可吸收甲醛材料,其化学式为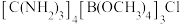 ,部分晶体结构如下图所示:
,部分晶体结构如下图所示: 为平面结构。
为平面结构。
①该材料包含的化学键类型有___________ 。
②组成该材料的 三元素的电负性由大到小的顺序是
三元素的电负性由大到小的顺序是___________ 。
(7)某高温超导材料,其晶胞结构如图所示,该立方晶胞参数为apm。阿伏加德罗常数的值为 。
。___________ 。
②该晶体的密度为___________ 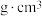 。
。
 是一种常见催化剂,能催化臭氧(
是一种常见催化剂,能催化臭氧( )与烟气(
)与烟气( 、
、 )的反应。回答下列问题:
)的反应。回答下列问题:(1)写出
 和
和 原子基态价电子排布式:
原子基态价电子排布式:(2)
 和
和 的中心原子轨道的杂化类型为
的中心原子轨道的杂化类型为(3)
 和
和 中所含元素的第一电离能由大到小的顺序是
中所含元素的第一电离能由大到小的顺序是(4)
 与
与 生成的
生成的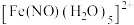 ,画出生成的
,画出生成的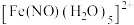 的结构简式,并用“
的结构简式,并用“ ”标出所有配位键:
”标出所有配位键:(5)
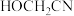 分子中含有的
分子中含有的 键和
键和 键的数目之比为
键的数目之比为(6)一种可吸收甲醛材料,其化学式为
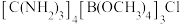 ,部分晶体结构如下图所示:
,部分晶体结构如下图所示: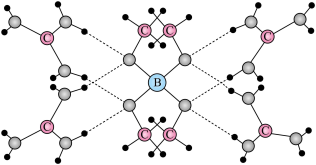
 为平面结构。
为平面结构。①该材料包含的化学键类型有
②组成该材料的
 三元素的电负性由大到小的顺序是
三元素的电负性由大到小的顺序是(7)某高温超导材料,其晶胞结构如图所示,该立方晶胞参数为apm。阿伏加德罗常数的值为
 。
。
②该晶体的密度为
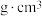 。
。
您最近一年使用:0次
3 . 结构决定性质是化学的基本原理,结构的细微差异会导致物质化学性质变化。回答下列问题:
(1) 是一种离子晶体,其中Au的化合价为
是一种离子晶体,其中Au的化合价为 ,晶体中的阳离子的离子符号为
,晶体中的阳离子的离子符号为______ ; 低温时生成一种暗红色粉末和两种气体,其中氧化性较强的气体的化学式为
低温时生成一种暗红色粉末和两种气体,其中氧化性较强的气体的化学式为______ 。金元素形成的部分离子氧化性很强,与“6s惰性电子对”效应有关,即失去6s电子对的离子会具有很强的氧化性。下列选项中具有此效应的离子是______ (填序号)。
A. B.
B. C.
C. D.
D.
(2)吡咯( )具有芳香性,分子中存在大
)具有芳香性,分子中存在大 键,1 mol吡咯分子中
键,1 mol吡咯分子中 键数目为
键数目为______ 。用氧原子(或硫原子)替代吡咯中的氮原子可以得到呋喃(或噻吩分子),则呋喃分子的键线式为______ ;分子结构中的大 键电子云分布越均匀,物质的芳香性越强,请比较噻吩和呋喃的芳香性并解释原因
键电子云分布越均匀,物质的芳香性越强,请比较噻吩和呋喃的芳香性并解释原因______ 。
(3)将钴氧化物和 按适量的比例混合,将混合物高温煅烧可得到钴蓝(过程中无化学变化),钴蓝可用于青花瓷的颜料。钴蓝晶体是由图甲所示的结构构成。图甲包含Ⅰ型和Ⅱ型两种小立方体。图乙是钴蓝的晶胞,已知该晶胞的顶点和面心为钴原子。
按适量的比例混合,将混合物高温煅烧可得到钴蓝(过程中无化学变化),钴蓝可用于青花瓷的颜料。钴蓝晶体是由图甲所示的结构构成。图甲包含Ⅰ型和Ⅱ型两种小立方体。图乙是钴蓝的晶胞,已知该晶胞的顶点和面心为钴原子。 的比例为
的比例为______ ;
②图乙所示字母中,Ⅰ型小立方体分别是a、______ (填字母符号)。
(1)
 是一种离子晶体,其中Au的化合价为
是一种离子晶体,其中Au的化合价为 ,晶体中的阳离子的离子符号为
,晶体中的阳离子的离子符号为 低温时生成一种暗红色粉末和两种气体,其中氧化性较强的气体的化学式为
低温时生成一种暗红色粉末和两种气体,其中氧化性较强的气体的化学式为A.
 B.
B. C.
C. D.
D.
(2)吡咯(
 )具有芳香性,分子中存在大
)具有芳香性,分子中存在大 键,1 mol吡咯分子中
键,1 mol吡咯分子中 键数目为
键数目为 键电子云分布越均匀,物质的芳香性越强,请比较噻吩和呋喃的芳香性并解释原因
键电子云分布越均匀,物质的芳香性越强,请比较噻吩和呋喃的芳香性并解释原因(3)将钴氧化物和
 按适量的比例混合,将混合物高温煅烧可得到钴蓝(过程中无化学变化),钴蓝可用于青花瓷的颜料。钴蓝晶体是由图甲所示的结构构成。图甲包含Ⅰ型和Ⅱ型两种小立方体。图乙是钴蓝的晶胞,已知该晶胞的顶点和面心为钴原子。
按适量的比例混合,将混合物高温煅烧可得到钴蓝(过程中无化学变化),钴蓝可用于青花瓷的颜料。钴蓝晶体是由图甲所示的结构构成。图甲包含Ⅰ型和Ⅱ型两种小立方体。图乙是钴蓝的晶胞,已知该晶胞的顶点和面心为钴原子。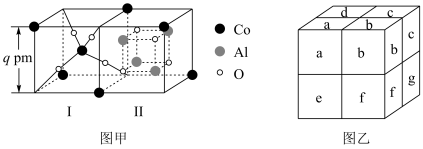
 的比例为
的比例为②图乙所示字母中,Ⅰ型小立方体分别是a、
您最近一年使用:0次
名校
解题方法
4 . 硼元素有“金属材料的维生素”之称,其单质及其化合物的研究在无机化学的发展中占有独特的地位。请回答下列问题:
(1)基态硼原子的电子排布式为:___________ 。
(2)硼的化合物 中氢元素化合价为-1,故而被称为“万能还原剂”,广泛用于有机合成。
中氢元素化合价为-1,故而被称为“万能还原剂”,广泛用于有机合成。 中所含元素电负性由大到小的顺序为:
中所含元素电负性由大到小的顺序为:___________ 。
(3) 与
与 可以通过配位键形成
可以通过配位键形成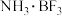 。
。
① 的空间构型为:
的空间构型为:___________ ,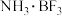 中硼原子的杂化方式为
中硼原子的杂化方式为___________ 。
② 的键角
的键角___________  的键角(填“大于”、“小于”或“等于”)。
的键角(填“大于”、“小于”或“等于”)。
(4)硼酸 晶体中单元结构如图1所示。各单元中的氧原子通过氢键连结成层状结构如图2所示,层与层之间以微弱的分子间力相结合构成整个硼酸晶体。
晶体中单元结构如图1所示。各单元中的氧原子通过氢键连结成层状结构如图2所示,层与层之间以微弱的分子间力相结合构成整个硼酸晶体。___________ 。
②1mol硼酸中含有氢键的数目为___________ 。
③ 在加热过程中会形成链状多硼酸根,其结构如图3所示。已知链状多硼酸根所有氧原子都达到8电子稳定结构,则含n个硼原子的多硼酸根可表示为
在加热过程中会形成链状多硼酸根,其结构如图3所示。已知链状多硼酸根所有氧原子都达到8电子稳定结构,则含n个硼原子的多硼酸根可表示为___________ 。
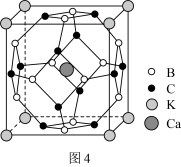
(5)科学家合成了一种含硼高温超导材料,其立方晶胞结构如图4所示。___________ 个面。
②已知晶胞边长为apm,阿伏加德罗常数为 ,则该晶体密度为
,则该晶体密度为___________  (用含
(用含 、a的式子表示,写出表达式即可)。
、a的式子表示,写出表达式即可)。
(1)基态硼原子的电子排布式为:
(2)硼的化合物
 中氢元素化合价为-1,故而被称为“万能还原剂”,广泛用于有机合成。
中氢元素化合价为-1,故而被称为“万能还原剂”,广泛用于有机合成。 中所含元素电负性由大到小的顺序为:
中所含元素电负性由大到小的顺序为:(3)
 与
与 可以通过配位键形成
可以通过配位键形成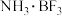 。
。①
 的空间构型为:
的空间构型为: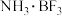 中硼原子的杂化方式为
中硼原子的杂化方式为②
 的键角
的键角 的键角(填“大于”、“小于”或“等于”)。
的键角(填“大于”、“小于”或“等于”)。(4)硼酸
 晶体中单元结构如图1所示。各单元中的氧原子通过氢键连结成层状结构如图2所示,层与层之间以微弱的分子间力相结合构成整个硼酸晶体。
晶体中单元结构如图1所示。各单元中的氧原子通过氢键连结成层状结构如图2所示,层与层之间以微弱的分子间力相结合构成整个硼酸晶体。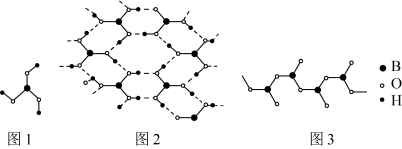
②1mol硼酸中含有氢键的数目为
③
 在加热过程中会形成链状多硼酸根,其结构如图3所示。已知链状多硼酸根所有氧原子都达到8电子稳定结构,则含n个硼原子的多硼酸根可表示为
在加热过程中会形成链状多硼酸根,其结构如图3所示。已知链状多硼酸根所有氧原子都达到8电子稳定结构,则含n个硼原子的多硼酸根可表示为(5)科学家合成了一种含硼高温超导材料,其立方晶胞结构如图4所示。
②已知晶胞边长为apm,阿伏加德罗常数为
 ,则该晶体密度为
,则该晶体密度为 (用含
(用含 、a的式子表示,写出表达式即可)。
、a的式子表示,写出表达式即可)。
您最近一年使用:0次
名校
5 . I.金属催化剂M(Co、Ni)催化硼氢化钠( )水解释放
)水解释放 机理如下图所示:
机理如下图所示:

(1)过程Ⅱ中形成化学键的类型有________(填序号)。
(2) 最终会转化为
最终会转化为 ,1个
,1个 中存在
中存在________ 个配位键。
(3) 是一种重要的还原剂,其组成元素的电负性由大到小的顺序为
是一种重要的还原剂,其组成元素的电负性由大到小的顺序为________ 。
Ⅱ.过渡金属Q与镧形成的合金是一种储氢材料,其中基态Q原子的价电子排布式为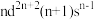 ,中子数为31,
,中子数为31,
(4)Q原子符号为________ ;基态Q原子核外成对电子数和未成对电子数之比为________ 。
Ⅲ. 、
、 是新型磁性材料的成分。依据其中有关元素回答问题:
是新型磁性材料的成分。依据其中有关元素回答问题:
(5)钕(Nd)属于镧系元素,则其在元素周期表中处于________ 区,Co元素在元素周期表中的位置________ 。
Ⅳ.分子式为 的化合物的结构如图,
的化合物的结构如图,
(6)其中B原子的杂化类型是________ ,B-B-B键的键角________ Cl-B-Cl的键角(填“ ”“
”“ ”或“
”或“ ”)。
”)。
 )水解释放
)水解释放 机理如下图所示:
机理如下图所示:
(1)过程Ⅱ中形成化学键的类型有________(填序号)。
| A.离子键 | B.金属键 | C.极性键 | D.非极性键 |
(2)
 最终会转化为
最终会转化为 ,1个
,1个 中存在
中存在(3)
 是一种重要的还原剂,其组成元素的电负性由大到小的顺序为
是一种重要的还原剂,其组成元素的电负性由大到小的顺序为Ⅱ.过渡金属Q与镧形成的合金是一种储氢材料,其中基态Q原子的价电子排布式为
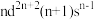 ,中子数为31,
,中子数为31,(4)Q原子符号为
Ⅲ.
 、
、 是新型磁性材料的成分。依据其中有关元素回答问题:
是新型磁性材料的成分。依据其中有关元素回答问题:(5)钕(Nd)属于镧系元素,则其在元素周期表中处于
Ⅳ.分子式为
 的化合物的结构如图,
的化合物的结构如图,
(6)其中B原子的杂化类型是
 ”“
”“ ”或“
”或“ ”)。
”)。
您最近一年使用:0次
6 . 镁 可用作轻质合金,在航天器材与光学设备的生产制造方面有重要应用。回答下列问题:
可用作轻质合金,在航天器材与光学设备的生产制造方面有重要应用。回答下列问题:
(1)基态 原子的核外电子有
原子的核外电子有_______ 种空间运动状态,在元素周期表中, 和
和 均与
均与 相邻,这三种元素第一电离能由大到小的顺序是
相邻,这三种元素第一电离能由大到小的顺序是_______ 。
(2) 可用于
可用于 的冶炼:
的冶炼: ,基态
,基态 的价电子排布图(轨道表示式)为
的价电子排布图(轨道表示式)为_______ , 的熔点
的熔点 比
比 (714
(714 )低,其原因是
)低,其原因是_______ 。
(3)大黄素的分子结构如图所示,其中碳原子的杂化轨道类型是_______ ,分子中至少有_______ 个原子共平面,一定条件下,大黄素分子中的_______ 原子能提供孤对电子与 形成配位键。
形成配位键。 和
和 三种元素组成的晶体
三种元素组成的晶体 ,其立方晶胞如图,
,其立方晶胞如图, 与
与 的最小核间距大于
的最小核间距大于 与
与 的最小核间距,
的最小核间距, 与
与 为整数,则
为整数,则 在晶胞中的位置为
在晶胞中的位置为_______ , 的配位数是
的配位数是_______ ,若晶胞参数为 ,则晶体密度
,则晶体密度
_______  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
 可用作轻质合金,在航天器材与光学设备的生产制造方面有重要应用。回答下列问题:
可用作轻质合金,在航天器材与光学设备的生产制造方面有重要应用。回答下列问题:(1)基态
 原子的核外电子有
原子的核外电子有 和
和 均与
均与 相邻,这三种元素第一电离能由大到小的顺序是
相邻,这三种元素第一电离能由大到小的顺序是(2)
 可用于
可用于 的冶炼:
的冶炼: ,基态
,基态 的价电子排布图(轨道表示式)为
的价电子排布图(轨道表示式)为 的熔点
的熔点 比
比 (714
(714 )低,其原因是
)低,其原因是(3)大黄素的分子结构如图所示,其中碳原子的杂化轨道类型是
 形成配位键。
形成配位键。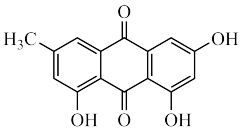
 和
和 三种元素组成的晶体
三种元素组成的晶体 ,其立方晶胞如图,
,其立方晶胞如图, 与
与 的最小核间距大于
的最小核间距大于 与
与 的最小核间距,
的最小核间距, 与
与 为整数,则
为整数,则 在晶胞中的位置为
在晶胞中的位置为 的配位数是
的配位数是 ,则晶体密度
,则晶体密度
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
解题方法
7 . 国产大飞机C919的制造使用了较多含硼材料(如硼纤维、氮化硼等),多项技术打破了外国垄断。
(1)立方氮化硼硬度大,熔点为3000℃,其晶体类型为___________ 。
(2)耐高温材料立方BN制备流程中用到NH3、BCl3和触媒剂Ca3B2N4。
①Ca、B、N三种元素电负性从大到小的顺序为___________ 。
②BCl3中B原子的___________ 轨道与Cl原子的___________ 轨道形成 键;形成BCl3过程中,基态B原子价电子层上的电子先激发,再杂化,激发后B原子的价电子轨道表示式为
键;形成BCl3过程中,基态B原子价电子层上的电子先激发,再杂化,激发后B原子的价电子轨道表示式为___________ 。
③BCl3在四氯化碳中的溶解度远大于NH3,原因是___________ 。
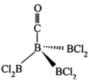
(3)近年来硼氢类离子液体作为火箭推进剂燃料得到了广泛使用。该化合物(如图所示)中不存在的作用力有___________ (填字母)。 键 E.
键 E. 键 F.氢键
键 F.氢键
(4)硼化钙晶胞结构如图所示,B原子构成B6,正八面体,各个顶点通过B-B键互相连接成三维骨架,八个B6多面体围成立方体,中心为Ca。硼化钙的化学式为___________ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。已知Ca原子的分数坐标为(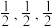 ),B6正八面体中B-B键的键长为r pm,晶胞参数为a pm,则A点原子的分数坐标为
),B6正八面体中B-B键的键长为r pm,晶胞参数为a pm,则A点原子的分数坐标为___________ 。
(1)立方氮化硼硬度大,熔点为3000℃,其晶体类型为
(2)耐高温材料立方BN制备流程中用到NH3、BCl3和触媒剂Ca3B2N4。
①Ca、B、N三种元素电负性从大到小的顺序为
②BCl3中B原子的
 键;形成BCl3过程中,基态B原子价电子层上的电子先激发,再杂化,激发后B原子的价电子轨道表示式为
键;形成BCl3过程中,基态B原子价电子层上的电子先激发,再杂化,激发后B原子的价电子轨道表示式为③BCl3在四氯化碳中的溶解度远大于NH3,原因是
(3)近年来硼氢类离子液体作为火箭推进剂燃料得到了广泛使用。该化合物(如图所示)中不存在的作用力有

 键 E.
键 E. 键 F.氢键
键 F.氢键(4)硼化钙晶胞结构如图所示,B原子构成B6,正八面体,各个顶点通过B-B键互相连接成三维骨架,八个B6多面体围成立方体,中心为Ca。硼化钙的化学式为
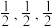 ),B6正八面体中B-B键的键长为r pm,晶胞参数为a pm,则A点原子的分数坐标为
),B6正八面体中B-B键的键长为r pm,晶胞参数为a pm,则A点原子的分数坐标为
您最近一年使用:0次
解题方法
8 . 回答下列问题。
(1)白磷(P4)在氯气中燃烧可生成 PCl3 和 PCl5。
①形成 PCl5时,P 原子的一个 3s 电子激发入 3d 轨道后参与成键,该激发态的价电子排布式为___________ 。
②研究表明,在加压条件下 PCl5 于 148℃液化时能发生与水类似的自偶电离,形成一种能导电的熔体,其电离方程式为___________ ,产生的阳离子的空间结构形状为___________ 。
(2)分子中的大π键可用符号 表示,其中 m 代表参与形成大π键的原子数,n 代表参与形成大键的电子数(如苯分子中的大π键可表示为
表示,其中 m 代表参与形成大π键的原子数,n 代表参与形成大键的电子数(如苯分子中的大π键可表示为 )。一种观点认为,苯酚羟基中的 O 原子是 sp2 杂化则苯酚中的大π键可表示为
)。一种观点认为,苯酚羟基中的 O 原子是 sp2 杂化则苯酚中的大π键可表示为___________ ,一定在同一平面上的原子有___________ 个。乙醇显中性而苯酚显酸性的原因是:___________ 。
(3)硫化锌精矿是冶炼金属锌的主要原料,六方硫化锌(纤锌矿型)的平行六面体晶胞如图 2 所示,晶体中正负离子的配位数之比为___________ 。___________ g•cm-3。
(1)白磷(P4)在氯气中燃烧可生成 PCl3 和 PCl5。
①形成 PCl5时,P 原子的一个 3s 电子激发入 3d 轨道后参与成键,该激发态的价电子排布式为
②研究表明,在加压条件下 PCl5 于 148℃液化时能发生与水类似的自偶电离,形成一种能导电的熔体,其电离方程式为
(2)分子中的大π键可用符号
 表示,其中 m 代表参与形成大π键的原子数,n 代表参与形成大键的电子数(如苯分子中的大π键可表示为
表示,其中 m 代表参与形成大π键的原子数,n 代表参与形成大键的电子数(如苯分子中的大π键可表示为 )。一种观点认为,苯酚羟基中的 O 原子是 sp2 杂化则苯酚中的大π键可表示为
)。一种观点认为,苯酚羟基中的 O 原子是 sp2 杂化则苯酚中的大π键可表示为(3)硫化锌精矿是冶炼金属锌的主要原料,六方硫化锌(纤锌矿型)的平行六面体晶胞如图 2 所示,晶体中正负离子的配位数之比为


您最近一年使用:0次
名校
解题方法
9 . 钠是一种活泼金属,其单质及化合物在科研、生产中有重要的作用。
(1)基态钠原子核外电子的空间运动状态有___________ 种。
(2)冰晶石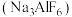 是铝电解的助熔剂,其晶胞与氯化钠的晶胞结构相似(如图所示),
是铝电解的助熔剂,其晶胞与氯化钠的晶胞结构相似(如图所示),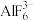 占据的位置相当于氯化钠晶胞中
占据的位置相当于氯化钠晶胞中 占据的位置。
占据的位置。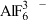 是正八面体结构,中心原子的杂化方式是
是正八面体结构,中心原子的杂化方式是___________ (填字母)。
A. B.
B. C.
C. D.
D.
② 晶体中存在的作用力有
晶体中存在的作用力有___________ (填字母)。
A.非极性共价键 B.配位键 C.范德华力 D.离子键
(3) 与
与 均为第三周期元素,
均为第三周期元素, 熔点明显高于
熔点明显高于 ,其原因是
,其原因是___________ 。
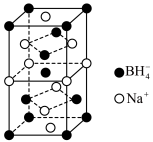
(4)硼氢化钠是一种常用的还原剂和催化剂。硼氢化钠的晶胞结构如图所示。 ,硼氢化钠溶于水的化学方程式为
,硼氢化钠溶于水的化学方程式为___________ ,硼氢化钠晶胞中与 紧邻的
紧邻的 个数是
个数是___________ 。
(5)有研究表明,在超高压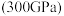 下,金属钠和氦之间可形成化合物电子盐(即电子是阴离子),在这一结构中,钠离子主要是按照简单立方排列的(如图1),并且形成
下,金属钠和氦之间可形成化合物电子盐(即电子是阴离子),在这一结构中,钠离子主要是按照简单立方排列的(如图1),并且形成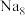 立方体空隙,电子对(2e-)和氦原子交替分布填充在立方体的中心。晶体结构俯视图如图2所示:
立方体空隙,电子对(2e-)和氦原子交替分布填充在立方体的中心。晶体结构俯视图如图2所示: 的最短距离为
的最短距离为___________  (用含a的代数式表示)。
(用含a的代数式表示)。
(1)基态钠原子核外电子的空间运动状态有
(2)冰晶石
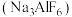 是铝电解的助熔剂,其晶胞与氯化钠的晶胞结构相似(如图所示),
是铝电解的助熔剂,其晶胞与氯化钠的晶胞结构相似(如图所示),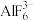 占据的位置相当于氯化钠晶胞中
占据的位置相当于氯化钠晶胞中 占据的位置。
占据的位置。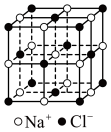
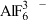 是正八面体结构,中心原子的杂化方式是
是正八面体结构,中心原子的杂化方式是A.
 B.
B. C.
C. D.
D.
②
 晶体中存在的作用力有
晶体中存在的作用力有A.非极性共价键 B.配位键 C.范德华力 D.离子键
(3)
 与
与 均为第三周期元素,
均为第三周期元素, 熔点明显高于
熔点明显高于 ,其原因是
,其原因是(4)硼氢化钠是一种常用的还原剂和催化剂。硼氢化钠的晶胞结构如图所示。
 ,硼氢化钠溶于水的化学方程式为
,硼氢化钠溶于水的化学方程式为 紧邻的
紧邻的 个数是
个数是(5)有研究表明,在超高压
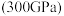 下,金属钠和氦之间可形成化合物电子盐(即电子是阴离子),在这一结构中,钠离子主要是按照简单立方排列的(如图1),并且形成
下,金属钠和氦之间可形成化合物电子盐(即电子是阴离子),在这一结构中,钠离子主要是按照简单立方排列的(如图1),并且形成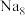 立方体空隙,电子对(2e-)和氦原子交替分布填充在立方体的中心。晶体结构俯视图如图2所示:
立方体空隙,电子对(2e-)和氦原子交替分布填充在立方体的中心。晶体结构俯视图如图2所示: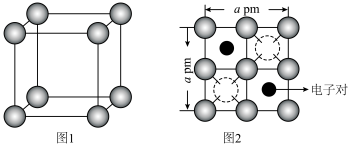
 的最短距离为
的最短距离为 (用含a的代数式表示)。
(用含a的代数式表示)。
您最近一年使用:0次
解题方法
10 . 金属铍在原子能、航空航天、火箭制造等领域有广泛应用。
(1)下列状态的铍中,电离最外层一个电子所需能量最小的是___________(填标号)。
(2) 能以单体、多聚体等形式存在。单体
能以单体、多聚体等形式存在。单体 的
的 模型名称为
模型名称为___________ ;多聚体 为链状结构,所有原子均满足
为链状结构,所有原子均满足 稳定结构,中心原子的杂化方式是
稳定结构,中心原子的杂化方式是___________ ; 晶体的熔点
晶体的熔点___________ (填“高于”或“低于”) 晶体,其原因是
晶体,其原因是___________ 。
(3)碳酸铍与醋酸反应生成了一种配合物分子 (结构如图1),每个
(结构如图1),每个 位于4个
位于4个 形成的四面体中,
形成的四面体中, 与
与 形成的化学键可全部看成配位键。
形成的化学键可全部看成配位键。___________ 。
② 中含有
中含有___________  配位键。
配位键。
(4)非线性光学材料氟代硼铍酸钾 具有重大战略价值。已知其属于四方晶系,晶胞结构如图2所示(氧原子未画出,晶胞参数
具有重大战略价值。已知其属于四方晶系,晶胞结构如图2所示(氧原子未画出,晶胞参数 )。一定条件下,
)。一定条件下, 和
和 发生非氧化还原反应生成氟代硼铍酸钾,并放出
发生非氧化还原反应生成氟代硼铍酸钾,并放出 气体。
气体。
氟代硼铍酸钾的化学式为___________ ;晶体的密度为___________  为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)下列状态的铍中,电离最外层一个电子所需能量最小的是___________(填标号)。
A. | B. | C. | D. |
(2)
 能以单体、多聚体等形式存在。单体
能以单体、多聚体等形式存在。单体 的
的 模型名称为
模型名称为 为链状结构,所有原子均满足
为链状结构,所有原子均满足 稳定结构,中心原子的杂化方式是
稳定结构,中心原子的杂化方式是 晶体的熔点
晶体的熔点 晶体,其原因是
晶体,其原因是(3)碳酸铍与醋酸反应生成了一种配合物分子
 (结构如图1),每个
(结构如图1),每个 位于4个
位于4个 形成的四面体中,
形成的四面体中, 与
与 形成的化学键可全部看成配位键。
形成的化学键可全部看成配位键。
②
 中含有
中含有 配位键。
配位键。(4)非线性光学材料氟代硼铍酸钾
 具有重大战略价值。已知其属于四方晶系,晶胞结构如图2所示(氧原子未画出,晶胞参数
具有重大战略价值。已知其属于四方晶系,晶胞结构如图2所示(氧原子未画出,晶胞参数 )。一定条件下,
)。一定条件下, 和
和 发生非氧化还原反应生成氟代硼铍酸钾,并放出
发生非氧化还原反应生成氟代硼铍酸钾,并放出 气体。
气体。氟代硼铍酸钾的化学式为
 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次



