名校
1 . 锌在生产生活中应用广泛,同时,锌也是人体必需的微量元素之一,起着极其重要的作用。
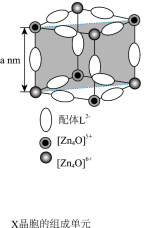
(1)配位化合物X由配体L2-(如图)和具有正四面体结构的[Zn4O]6+构成。_______ 。
②L2-所含元素中,第一电离能从小到大的顺序为_______ ;每个L2-中采取sp2杂化的C原子数目为_______ 个。
③X晶体内部空腔可吸附小分子,要增强X与H2O的吸附作用,可在L2-上引入_______ 。(假设X晶胞形状不变)。
A.-Cl B.-OH C.-NH2 D.-CH3
④X晶体具有面心立方结构,其晶胞由8个结构相似的组成单元(如图)构成。_______ g•cm-3(列出化简的计算式)。
(2)复兴号高铁车体材质用到Zn、Co等元素,已知r(Co2+) =65 pm,r(Zn2+) =74 pm,推测ZnCO3比CoCO3的分解温度_______ (填“高”或“低”),解释原因:_______ 。
(3)H3PO3和H3AsO3的形式一样,但酸性强弱相差很大。已知H3PO3为中强酸,H3AsO3为弱酸,试推断H3PO3和H3AsO3的分子结构_______ 。
(1)配位化合物X由配体L2-(如图)和具有正四面体结构的[Zn4O]6+构成。

②L2-所含元素中,第一电离能从小到大的顺序为
③X晶体内部空腔可吸附小分子,要增强X与H2O的吸附作用,可在L2-上引入
A.-Cl B.-OH C.-NH2 D.-CH3
④X晶体具有面心立方结构,其晶胞由8个结构相似的组成单元(如图)构成。
(2)复兴号高铁车体材质用到Zn、Co等元素,已知r(Co2+) =65 pm,r(Zn2+) =74 pm,推测ZnCO3比CoCO3的分解温度
(3)H3PO3和H3AsO3的形式一样,但酸性强弱相差很大。已知H3PO3为中强酸,H3AsO3为弱酸,试推断H3PO3和H3AsO3的分子结构
您最近一年使用:0次
名校
解题方法
2 . 卤素可形成许多结构和性质特殊的化合物。回答下列问题:
(1)下列说法正确的是___________。
(2)ClO2中心原子为Cl,Cl2O中心原子为O,二者均为V形结构,但ClO2中存在大π键(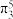 ),ClO2中Cl原子的轨道杂化方式
),ClO2中Cl原子的轨道杂化方式___________ ;O-Cl-O键角___________ Cl-O-Cl键角(填“>”“<”或“=”)。比较ClO2与Cl2O中Cl-O键的键长并说明原因___________ 。
(3)470K时,F2与Cl2反应生成ClF,常温常压下,ClF为无色气体,固态ClF的晶体类型为___________ 。
(4)一定条件下,CuCl2、K和F2反应生成KCl和化合物X。已知X属于四方晶系,晶胞结构如图所示(晶胞参数 ,
,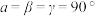 ),其中Cu化合价为+2。上述反应中K和F2的物质的量之比为
),其中Cu化合价为+2。上述反应中K和F2的物质的量之比为___________ 。与Cu原子距离最近的F原子的数目为___________ ,若该化合物的密度为 ,则阿伏加徳罗常数的值NA=
,则阿伏加徳罗常数的值NA=___________ (用含 、a、c的代数式表示。
、a、c的代数式表示。
(1)下列说法正确的是___________。
A.能量最低的激发态F原子的电子排布图为: |
| B.化学键中离子键成分的百分数:CaF2>LiF>NaF |
| C.HF的沸点比H2O低是因为HF氢键的键能小于H2O |
| D.已知N—F键的极性比N—H的极性强,因此NF3分子的极性比NH3的极性弱 |
(2)ClO2中心原子为Cl,Cl2O中心原子为O,二者均为V形结构,但ClO2中存在大π键(
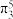 ),ClO2中Cl原子的轨道杂化方式
),ClO2中Cl原子的轨道杂化方式(3)470K时,F2与Cl2反应生成ClF,常温常压下,ClF为无色气体,固态ClF的晶体类型为
(4)一定条件下,CuCl2、K和F2反应生成KCl和化合物X。已知X属于四方晶系,晶胞结构如图所示(晶胞参数
 ,
,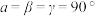 ),其中Cu化合价为+2。上述反应中K和F2的物质的量之比为
),其中Cu化合价为+2。上述反应中K和F2的物质的量之比为 ,则阿伏加徳罗常数的值NA=
,则阿伏加徳罗常数的值NA= 、a、c的代数式表示。
、a、c的代数式表示。
您最近一年使用:0次
3 . 芯片作为科技产业,以及信息化、数字化的基础,一直倍受关注。芯片制造会经过六个最为关键的步骤;沉积、光刻胶涂覆、光刻、刻蚀、离子注入和封装。
(1)“沉积”是将导体、绝缘体或半导体材料薄膜沉积到纯硅晶圆上。GaN、GaAs是制造芯片的新型半导体材料。___________ 。
②GaN、GaP、GaAs熔融状态均不导电,据此判断它们是___________ 化合物。它们的晶体结构与金刚石相似,试分析GaN、GaP、GaAs熔点由大到小的顺序为___________ 。
③GaAs的晶体结构如图甲(白色球为Ga原子)所示,1molGaAs中配位键的数目为___________ 。
(2)“光刻胶涂覆”中用到一种701紫外正型光刻胶,结构如图乙所示,其S原子的杂化方式为___________ 。

(3)“光刻”时,紫外负型光刻胶常含有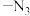 (叠氮基),在紫外光下可以形成阴离子
(叠氮基),在紫外光下可以形成阴离子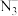 ,
,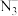 的等电子体有
的等电子体有___________ (填化学式,写出一种即可),其空间构型为___________ 。
(4)“刻蚀”过程可能用到刻蚀剂HF, 及清洗剂
及清洗剂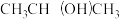 ,三种物质中属于第二周期的元素电负性由大到小的顺序为
,三种物质中属于第二周期的元素电负性由大到小的顺序为___________ 。氢氟酸是弱酸,在水溶液中存在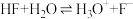 ,
,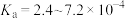 ,但当HF的浓度大于5mol/L时,氢氟酸是一种相当强的酸,请解释原因:
,但当HF的浓度大于5mol/L时,氢氟酸是一种相当强的酸,请解释原因:___________ 。
(5)LiF晶体结构属于氯化钠型,LiF晶体的密度约为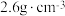 ,LiF晶胞体积V=
,LiF晶胞体积V=___________ cm-3。(列出计算式,设阿伏加德罗常数的值为 )
)
(1)“沉积”是将导体、绝缘体或半导体材料薄膜沉积到纯硅晶圆上。GaN、GaAs是制造芯片的新型半导体材料。

②GaN、GaP、GaAs熔融状态均不导电,据此判断它们是
③GaAs的晶体结构如图甲(白色球为Ga原子)所示,1molGaAs中配位键的数目为
(2)“光刻胶涂覆”中用到一种701紫外正型光刻胶,结构如图乙所示,其S原子的杂化方式为

(3)“光刻”时,紫外负型光刻胶常含有
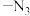 (叠氮基),在紫外光下可以形成阴离子
(叠氮基),在紫外光下可以形成阴离子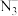 ,
,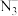 的等电子体有
的等电子体有(4)“刻蚀”过程可能用到刻蚀剂HF,
 及清洗剂
及清洗剂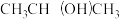 ,三种物质中属于第二周期的元素电负性由大到小的顺序为
,三种物质中属于第二周期的元素电负性由大到小的顺序为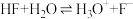 ,
,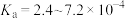 ,但当HF的浓度大于5mol/L时,氢氟酸是一种相当强的酸,请解释原因:
,但当HF的浓度大于5mol/L时,氢氟酸是一种相当强的酸,请解释原因:(5)LiF晶体结构属于氯化钠型,LiF晶体的密度约为
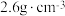 ,LiF晶胞体积V=
,LiF晶胞体积V= )
)
您最近一年使用:0次
解题方法
4 . 第二周期非金属元素的单质及其化合物是生命活动的重要物质基础。请回答:
(1)下列说法正确的是_______。
(2)有机物转化及相应产率: ,所有有机物中碳原子的杂化方式为
,所有有机物中碳原子的杂化方式为_______ ,后者产物的产率低的原因是_______ 。
(3)当负电荷位于电负性大的原子时,结构较稳定。 结合
结合 ,通过电子转移可得到下列粒子,稳定性最弱的粒子是_______。
,通过电子转移可得到下列粒子,稳定性最弱的粒子是_______。
(4)某新型电池的正极材料由F、K、Ni三种元素组成,其晶胞如图所示:

①基态Ni的核外电子排布式为_______ 。
②K与F间的化学键的离子键百分率_______ Ni与F间的化学键(选填“大于”或“小于”)。
③该材料中,Ni元素的化合价为_______ 。
(1)下列说法正确的是_______。
A. 三种分子的键角逐渐减小 三种分子的键角逐渐减小 |
| B.第二周期非金属元素的最高正价逐渐升高 |
C. 最外层电子排布为 最外层电子排布为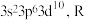 与硼元素同主族 与硼元素同主族 |
D.结合质子趋势: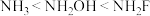 |
(2)有机物转化及相应产率:
 ,所有有机物中碳原子的杂化方式为
,所有有机物中碳原子的杂化方式为(3)当负电荷位于电负性大的原子时,结构较稳定。
 结合
结合 ,通过电子转移可得到下列粒子,稳定性最弱的粒子是_______。
,通过电子转移可得到下列粒子,稳定性最弱的粒子是_______。A. | B. | C. | D. |
(4)某新型电池的正极材料由F、K、Ni三种元素组成,其晶胞如图所示:

①基态Ni的核外电子排布式为
②K与F间的化学键的离子键百分率
③该材料中,Ni元素的化合价为
您最近一年使用:0次
解题方法
5 . ⅤA族元素有的是金属元素,有的是非金属元素,应用非常广泛。回答下列问题:
(1)基态P原子的价层电子排布式为_______ 。
(2)氮原子与碳原子形成六元环状结构,再通过相互连接形成层状“类石墨”晶体结构,有良好的光催化性能。如图是这种石墨相共价化合物的单层结构。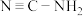 )为原料在不断加热条件下制得,其中双氰胺和三聚氰胺分别是加热至203℃和234℃时得到的中间产物,三聚氰胺的分子式为
)为原料在不断加热条件下制得,其中双氰胺和三聚氰胺分别是加热至203℃和234℃时得到的中间产物,三聚氰胺的分子式为_______ 。
②这种化合物中的氮原子与碳原子杂化方式是______ ,结构图空框中是晶体的末尾含氢 官能团,该官能团的结构简式为_______ 。
③下列有关这种化合物说法不正确 的是______ 。
A.两种结构相似的完美共价晶体熔点:氮化碳<氮化硅
B.激发态 原子可能的电子排布式为:
原子可能的电子排布式为: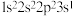
C.这种化合物每个六元环含有2个碳原子和2个氮原子
D.已知苯胺的碱性比氨弱,所以氨基氰的碱性也比氨弱
(3)立方氮化硼(CBN)晶体的极端条件性能稳定,是理想的第三代半导体材料,其结构如图所示。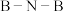 的键角为
的键角为______ 。
② 原子分数坐标为
原子分数坐标为 ,则原子
,则原子 的坐标为
的坐标为______ 。
(1)基态P原子的价层电子排布式为
(2)氮原子与碳原子形成六元环状结构,再通过相互连接形成层状“类石墨”晶体结构,有良好的光催化性能。如图是这种石墨相共价化合物的单层结构。

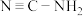 )为原料在不断加热条件下制得,其中双氰胺和三聚氰胺分别是加热至203℃和234℃时得到的中间产物,三聚氰胺的分子式为
)为原料在不断加热条件下制得,其中双氰胺和三聚氰胺分别是加热至203℃和234℃时得到的中间产物,三聚氰胺的分子式为②这种化合物中的氮原子与碳原子杂化方式是
③下列有关这种化合物说法
A.两种结构相似的完美共价晶体熔点:氮化碳<氮化硅
B.激发态
 原子可能的电子排布式为:
原子可能的电子排布式为: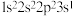
C.这种化合物每个六元环含有2个碳原子和2个氮原子
D.已知苯胺的碱性比氨弱,所以氨基氰的碱性也比氨弱
(3)立方氮化硼(CBN)晶体的极端条件性能稳定,是理想的第三代半导体材料,其结构如图所示。

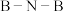 的键角为
的键角为②
 原子分数坐标为
原子分数坐标为 ,则原子
,则原子 的坐标为
的坐标为
您最近一年使用:0次
6 .  是一种钠离子电池正极材料,充、放电过程中正极材料立方晶胞示意图的组成变化如图所示,晶胞内未标出因放电产生的0价
是一种钠离子电池正极材料,充、放电过程中正极材料立方晶胞示意图的组成变化如图所示,晶胞内未标出因放电产生的0价 。
。 呈黄色,
呈黄色, 呈绿色,
呈绿色, 呈蓝色等;预测
呈蓝色等;预测 呈
呈_______ 色,原因是_______ 。
(2) 可以形成多种配合物,其中的甘氨酸铜对于预防和治疗贫血、骨质疏松等疾病具有一定的作用,它有顺式和反式两种同分异构体,结构如图。
可以形成多种配合物,其中的甘氨酸铜对于预防和治疗贫血、骨质疏松等疾病具有一定的作用,它有顺式和反式两种同分异构体,结构如图。_______ (填“ ”或“
”或“ ”)。
”)。
(3)充电时,每个 晶胞完全转化为
晶胞完全转化为 晶胞。每个
晶胞。每个 晶胞中
晶胞中 个数为
个数为_______ (用含 的代数式作答)。当
的代数式作答)。当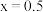 时,
时,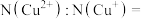
_______ 。 晶胞中互不相邻的
晶胞中互不相邻的 围成的空间结构是
围成的空间结构是_______ 。
(4) 可以与稀硫酸反应生成
可以与稀硫酸反应生成 ,比较
,比较 和
和 键角的大小:
键角的大小: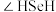
_______ (填“>”或“<”)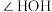 ,说明原因:
,说明原因:_______ 。
(5)立方 晶胞的晶胞参数为
晶胞的晶胞参数为 ,该晶胞的密度为
,该晶胞的密度为_______  (用
(用 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
 是一种钠离子电池正极材料,充、放电过程中正极材料立方晶胞示意图的组成变化如图所示,晶胞内未标出因放电产生的0价
是一种钠离子电池正极材料,充、放电过程中正极材料立方晶胞示意图的组成变化如图所示,晶胞内未标出因放电产生的0价 。
。
 呈黄色,
呈黄色, 呈绿色,
呈绿色, 呈蓝色等;预测
呈蓝色等;预测 呈
呈(2)
 可以形成多种配合物,其中的甘氨酸铜对于预防和治疗贫血、骨质疏松等疾病具有一定的作用,它有顺式和反式两种同分异构体,结构如图。
可以形成多种配合物,其中的甘氨酸铜对于预防和治疗贫血、骨质疏松等疾病具有一定的作用,它有顺式和反式两种同分异构体,结构如图。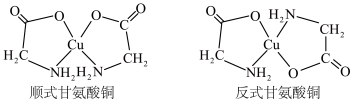
 ”或“
”或“ ”)。
”)。(3)充电时,每个
 晶胞完全转化为
晶胞完全转化为 晶胞。每个
晶胞。每个 晶胞中
晶胞中 个数为
个数为 的代数式作答)。当
的代数式作答)。当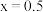 时,
时,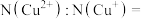
 晶胞中互不相邻的
晶胞中互不相邻的 围成的空间结构是
围成的空间结构是(4)
 可以与稀硫酸反应生成
可以与稀硫酸反应生成 ,比较
,比较 和
和 键角的大小:
键角的大小: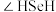
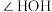 ,说明原因:
,说明原因:(5)立方
 晶胞的晶胞参数为
晶胞的晶胞参数为 ,该晶胞的密度为
,该晶胞的密度为 (用
(用 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
您最近一年使用:0次
7 . 中国幅员辽阔,有丰富的金、银、铜、铅等矿产资源。根据所学知识回答下列问题:
(1)已知金的价电子排布式为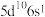 ,则其位于元素周期表
,则其位于元素周期表___________ 区。
(2)某种配合物结构如图(H原子未给出)。___________ (填元素符号)。
②该配合物中N、O、S三种元素的第一电离能由大到小的顺序为___________ 。
③该配合物中键角∠O—S—O___________ (填“>”“<”或“=”)∠C—N—C。
(3)铜及其化合物常用作催化剂,如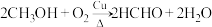 。
。
① 分子中O原子的杂化轨道类型为
分子中O原子的杂化轨道类型为___________ 。
② 易溶于水,原因是
易溶于水,原因是___________ 、___________ 。
③ 的立体构型为
的立体构型为___________ ,其分子中含有的 键与
键与 键数目之比为
键数目之比为___________ 。
(4)Pb、S形成的某种晶体结构示意图如图,设晶胞参数为a pm, 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。___________ 。
②该晶体的密度为___________  。
。
(1)已知金的价电子排布式为
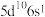 ,则其位于元素周期表
,则其位于元素周期表(2)某种配合物结构如图(H原子未给出)。
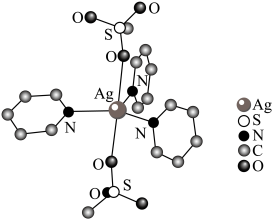
②该配合物中N、O、S三种元素的第一电离能由大到小的顺序为
③该配合物中键角∠O—S—O
(3)铜及其化合物常用作催化剂,如
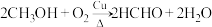 。
。①
 分子中O原子的杂化轨道类型为
分子中O原子的杂化轨道类型为②
 易溶于水,原因是
易溶于水,原因是③
 的立体构型为
的立体构型为 键与
键与 键数目之比为
键数目之比为(4)Pb、S形成的某种晶体结构示意图如图,设晶胞参数为a pm,
 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。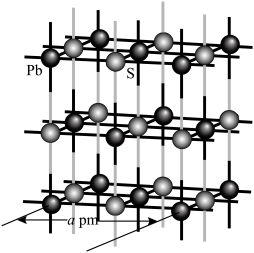
②该晶体的密度为
 。
。
您最近一年使用:0次
解题方法
8 . H、C、N、F、Cl、Ba等是几种重要的元素,Ba的一种氢化物是一种重要的储氢晶体。回答下列问题:
(1)处于基态的F和N原子,下列参数前者小于后者的是________ (填字母)。
A.最外层电子数 B.未成对电子数 C.第一电离能 D.原子半径 E.电负性
(2)咪唑(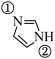 )具有类似苯环的芳香性,①号N比②号N更易与某些金属离子(如
)具有类似苯环的芳香性,①号N比②号N更易与某些金属离子(如 )形成配位键的原因:
)形成配位键的原因:________ 。
(3) 、
、 两种物质中熔点较高的是
两种物质中熔点较高的是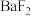 ,其原因是
,其原因是________ 。
(4)三氯乙腈 和过量
和过量 反应可得到一种高能物质M,其结构如图,则
反应可得到一种高能物质M,其结构如图,则 分子中
分子中 键与
键与 键的数目比为
键的数目比为________ , 的空间构型为
的空间构型为________ ,M中N原子杂化方式为________ 。 与
与 形成的氢化物储氢(用H表示)后的晶胞如图:
形成的氢化物储氢(用H表示)后的晶胞如图:________ (填“H”或“ ”)。
”)。
②原子分数坐标为 ,
, ,
, ,d原子的坐标为
,d原子的坐标为________ 。
③根据上图所示,储氢后该晶体的密度为________  。
。
(1)处于基态的F和N原子,下列参数前者小于后者的是
A.最外层电子数 B.未成对电子数 C.第一电离能 D.原子半径 E.电负性
(2)咪唑(
 )具有类似苯环的芳香性,①号N比②号N更易与某些金属离子(如
)具有类似苯环的芳香性,①号N比②号N更易与某些金属离子(如 )形成配位键的原因:
)形成配位键的原因:(3)
 、
、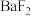 两种物质中熔点较高的是
两种物质中熔点较高的是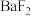 ,其原因是
,其原因是(4)三氯乙腈
 和过量
和过量 反应可得到一种高能物质M,其结构如图,则
反应可得到一种高能物质M,其结构如图,则 分子中
分子中 键与
键与 键的数目比为
键的数目比为 的空间构型为
的空间构型为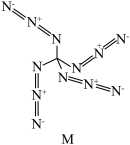
 与
与 形成的氢化物储氢(用H表示)后的晶胞如图:
形成的氢化物储氢(用H表示)后的晶胞如图:
 ”)。
”)。②原子分数坐标为
 ,
, ,
, ,d原子的坐标为
,d原子的坐标为③根据上图所示,储氢后该晶体的密度为
 。
。
您最近一年使用:0次
解题方法
9 . 钛是一种银白色过渡金属,在高科技社会中得到了广泛的应用。可以从钛铁矿( )中提取
)中提取 ,并常用Na置换熔融
,并常用Na置换熔融 来获得单质Ti。
来获得单质Ti。
(1)基态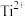 的价电子排布式为
的价电子排布式为___________ ,其核外能量最高的电子所在的能层符号为___________ ,其核外共有___________ 种运动状态不同的电子。
(2)Ti的配合物有多种。在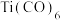 、
、 和
和 三种微粒的配体中,所含原子电负性由大到小排序后,排第3位的元素是
三种微粒的配体中,所含原子电负性由大到小排序后,排第3位的元素是___________ (填写元素名称), 中
中
___________ (填“大于”、“小于”或“等于”)单个水分子中 ,原因是
,原因是___________ 。
(3) 的球棍结构如图,Ti的配位数是
的球棍结构如图,Ti的配位数是___________ ,N原子的杂化方式为___________ ,与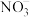 互为等电子体的分子为
互为等电子体的分子为___________ (写分子式)。 和
和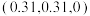 ,则微粒3的原子分数坐标为
,则微粒3的原子分数坐标为___________ ;若阿伏加德罗常数的值为 ,金红石的密度为
,金红石的密度为___________  (列出计算表达式)。
(列出计算表达式)。
 )中提取
)中提取 ,并常用Na置换熔融
,并常用Na置换熔融 来获得单质Ti。
来获得单质Ti。(1)基态
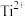 的价电子排布式为
的价电子排布式为(2)Ti的配合物有多种。在
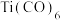 、
、 和
和 三种微粒的配体中,所含原子电负性由大到小排序后,排第3位的元素是
三种微粒的配体中,所含原子电负性由大到小排序后,排第3位的元素是 中
中
 ,原因是
,原因是(3)
 的球棍结构如图,Ti的配位数是
的球棍结构如图,Ti的配位数是 互为等电子体的分子为
互为等电子体的分子为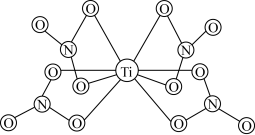
 和
和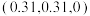 ,则微粒3的原子分数坐标为
,则微粒3的原子分数坐标为 ,金红石的密度为
,金红石的密度为 (列出计算表达式)。
(列出计算表达式)。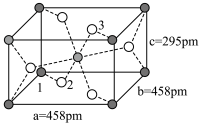
您最近一年使用:0次
10 . 锰及其化合物在化学实验室和化工生产应用非常广泛,回答下列问题:
(1)乙酰丙酮锰(III)是一种广泛用于苯酚类化合物氧化偶联的试剂,Me表示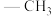 ,中心离子为
,中心离子为 离子,其结构如图所示。
离子,其结构如图所示。_______ ,该物质中不同杂化方式的碳原子数之比为_______ ,中心离子 填充在
填充在_______ 空隙中(填“四面体”或“八面体”)。
(2)从原子结构角度分析,基态原子中,Mn的第三电离能大于Fe的第三电离能的原因是_______ 。
(3) 能形成如图所示大π键,而羧基酸性随大π键电子云密度的增大而减弱,则
能形成如图所示大π键,而羧基酸性随大π键电子云密度的增大而减弱,则 、
、 、
、 酸性从强到弱顺序是
酸性从强到弱顺序是_______ 。 的顺式结构为
的顺式结构为_______ 分子(填“极性”、“非极性”)。 围成的八面体空隙中,形成无限螺旋链的络离子,同一条链内原子作用很强,其形成晶胞结构沿对角线的投影如图a所示,晶胞俯视图如图b所示,晶胞参数为
围成的八面体空隙中,形成无限螺旋链的络离子,同一条链内原子作用很强,其形成晶胞结构沿对角线的投影如图a所示,晶胞俯视图如图b所示,晶胞参数为 、
、 和
和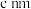 ,则该晶胞所带电荷为
,则该晶胞所带电荷为_______ 。阿伏加德罗常数的值为 ,该晶体的密度为
,该晶体的密度为_______  (用含
(用含 、a、c的式子表示)。
、a、c的式子表示)。
(1)乙酰丙酮锰(III)是一种广泛用于苯酚类化合物氧化偶联的试剂,Me表示
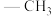 ,中心离子为
,中心离子为 离子,其结构如图所示。
离子,其结构如图所示。
 填充在
填充在(2)从原子结构角度分析,基态原子中,Mn的第三电离能大于Fe的第三电离能的原因是
(3)
 能形成如图所示大π键,而羧基酸性随大π键电子云密度的增大而减弱,则
能形成如图所示大π键,而羧基酸性随大π键电子云密度的增大而减弱,则 、
、 、
、 酸性从强到弱顺序是
酸性从强到弱顺序是 的顺式结构为
的顺式结构为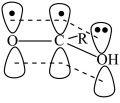
 围成的八面体空隙中,形成无限螺旋链的络离子,同一条链内原子作用很强,其形成晶胞结构沿对角线的投影如图a所示,晶胞俯视图如图b所示,晶胞参数为
围成的八面体空隙中,形成无限螺旋链的络离子,同一条链内原子作用很强,其形成晶胞结构沿对角线的投影如图a所示,晶胞俯视图如图b所示,晶胞参数为 、
、 和
和 ,则该晶胞所带电荷为
,则该晶胞所带电荷为 ,该晶体的密度为
,该晶体的密度为 (用含
(用含 、a、c的式子表示)。
、a、c的式子表示)。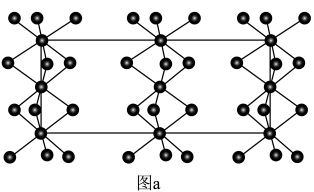

您最近一年使用:0次



