1 . 硅(Si)、硒(Se)、镓(Ga)、锗(Ge)的单质及某些化合物都是航空航天测控、光纤通信等领域常用的半导体材料。回答下列问题:
(1)制造手机芯片需要高纯度硅,晶体硅属于___________ 晶体,可溶于氢氟酸生成氢气。写出晶体硅与氢氟酸反应的化学方程式:___________ 。
(2)基态硒原子的价电子排布图为___________ ;硒、硅均能与氢元素形成气态氢化物,硅的氢化物的分子中共用电子对偏向氢原子,而氢气与硒反应时单质硒是氧化剂,则电负性大小为Se___________ (填“>”或“<”)Si, 的立体构型为
的立体构型为___________ 。
(3)镓和砷都是第四周期的元素,则第一电离能:Ga___________ (填“大于”或“小于”)As。GaN、GaAs的晶体类型与晶体硅相同,试解释,熔点GaN>GaAs的原因:___________ 。
(4)氮化镓是一种重要的半导体材料,其立方晶胞结构如图所示。每个Ga原子周围距离最近的Ga原子数为___________ 。已知晶胞边长为apm,若该晶体的密度为 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值
___________ (只列出计算式即可)。
(1)制造手机芯片需要高纯度硅,晶体硅属于
(2)基态硒原子的价电子排布图为
 的立体构型为
的立体构型为(3)镓和砷都是第四周期的元素,则第一电离能:Ga
(4)氮化镓是一种重要的半导体材料,其立方晶胞结构如图所示。每个Ga原子周围距离最近的Ga原子数为
 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值

您最近一年使用:0次
解题方法
2 . 镍及其合金是常用的催化剂,在化学反应中广泛应用。
(1)基态镍原子的价电子排布式为___________ 。
(2)镍形成的团簇分子能提高 还原为CO的活性。
还原为CO的活性。 中碳原子的杂化方式为
中碳原子的杂化方式为___________ 。
(3)在Ni和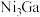 合金催化剂表面,5-羟甲基糠醛按需选择性催化加氢制呋喃二醇,反应如图所示。
合金催化剂表面,5-羟甲基糠醛按需选择性催化加氢制呋喃二醇,反应如图所示。 溶液的洁净试管中滴加
溶液的洁净试管中滴加 稀氨水至浊液刚好变澄清,得到的溶液为银氨溶液,主要成分是
稀氨水至浊液刚好变澄清,得到的溶液为银氨溶液,主要成分是 。相对于
。相对于 的稀氨水,所得到的银氨溶液的pH
的稀氨水,所得到的银氨溶液的pH___________ (填“升高”“降低”或“不变”),其原因是___________ 。
②呋喃二醇的沸点高于5-羟甲基糠醛,其主要原因是___________ 。
(4)羰基镍[ ]常作催化剂,它的熔点为-25℃,沸点为43℃。羰基镍的晶体类型是
]常作催化剂,它的熔点为-25℃,沸点为43℃。羰基镍的晶体类型是___________ ,其中心原子镍的配位数为___________ 。
(5)Ni和Nb组成的合金的晶胞结构如图所示。 表示阿伏加德罗常数的值,该晶体的密度为
表示阿伏加德罗常数的值,该晶体的密度为___________  (列出计算式)。
(列出计算式)。
(1)基态镍原子的价电子排布式为
(2)镍形成的团簇分子能提高
 还原为CO的活性。
还原为CO的活性。 中碳原子的杂化方式为
中碳原子的杂化方式为(3)在Ni和
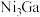 合金催化剂表面,5-羟甲基糠醛按需选择性催化加氢制呋喃二醇,反应如图所示。
合金催化剂表面,5-羟甲基糠醛按需选择性催化加氢制呋喃二醇,反应如图所示。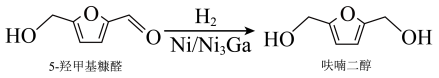
 溶液的洁净试管中滴加
溶液的洁净试管中滴加 稀氨水至浊液刚好变澄清,得到的溶液为银氨溶液,主要成分是
稀氨水至浊液刚好变澄清,得到的溶液为银氨溶液,主要成分是 。相对于
。相对于 的稀氨水,所得到的银氨溶液的pH
的稀氨水,所得到的银氨溶液的pH②呋喃二醇的沸点高于5-羟甲基糠醛,其主要原因是
(4)羰基镍[
 ]常作催化剂,它的熔点为-25℃,沸点为43℃。羰基镍的晶体类型是
]常作催化剂,它的熔点为-25℃,沸点为43℃。羰基镍的晶体类型是(5)Ni和Nb组成的合金的晶胞结构如图所示。
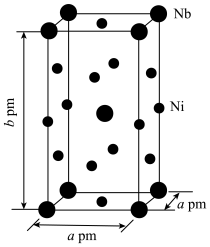
 表示阿伏加德罗常数的值,该晶体的密度为
表示阿伏加德罗常数的值,该晶体的密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
解题方法
3 . 硅及其化合物在生活、生产和科技等方面应用广泛。工业制备高纯硅的主要过程如下:
石英砂(主要成分 )
)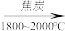 粗硅
粗硅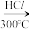

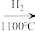 高纯硅
高纯硅
(1) 位于元素周期表第
位于元素周期表第_____ 周期,第_____ 族。
(2)由硅原子核形成的三种微粒,电子排布式分别为:a.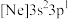 、b.
、b.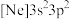 、c.
、c.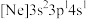 ,有关这些微粒的叙述,正确的是_____(填标号)。
,有关这些微粒的叙述,正确的是_____(填标号)。
(3)石英砂与焦炭反应制备粗硅的化学方程式为_____ 。粗硅与 反应过程中会有副产物
反应过程中会有副产物 生成,
生成, 中
中 的杂化轨道类型为
的杂化轨道类型为_____ 。 的键角
的键角_____ (填“大于”、“小于”或“等于”) 的键角。
的键角。
(4) 以空间结构为
以空间结构为_____ 。 和
和 会剧烈反应,写出该反应的化学方程式
会剧烈反应,写出该反应的化学方程式_____ (已知:电负性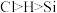 )。
)。
石英砂(主要成分
 )
) 粗硅
粗硅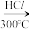

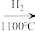 高纯硅
高纯硅(1)
 位于元素周期表第
位于元素周期表第(2)由硅原子核形成的三种微粒,电子排布式分别为:a.
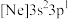 、b.
、b.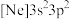 、c.
、c.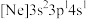 ,有关这些微粒的叙述,正确的是_____(填标号)。
,有关这些微粒的叙述,正确的是_____(填标号)。A.微粒半径: |
| B.电子排布属于基态原子(或离子)的是:a、b |
C.电离一个电子所需最低能量: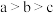 |
D.得电子能力: |
 反应过程中会有副产物
反应过程中会有副产物 生成,
生成, 中
中 的杂化轨道类型为
的杂化轨道类型为 的键角
的键角 的键角。
的键角。(4)
 以空间结构为
以空间结构为 和
和 会剧烈反应,写出该反应的化学方程式
会剧烈反应,写出该反应的化学方程式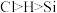 )。
)。
您最近一年使用:0次
2024-04-29更新
|
40次组卷
|
2卷引用:湖北省黄冈市2023-2024学年高二上学期期末调研考试化学试题
4 . 磷锡青铜(一种磷、锡、铜合金)是有名的弹性材料,广泛应用于仪器仪表中耐磨零件和弹性元件。回答下列问题:
(1)白磷(P4)晶体熔点44.1℃、沸点280℃,质软,则白磷属于___________ 晶体(写“分子”、“共价”、“离子”)。
(2)Cu2+与NH3能形成的配离子为___________ (写化学式),该配离子水溶液的颜色为___________ 。该配离子具有对称的空间构型,若其中两个NH3被两个Cl-取代,能得到两种不同结构的产物,则该配离子的空间构型为___________ (填“正四面体”、“平面正方形”)。
(3)PO 中P原子的杂化方式为
中P原子的杂化方式为___________ 杂化,PO 的空间构型为
的空间构型为___________ 。
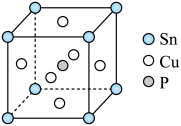
(4)磷锡青铜的立方晶胞结构如图所示,则该晶体的化学式为___________ 。
(1)白磷(P4)晶体熔点44.1℃、沸点280℃,质软,则白磷属于
(2)Cu2+与NH3能形成的配离子为
(3)PO
 中P原子的杂化方式为
中P原子的杂化方式为 的空间构型为
的空间构型为(4)磷锡青铜的立方晶胞结构如图所示,则该晶体的化学式为
您最近一年使用:0次
5 . 砷化硼和化镓是两种半导体材料。回答下列问题:
(1)基态B原子的核外电子空间运动状态有_____ 种,基态As原子的未成对电子数是_____ 。
(2)镓失去电子的逐级电离能依次为577 、1984
、1984 、2961.8
、2961.8 ,6192
,6192 ,由此推知镓的氧化物化学式可能为
,由此推知镓的氧化物化学式可能为____ 。
(3)通过反应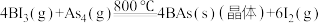 可制备BAs晶体。
可制备BAs晶体。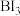 分子中键角为
分子中键角为_______ ;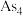 结构与白磷相似,其中As原子杂化方式是
结构与白磷相似,其中As原子杂化方式是_______ ,成键电子对与孤电子对数目之比为______ 。
(4) 的熔点为-126℃,而
的熔点为-126℃,而 的熔点超过1000℃,二者熔点差异大的原因为
的熔点超过1000℃,二者熔点差异大的原因为______ 。
(5)GaAs的晶胞结构如图所示.它可以看作As作_____ 堆积(填堆积方式),Ga原子处于As原子形成的_____ (填“正四面体”或“正八面体”)空隙中,As原子的配位数为_____ ;GaAs的密度为 ,Ga和As的相对原子质量分别为a和b,晶胞中Ga与As原子之间最短距离为d pm,则阿伏加德罗常数NA=
,Ga和As的相对原子质量分别为a和b,晶胞中Ga与As原子之间最短距离为d pm,则阿伏加德罗常数NA=______ (列出计算式即可)。
(1)基态B原子的核外电子空间运动状态有
(2)镓失去电子的逐级电离能依次为577
 、1984
、1984 、2961.8
、2961.8 ,6192
,6192 ,由此推知镓的氧化物化学式可能为
,由此推知镓的氧化物化学式可能为(3)通过反应
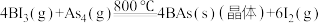 可制备BAs晶体。
可制备BAs晶体。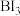 分子中键角为
分子中键角为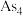 结构与白磷相似,其中As原子杂化方式是
结构与白磷相似,其中As原子杂化方式是(4)
 的熔点为-126℃,而
的熔点为-126℃,而 的熔点超过1000℃,二者熔点差异大的原因为
的熔点超过1000℃,二者熔点差异大的原因为(5)GaAs的晶胞结构如图所示.它可以看作As作
 ,Ga和As的相对原子质量分别为a和b,晶胞中Ga与As原子之间最短距离为d pm,则阿伏加德罗常数NA=
,Ga和As的相对原子质量分别为a和b,晶胞中Ga与As原子之间最短距离为d pm,则阿伏加德罗常数NA=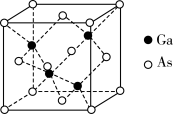
您最近一年使用:0次
6 . 某课题组发展了可控的 键形成策略,实现了
键形成策略,实现了 硅杂哌啶的高效合成,其反应原理如下:
硅杂哌啶的高效合成,其反应原理如下:
(1)下面B原子的电子排布图中,属于基态电子排布图的为___________ (填标号,下同),激发态电子排布图中能量最高的是___________ 。___________ (用元素符号表示)。晶体硅的熔点低于晶体硼,试解释其原因:___________ 。
(3)已知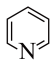 为平面结构,则合成的4-硅杂哌啶分子中,有
为平面结构,则合成的4-硅杂哌啶分子中,有 和
和 两种杂化方式的元素为
两种杂化方式的元素为___________ (填元素符号)。
(4)氮和硼可形成新型半导体材料 ,其晶胞结构如图所示,晶胞中每个
,其晶胞结构如图所示,晶胞中每个 周围最近的
周围最近的 原子个数为
原子个数为___________ 。若晶胞边长为 ,用
,用 表示阿伏加德罗常数的值,则最近的硼原子间的距离为
表示阿伏加德罗常数的值,则最近的硼原子间的距离为___________  (用含
(用含 的代数式表示),晶体密度为
的代数式表示),晶体密度为___________  (用含
(用含 、
、 的代数式表示)。
的代数式表示)。
 键形成策略,实现了
键形成策略,实现了 硅杂哌啶的高效合成,其反应原理如下:
硅杂哌啶的高效合成,其反应原理如下: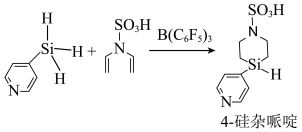
(1)下面B原子的电子排布图中,属于基态电子排布图的为
a.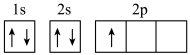 b.
b.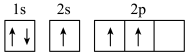
c. d.
d.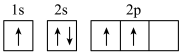
(3)已知
 为平面结构,则合成的4-硅杂哌啶分子中,有
为平面结构,则合成的4-硅杂哌啶分子中,有 和
和 两种杂化方式的元素为
两种杂化方式的元素为(4)氮和硼可形成新型半导体材料
 ,其晶胞结构如图所示,晶胞中每个
,其晶胞结构如图所示,晶胞中每个 周围最近的
周围最近的 原子个数为
原子个数为 ,用
,用 表示阿伏加德罗常数的值,则最近的硼原子间的距离为
表示阿伏加德罗常数的值,则最近的硼原子间的距离为 (用含
(用含 的代数式表示),晶体密度为
的代数式表示),晶体密度为 (用含
(用含 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解题方法
7 . 硫铝酸钙化学式为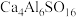 ,可写成
,可写成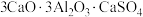 ,是一种常用的混凝土膨胀剂。回答下列问题:
,是一种常用的混凝土膨胀剂。回答下列问题:
(1)基态氧原子的价电子排布图为 ,而不是
,而不是 ,因为核外电子排布应遵循
,因为核外电子排布应遵循_____ (填“泡利原理”或“洪特规则”)。基态Ca原子核外电子占据的最高能层符号是_____ 。
(2) 的中心原子杂化方式为
的中心原子杂化方式为_____ , 可看成是
可看成是 中的一个氧原子被硫原子所替代,则
中的一个氧原子被硫原子所替代,则 -的VSEPR模型名称为
-的VSEPR模型名称为_____ 。
(3)Al的性质与Be的性质相似,可知熔点:
_____  (填“>”或“<”),理由是
(填“>”或“<”),理由是_____ 。
(4)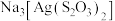 中存在的作用力有
中存在的作用力有_____ 。
A.离子键 B.共价键 C.范德华力 D.金属键 E.配位键
(5)在空气中灼烧 生成Ag和
生成Ag和 ,
, 分子空间构型为
分子空间构型为_____ ;与 相比,
相比, 的键角更
的键角更_____ (“大”、“小”、“相等”)。
(6)如图是金属氢化物储氢材料,其晶胞如图所示,其化学式为_____ ,已知该晶体的密度为 ,则该晶胞的体积为
,则该晶胞的体积为_____  (用含
(用含 、
、 的代数式表示)
的代数式表示)
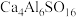 ,可写成
,可写成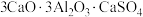 ,是一种常用的混凝土膨胀剂。回答下列问题:
,是一种常用的混凝土膨胀剂。回答下列问题:(1)基态氧原子的价电子排布图为
 ,而不是
,而不是 ,因为核外电子排布应遵循
,因为核外电子排布应遵循(2)
 的中心原子杂化方式为
的中心原子杂化方式为 可看成是
可看成是 中的一个氧原子被硫原子所替代,则
中的一个氧原子被硫原子所替代,则 -的VSEPR模型名称为
-的VSEPR模型名称为(3)Al的性质与Be的性质相似,可知熔点:

 (填“>”或“<”),理由是
(填“>”或“<”),理由是(4)
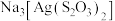 中存在的作用力有
中存在的作用力有A.离子键 B.共价键 C.范德华力 D.金属键 E.配位键
(5)在空气中灼烧
 生成Ag和
生成Ag和 ,
, 分子空间构型为
分子空间构型为 相比,
相比, 的键角更
的键角更(6)如图是金属氢化物储氢材料,其晶胞如图所示,其化学式为
 ,则该晶胞的体积为
,则该晶胞的体积为 (用含
(用含 、
、 的代数式表示)
的代数式表示)
您最近一年使用:0次
8 . 金属羰基配位化合物在催化反应中有着重要应用。HMn(CO)5是锰的一种简单羰基配位化合物,其结构示意图如下。

回答问题:
(1)基态锰原子的价层电子排布式为_______ 。
(2)配位化合物中的中心原子配位数是指和中心原子直接成键的原子的数目。HMn(CO)5中锰原子的配位数为_______ 。
(3)第一电离能的大小:C_______ O(填“大于”或“小于”)。
(4) 中碳原子的杂化轨道类型是
中碳原子的杂化轨道类型是_______ ,写出一种与具有相同空间结构的-1价无机酸根离子的化学式_______ 。
(5)CH3Mn(CO)5可看作是HMn(CO)5中的氢原子被甲基取代的产物。CH3Mn(CO)5与I2反应可用于制备CH3I,反应前后锰的配位数不变,CH3Mn(CO)5与I2反应的化学方程式为_______ 。
(6)MnS晶胞与NaCl晶胞属于同种类型,如图所示。前者的熔点明显高于后者,其主要原因是_______ 。


回答问题:
(1)基态锰原子的价层电子排布式为
(2)配位化合物中的中心原子配位数是指和中心原子直接成键的原子的数目。HMn(CO)5中锰原子的配位数为
(3)第一电离能的大小:C
(4)
 中碳原子的杂化轨道类型是
中碳原子的杂化轨道类型是(5)CH3Mn(CO)5可看作是HMn(CO)5中的氢原子被甲基取代的产物。CH3Mn(CO)5与I2反应可用于制备CH3I,反应前后锰的配位数不变,CH3Mn(CO)5与I2反应的化学方程式为
(6)MnS晶胞与NaCl晶胞属于同种类型,如图所示。前者的熔点明显高于后者,其主要原因是

您最近一年使用:0次
解题方法
9 . 硫在古代被列为重要的药材,目前含硫化合物广泛用于医药、农药等。回答下列问题:
(1)硫离子的价电子排布图为___________ 。
(2)铁硫簇是普遍存在于生物体内的最古老的生命物质之一、一种铁硫原子簇的结构如图所示:

该化合物的化学式为___________ ,中心原子Fe的配位数为___________ 。
(3)解砷灵的结构简式为 。―SH和
。―SH和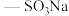 中硫原子的杂化轨道类型分别是
中硫原子的杂化轨道类型分别是___________ 、___________ ;1mol 中含
中含___________ mol 键。
键。
(4) 及
及 的分子结构及相应的键角如图所示。
的分子结构及相应的键角如图所示。

 的键角小于
的键角小于 的原因是
的原因是___________ 。
(5) 的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为3∶2∶1,对应的颜色分别为紫色、浅绿色和蓝绿色,其中浅绿色的结构中配离子的化学式为
的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为3∶2∶1,对应的颜色分别为紫色、浅绿色和蓝绿色,其中浅绿色的结构中配离子的化学式为___________ 。
(6)已知硫化锰(MnS)晶胞如图所示,该晶胞参数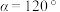 ,
, 。已知空间利用率指的是构成晶体的原子、离子或分子在整个晶体空间中所占有的体积百分比。已知锰和硫的原子半径分别
。已知空间利用率指的是构成晶体的原子、离子或分子在整个晶体空间中所占有的体积百分比。已知锰和硫的原子半径分别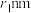 和
和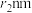 ,该晶体中原子的空间利用率为
,该晶体中原子的空间利用率为___________ (列出计算式即可)。

(1)硫离子的价电子排布图为
(2)铁硫簇是普遍存在于生物体内的最古老的生命物质之一、一种铁硫原子簇的结构如图所示:

该化合物的化学式为
(3)解砷灵的结构简式为
 。―SH和
。―SH和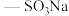 中硫原子的杂化轨道类型分别是
中硫原子的杂化轨道类型分别是 中含
中含 键。
键。(4)
 及
及 的分子结构及相应的键角如图所示。
的分子结构及相应的键角如图所示。
 的键角小于
的键角小于 的原因是
的原因是(5)
 的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为3∶2∶1,对应的颜色分别为紫色、浅绿色和蓝绿色,其中浅绿色的结构中配离子的化学式为
的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为3∶2∶1,对应的颜色分别为紫色、浅绿色和蓝绿色,其中浅绿色的结构中配离子的化学式为(6)已知硫化锰(MnS)晶胞如图所示,该晶胞参数
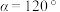 ,
, 。已知空间利用率指的是构成晶体的原子、离子或分子在整个晶体空间中所占有的体积百分比。已知锰和硫的原子半径分别
。已知空间利用率指的是构成晶体的原子、离子或分子在整个晶体空间中所占有的体积百分比。已知锰和硫的原子半径分别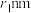 和
和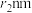 ,该晶体中原子的空间利用率为
,该晶体中原子的空间利用率为
您最近一年使用:0次
10 . 铁、钴及其化合物在生活中有广泛应用。
(1)Fe2+的基态核外电子排布式为___________ 。
(2)实验室用KSCN溶液、苯酚检验Fe3+。
①1mol苯酚分子中含有σ键的数目为___________ 。
②类卤素离子SCN-可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H S
S C≡N)和异硫氰酸
C≡N)和异硫氰酸 ,这两种酸中沸点较高的是
,这两种酸中沸点较高的是___________ ,原因:___________ 。
(3)氮化铁晶体的晶胞结构如图−1所示。该晶体中铁、氮的微粒个数之比为___________ 。

(4)某铁的化合物结构简式如图−2所示:

①上述化合物中所含有的非金属元素的电负性由大到小的顺序为___________ (用元素符号表示)。
②上述化合物中氮原子的杂化方式为___________ 。
(5)配合物[Co(NH3)5Cl]Cl2中与Co2+形成配位键的原子是___________ (用元素符号表示),与NH3互为等电子体的离子是___________ ,区别[Co(NH3)5Cl]Cl2和[Co(NH3)6]Cl3这两种晶体的实验方案为___________ 。
(1)Fe2+的基态核外电子排布式为
(2)实验室用KSCN溶液、苯酚检验Fe3+。
①1mol苯酚分子中含有σ键的数目为
②类卤素离子SCN-可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H
 S
S C≡N)和异硫氰酸
C≡N)和异硫氰酸 ,这两种酸中沸点较高的是
,这两种酸中沸点较高的是(3)氮化铁晶体的晶胞结构如图−1所示。该晶体中铁、氮的微粒个数之比为

(4)某铁的化合物结构简式如图−2所示:

①上述化合物中所含有的非金属元素的电负性由大到小的顺序为
②上述化合物中氮原子的杂化方式为
(5)配合物[Co(NH3)5Cl]Cl2中与Co2+形成配位键的原子是
您最近一年使用:0次



