名校
解题方法
1 . 在照相底片的定影过程中,未曝光的溴化银(AgBr)常用硫代硫酸钠(Na2S2O3)溶解,反应生成Na3[Ag(S2O3)2];在废定影液中加入Na2S使Na3[Ag(S2O3)2]中的银转化为Ag2S,并使定影液再生。将Ag2S在高温下转化为Ag,就达到了回收银的目的。
(1)基态铜原子的价电子排布式为_______ 。
(2)Na、O、S简单离子半径由大到小的顺序为_______ 。
(3)S2O 离子结构如图所示,其中心硫原子的杂化轨道类型为
离子结构如图所示,其中心硫原子的杂化轨道类型为_______ 。
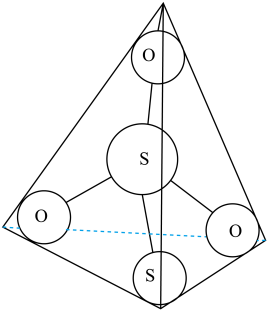
(4)写出AgBr 溶于Na2S2O3溶液的离子反应方程式_______ 。
(5)Na3[Ag(S2O3)2]中存在的作用力有离子键、共价键、_______ 。
(6)在空气中灼烧Ag2S生成Ag和SO2,SO2分子中硫原子的价层电子对数为_______ ,其分子空间构型为_______ 。SO2易溶于水,原因是_______ 。
(7)现在人们已经有多种方法来测定阿伏加德罗常数,X射线衍射法就是其中的一种,通过对金晶体的X 射线衍射图像的分析,可以得出金晶体的晶胞属于面心立方晶胞(与铜的晶胞相似)。若金的密度为ρg·cm-3,金的摩尔质量为Mg·mol-1,阿伏加德罗常数为NA,试通过这些数据列出计算晶胞的体积的算式为_______ 。
(1)基态铜原子的价电子排布式为
(2)Na、O、S简单离子半径由大到小的顺序为
(3)S2O
 离子结构如图所示,其中心硫原子的杂化轨道类型为
离子结构如图所示,其中心硫原子的杂化轨道类型为
(4)写出AgBr 溶于Na2S2O3溶液的离子反应方程式
(5)Na3[Ag(S2O3)2]中存在的作用力有离子键、共价键、
(6)在空气中灼烧Ag2S生成Ag和SO2,SO2分子中硫原子的价层电子对数为
(7)现在人们已经有多种方法来测定阿伏加德罗常数,X射线衍射法就是其中的一种,通过对金晶体的X 射线衍射图像的分析,可以得出金晶体的晶胞属于面心立方晶胞(与铜的晶胞相似)。若金的密度为ρg·cm-3,金的摩尔质量为Mg·mol-1,阿伏加德罗常数为NA,试通过这些数据列出计算晶胞的体积的算式为
您最近一年使用:0次
名校
解题方法
2 . 物质的组成与结构决定了物质的性质与变化。回答下列问题:
(1)基态铁原子简化的电子排布式为[Ar]___________ 。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是___________ 。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为___________ ,提供孤电子对的成键原子是___________ 。
③氨的沸点高于膦(PH3)的原因是___________ ;PH3分子中P原子的杂化轨道类型为___________ 。
(3)铜与(SCN)2反应生成Cu(SCN)2,1mol(SCN)2中含有π键的数目为___________ 。
(4)碘与锰形成的某种化合物晶胞结构及参数如图所示,该化合物的化学式是___________ ,其晶体密度的计算表达式为___________ g·cm-3(阿伏加德罗常数的值用NA表示)。

(1)基态铁原子简化的电子排布式为[Ar]
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为
③氨的沸点高于膦(PH3)的原因是
(3)铜与(SCN)2反应生成Cu(SCN)2,1mol(SCN)2中含有π键的数目为
(4)碘与锰形成的某种化合物晶胞结构及参数如图所示,该化合物的化学式是

您最近一年使用:0次
解题方法
3 . 碱式碳酸铜[2CuCO3·Cu(OH)2]可用于制造烟火等。在较低温度下,将Cu(NO3)2饱和溶液倒入一定浓度的Na2CO3溶液中,即有碱式碳酸铜生成。
(1)Cu2+基态核外电子排布式为___________ 。
(2)Cu2+在溶液中实际上是以水合离子[Cu(H2O)4]2+的形式存在的。1 mol[Cu(H2O)4]2+中含有σ键的数目为___________ 。
(3)CO 中C原子轨道杂化类型为
中C原子轨道杂化类型为___________ ;与CO2互为等电子体的一种阴离子为___________ (填化学式)。
(4)NO 的空间构型为
的空间构型为___________ (用文字描述)。
(5)Cu的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是___________ 。
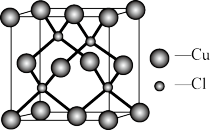
(1)Cu2+基态核外电子排布式为
(2)Cu2+在溶液中实际上是以水合离子[Cu(H2O)4]2+的形式存在的。1 mol[Cu(H2O)4]2+中含有σ键的数目为
(3)CO
 中C原子轨道杂化类型为
中C原子轨道杂化类型为(4)NO
 的空间构型为
的空间构型为(5)Cu的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是

您最近一年使用:0次
名校
解题方法
4 . 2020年9月,中山大学张伟雄教授课题组光响应分子铁电体取得重要进展,某些晶体在一定的温度范围内可以自发极化,而且其自发极化方向可以因外电场方向的反向而反向,晶体的这种性质称为铁电性,具有铁电性的晶体称为铁电体。NaNO2、KH2PO4、BaTiO3晶体均属于铁电体。
(1)K元素处于周期表的_______ 区,NaNO2中阴离子的空间构型为_______ 。
(2)将TiO2与BaCO3加热熔融可制得BaTiO3,TiO2中Ti的离子结构示意图为_______ 。BaTiO3晶体灼烧时,钡元素的焰色是_______ 色。
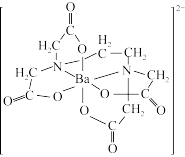
(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。EDTA(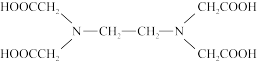 )与Ba2+形成的螯合物结构如图所示,该螯合物中采取sp3杂化的原子有
)与Ba2+形成的螯合物结构如图所示,该螯合物中采取sp3杂化的原子有_______ ,1 mol该螯合物中通过螯合作用形成的配位键数目为_______ 。
(4)KH2PO4的晶胞结构如图所示。
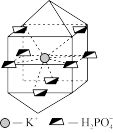
①KH2PO4中阴离子的配位数为_______ 。
②若该晶胞的体积为V nm3,则该KH2PO4晶体的密度为_______ g/cm3。(用含有NA的代数式表示)
(1)K元素处于周期表的
(2)将TiO2与BaCO3加热熔融可制得BaTiO3,TiO2中Ti的离子结构示意图为
(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。EDTA(
 )与Ba2+形成的螯合物结构如图所示,该螯合物中采取sp3杂化的原子有
)与Ba2+形成的螯合物结构如图所示,该螯合物中采取sp3杂化的原子有
(4)KH2PO4的晶胞结构如图所示。

①KH2PO4中阴离子的配位数为
②若该晶胞的体积为V nm3,则该KH2PO4晶体的密度为
您最近一年使用:0次
名校
解题方法
5 . 铁氧体是一种磁性材料,具有广泛的应用。
(1)基态铁原子的核外电子排布式为____ 。
(2)工业制备铁氧体常使用水解法,制备时常加入尿素[CO(NH2)2]、醋酸钠等碱性物质。尿素分子中四种不同元素的电负性由大至小的顺序是____ ;醋酸钠中碳原子的杂化类型是____ 。
(3)工业制备铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4)等弱碱。比较表中氨(NH3)、联氨(N2H4)的熔沸点,解释其高低的主要原因____ 。
(4)如图是从铁氧体离子晶体Fe3O4中,取出的能体现其晶体结构的一个立方体,则晶体中的氧离子是否构成了面心立方最密堆积____ (填“是”或“否”),该立方体是不是Fe3O4的晶胞____ (填“是”或“否”),立方体中三价铁离子处于氧离子围成的____ 空隙(填空间结构)。
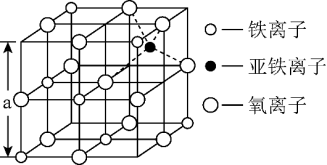
(5)解释该Fe3O4晶体能导电的原因____ ,根据如图计算Fe3O4晶体的密度____ g•cm-3。(图中a=0.42nm,只需要列出计算式。)
(1)基态铁原子的核外电子排布式为
(2)工业制备铁氧体常使用水解法,制备时常加入尿素[CO(NH2)2]、醋酸钠等碱性物质。尿素分子中四种不同元素的电负性由大至小的顺序是
(3)工业制备铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4)等弱碱。比较表中氨(NH3)、联氨(N2H4)的熔沸点,解释其高低的主要原因
| N2H4 | NH3 | |
| 熔点/℃ | 2 | -77.8 |
| 沸点/℃ | 113.5 | -33.5 |

(5)解释该Fe3O4晶体能导电的原因
您最近一年使用:0次
2022-03-18更新
|
176次组卷
|
5卷引用:2017届湖北省黄冈市高三3月质量检测理科综合化学试卷
解题方法
6 . 实验室常利用“棕色环”现象检验 离子。其方法为:取含有
离子。其方法为:取含有 的溶液于试管中,加入FeSO4溶液振荡,然后沿着试管内壁加入浓H2SO4,在溶液的界面上出现“棕色环”。回答下列问题:
的溶液于试管中,加入FeSO4溶液振荡,然后沿着试管内壁加入浓H2SO4,在溶液的界面上出现“棕色环”。回答下列问题:
(1)形成“棕色环”主要发生如下反应:
3[Fe(H2O)6]2++ +4H+=3[Fe(H2O)6]3++NO↑+2H2O
+4H+=3[Fe(H2O)6]3++NO↑+2H2O
[Fe(H2O)6]2++NO=[Fe(NO)(H2O)5]2+(棕色)+H2O
[Fe(NO)(H2O)5]2+中,配位数为___________ 。
(2)与 互为等电子体的微粒是
互为等电子体的微粒是___________ (任写一例)。
(3) 的空间构型是
的空间构型是___________ ,其中N原子的杂化方式是___________ 。
(4)铁原子在不同温度下排列构成不同晶体结构,在912℃以下排列构成的晶体叫做α-铁;在912℃至1394℃之间排列构成的晶体叫做γ-铁;在1394℃以上排列构成的晶体,叫做δ-铁。晶胞剖面结构如图所示:

①γ-铁的原子堆积方式为___________ 。α-Fe、δ-Fe晶胞中铁原子个数比为___________ 。
②已知γ-铁晶体密度为dg/cm3,则Fe原子的半径为___________ nm(用含d、NA的式子表示)。
 离子。其方法为:取含有
离子。其方法为:取含有 的溶液于试管中,加入FeSO4溶液振荡,然后沿着试管内壁加入浓H2SO4,在溶液的界面上出现“棕色环”。回答下列问题:
的溶液于试管中,加入FeSO4溶液振荡,然后沿着试管内壁加入浓H2SO4,在溶液的界面上出现“棕色环”。回答下列问题:(1)形成“棕色环”主要发生如下反应:
3[Fe(H2O)6]2++
 +4H+=3[Fe(H2O)6]3++NO↑+2H2O
+4H+=3[Fe(H2O)6]3++NO↑+2H2O[Fe(H2O)6]2++NO=[Fe(NO)(H2O)5]2+(棕色)+H2O
[Fe(NO)(H2O)5]2+中,配位数为
(2)与
 互为等电子体的微粒是
互为等电子体的微粒是(3)
 的空间构型是
的空间构型是(4)铁原子在不同温度下排列构成不同晶体结构,在912℃以下排列构成的晶体叫做α-铁;在912℃至1394℃之间排列构成的晶体叫做γ-铁;在1394℃以上排列构成的晶体,叫做δ-铁。晶胞剖面结构如图所示:

①γ-铁的原子堆积方式为
②已知γ-铁晶体密度为dg/cm3,则Fe原子的半径为
您最近一年使用:0次
7 . 我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为“液态阳光”计划。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。回答下列问题:
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排布式为___________ ;单晶硅的晶体类型为___________ 。SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为___________ 。
(2)CO2分子中存在___________ 个σ键和___________ 个π键。
(3)甲醇的沸点(64.7°C)介于水(100°C)和甲硫醇(CH3SH,7.6°C)之间,其原因是___________ 。
(4)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。四方ZrO2晶胞如图所示。Zr4+离子在晶胞中的配位数是___________ ,晶胞参数为apm、apm、cpm,该晶体密度为___________ g·cm-3(写出表达式)。在ZrO2中掺杂少量ZnO后形成的催化剂,化学式可表示为ZnxZr1-xOy,则y=___________ (用x表达)。

(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排布式为
(2)CO2分子中存在
(3)甲醇的沸点(64.7°C)介于水(100°C)和甲硫醇(CH3SH,7.6°C)之间,其原因是
(4)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。四方ZrO2晶胞如图所示。Zr4+离子在晶胞中的配位数是

您最近一年使用:0次
名校
8 . 白铜的发明是我国古代冶金技术中的杰出成就,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币和制作仿银饰品。回答下列问题:
(1)镍元素态原子的价电子的核外电子排布图为___ ,3d能级上的未成对电子数为___ 。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是___ 。
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键中提供孤电子对的成键原子是___ 。
③氨的沸点___ (填“高于”或“低于”)膦(PH3),原因是__ ;氨是分子___ (填“极性”或“非极性”),中心原子的轨道杂化类型为___ 。
(3)元素铜与镍的第二电离能分别为:ICu=1958kJ•mol-1、INi=1753kJ•mol-1,ICu>INi的原因是___ 。
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为___ 。
②若合金的密度为dg•cm-3,晶胞参数a=___ nm。
(1)镍元素态原子的价电子的核外电子排布图为
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键中提供孤电子对的成键原子是
③氨的沸点
(3)元素铜与镍的第二电离能分别为:ICu=1958kJ•mol-1、INi=1753kJ•mol-1,ICu>INi的原因是
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为
②若合金的密度为dg•cm-3,晶胞参数a=
您最近一年使用:0次
解题方法
9 . 很多元素在生产生活中有很多应用,请回答下列问题:
(1)基态Fe原子的价电子排布图为___________
(2)Zn2+和CN-、K+可组成化合物K2Zn(CN)4,其中Zn(CN) 中的配体为
中的配体为___________ ,配位原子为___________ ,与该配离子中配体等电子体的分子为___________
(3)Fe-Cr-Al合金可作为汽车尾气催化剂的载体,汽车尾气催化剂可将NO2还原为无毒害的气体,防止HNO3型酸雨的形成,NO2的空间构型为___________ 。HNO3的酸性强于HNO2的原因为___________
(4)金刚砂(SiC)的硬度为9.5,其晶胞结构如下图所示,则金刚砂晶体类型为___________ ,在SiC中,每个C原子周围最近的C原子数目为______ 个;若晶胞的边长为apm,则金刚砂的密度为_______ g/cm3(用NA表示阿伏加德罗常数的值)。
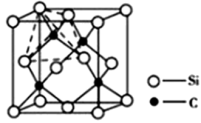
(1)基态Fe原子的价电子排布图为
(2)Zn2+和CN-、K+可组成化合物K2Zn(CN)4,其中Zn(CN)
 中的配体为
中的配体为(3)Fe-Cr-Al合金可作为汽车尾气催化剂的载体,汽车尾气催化剂可将NO2还原为无毒害的气体,防止HNO3型酸雨的形成,NO2的空间构型为
(4)金刚砂(SiC)的硬度为9.5,其晶胞结构如下图所示,则金刚砂晶体类型为

您最近一年使用:0次
2021高三·山东·专题练习
解题方法
10 . 铁是人体必需的微量元素,在人类生产和生活中也有重要作用。
(1)①有机物甲所含的元素中,电负性最小的是___________ (填元素符号,下同),第一电离能最大的是___________ 。

②血红蛋白中的铁处于基态时,其最高能级中的单电子数为___________ 。
③血红蛋白中N原子的杂化方式为___________ 。
(2)FeCl3中的化学键具有明显的共价性,蒸气状态下以双聚分子存在的FeCl3的结构式为___________ ,其中Fe的配位数为___________ 。
(3)LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示。

这类磷酸根离子的化学式可用通式表示为___________ (用n代表P原子数)。
(4)铁及其化合物的晶体种类较多。
①Fe的一种晶体结构如甲、乙所示,若按甲中虚线方向切乙,得到的切面图正确的是___________ (填序号)。

A. B.
B. C.
C. D.
D.
②Fe和N可组成一种过渡金属氮化物,其晶胞如图所示。六棱柱底边边长为x cm,高为y cm,NA为阿伏加德罗常数的值,则晶胞密度为___________ g·cm-3 (列出计算式即可)。

(1)①有机物甲所含的元素中,电负性最小的是

②血红蛋白中的铁处于基态时,其最高能级中的单电子数为
③血红蛋白中N原子的杂化方式为
(2)FeCl3中的化学键具有明显的共价性,蒸气状态下以双聚分子存在的FeCl3的结构式为
(3)LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示。

这类磷酸根离子的化学式可用通式表示为
(4)铁及其化合物的晶体种类较多。
①Fe的一种晶体结构如甲、乙所示,若按甲中虚线方向切乙,得到的切面图正确的是

A.
 B.
B. C.
C. D.
D.
②Fe和N可组成一种过渡金属氮化物,其晶胞如图所示。六棱柱底边边长为x cm,高为y cm,NA为阿伏加德罗常数的值,则晶胞密度为

您最近一年使用:0次



