(1)基态铜原子的价电子排布式为
(2)Na、O、S简单离子半径由大到小的顺序为
(3)S2O
 离子结构如图所示,其中心硫原子的杂化轨道类型为
离子结构如图所示,其中心硫原子的杂化轨道类型为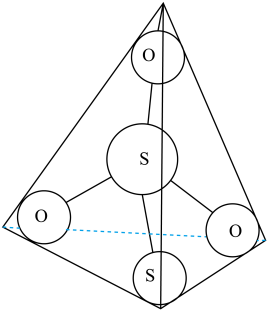
(4)写出AgBr 溶于Na2S2O3溶液的离子反应方程式
(5)Na3[Ag(S2O3)2]中存在的作用力有离子键、共价键、
(6)在空气中灼烧Ag2S生成Ag和SO2,SO2分子中硫原子的价层电子对数为
(7)现在人们已经有多种方法来测定阿伏加德罗常数,X射线衍射法就是其中的一种,通过对金晶体的X 射线衍射图像的分析,可以得出金晶体的晶胞属于面心立方晶胞(与铜的晶胞相似)。若金的密度为ρg·cm-3,金的摩尔质量为Mg·mol-1,阿伏加德罗常数为NA,试通过这些数据列出计算晶胞的体积的算式为
相似题推荐
(1)COCl2的空间构型为
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列
A.CsICl2====CsCl+ICl B.CsICl2====CsI+Cl2
(3)根据表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是
| 元素 | 氟 | 氯 | 溴 | 碘 |
| 第一电离能/ (kJ·mol-1) | 1681 | 1251 | 1140 | 1008 |
(4)下列分子既不存在“s-p”σ键,也不存在“p-p”π键的是
A.HCl B.HF C.SO2 D.SCl2
(5)已知ClO2-为“V”形,中心氯原子周围有4对价层电子。ClO2-中心氯原子的杂化轨道类型为
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示,由此可判断钙的氧化物的化学式为

(1). Ti元素位于元素周期表的第四周期第
(2). 第二周期元素中,第一电离能比N大的元素有
(3). 叠氮酸根
 的几何构型为
的几何构型为 中含有的价层电子对数目为
中含有的价层电子对数目为(4). Mg的熔点是648℃,而Al的熔点是660℃,分析Al熔点更高的原因是
(5). 用Al掺杂TiN后,其晶胞结构如下图所示,距离Ti最近的Al有
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,原子①与原子②距离为
,原子①与原子②距离为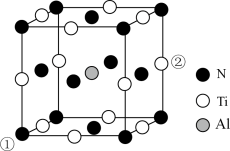
(1)写出E的价电子排布式:
(2)在A形成的化合物中,A采取sp2杂化,且分子量最小的化合物为(写化学式)
(3)下列物质的性质与氢键有关的是
A. 可燃冰的形成 B. A的氢化物的沸点 C. B的氢化物的热稳定性
(4)E3+可以与AB-形成配离子,其中E3+以d2sp3方式杂化,杂化轨道全部用来与AB-形成配位键,则E3+的配位数为
(5)在C和D形成的化合物中,中心原子没有孤电子对的分子的空间构型为
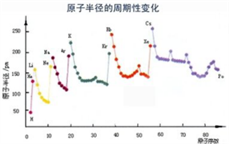
(6)根据下列图片说明为什么同周期过渡金属第一电离能变化没有主族元素变化明显

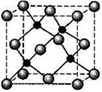
(7)F与D形成的化合物晶胞如图,F的配位数为
(1)基态Br原子的电子排布式为[Ar]
(2)同一条件下,HF的沸点
(3)一种Ag2HgI4固体导电材料为四方晶系,其晶胞参数为apm、apm和2apm,晶胞沿x、y、z的方向投影(如图所示),A、B、C表示三种不同原子的投影,标记为n的原子分数坐标为(
 ,
, ,
, ),则m的原子分数坐标为
),则m的原子分数坐标为
(1)写出基态溴原子的价电子排布式
(2) Mg、Al的氟化物晶格能分别是2957 kJ•mol-1、5492 kJ•mol-1,二者相差很大的原因是
(3) X射线衍射测定等发现,I3AsF6中存在I
 离子。I
离子。I 离子的几何构型为
离子的几何构型为(4) C原子可以形成多种有机物,如图所示是一种吡啶和一种嘌呤的结构,两种分子中所有原子都在一个平面上。

①1mol吡啶分子中含有σ键数目是
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因
③分子中的大π键可以用符号
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为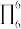 )。该吡啶和嘌呤中都含有大π键,则该吡啶中的大π键表示为
)。该吡啶和嘌呤中都含有大π键,则该吡啶中的大π键表示为(5) CaF2可用于冶金、化工和建材等很多行业,为立方晶胞,结构如下图所示:
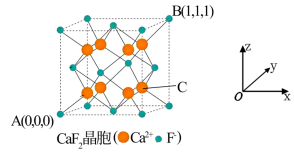
①“ 原子坐标参数”可表示晶胞内部各原子的相对位置,已知A、B两点的原子坐标参数如图所示,则C点的“原子坐标参数”为(
 )
)②已知晶胞参数为0.5462 nm,阿伏加德罗常数的值为NA,则其密度为
(1)A、E形成的化合物E2A4分子中σ键和π键数目之比为
(2)与PH3相比,BA3易液化的主要原因是
(3)BC
 离子的立体构型为
离子的立体构型为 中B原子轨道的杂化类型为
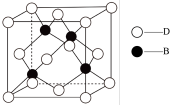
中B原子轨道的杂化类型为(4)化合物DB是人工合成的半导体材料,它的晶胞结构如图所示,其中最近两个D原子的核间距为a cm。该晶体的密度为
(1)基态As原子核外有
(2)已知:4AsH3
 As4+6H2↑,AsH3的空间结构为
As4+6H2↑,AsH3的空间结构为(3)氨、肼(N2H4)和叠氮酸(HN3)都是氮元素的重要氢化物,肼的相对分子质量与乙烷(C2H6)接近,但沸点远高于乙烷的原因是
 cm3。
cm3。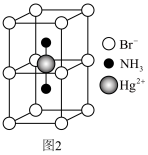
【推荐2】氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1)COCl2的空间构型为
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列
A.CsICl2=CsCl+ICl B.CsICl2=CsI+Cl2
(3)根据表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是
元素 | 氟 | 氯 | 溴 | 碘 |
第一电离能/(kJ·mol-1) | 1681 | 1251 | 1140 | 1008 |
(4)下列分子既不存在“s-p”σ键,也不存在“p-p”π键的是
A.HCl B.HF C.SO2 D.SCl2
(5)已知 为“V”形,中心氯原子周围有4对价层电子。
为“V”形,中心氯原子周围有4对价层电子。 中心氯原子的杂化轨道类型为
中心氯原子的杂化轨道类型为
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示,由此可判断钙的氧化物的化学式为

(1)
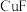 中
中 的基态价电子排布式为
的基态价电子排布式为(2)已知
 、
、 的第二电离能分别为1957.9
的第二电离能分别为1957.9 、1733.3
、1733.3 ,前者高于后者的原因是
,前者高于后者的原因是(3)
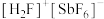 (氟锑酸,是一种超强酸),
(氟锑酸,是一种超强酸), 与N原子同主族,阴离子
与N原子同主族,阴离子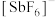 的空间构型为
的空间构型为 中F原子的杂化方式是
中F原子的杂化方式是(4)
 的晶胞如图所示,已知
的晶胞如图所示,已知 晶体的密度为
晶体的密度为 ,相邻的两个
,相邻的两个 的最近核间距为a
的最近核间距为a ,则
,则 的摩尔质量为
的摩尔质量为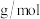 (列出代数式,设
(列出代数式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。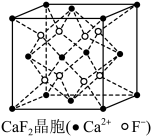
(1)分子中含有两个或两个以上中心原子(离子)的配合物称为多核配合物,如图为Co (II)双核配合物的内界。

①元素Co位于元素周期表中
种。
②下列状态的钴中,失去一个电子所需能量最大的是
A.[Ar]3d74s2 B.[Ar]3d74s1 C.[Ar]3d74s14p1 D.[Ar]3d74p1
③配合物中每个中心离子的配位数为
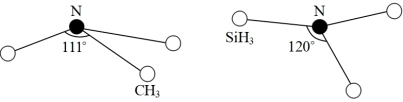
④由于硅的价层有d轨道可以利用,而碳没有,因此它们的化合物结构和性质存在较大差异。化合物N(CH3)3(三角锥形)和N(SiH3)3 (平面形)的结构如图所示,则N(SiH3)3中N的杂化方式为
(2)①有机物甲醛是居室中常见的污染物之一,其结构为
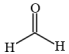 ,其中H—C—H间的键角略小于120°,原因是
,其中H—C—H间的键角略小于120°,原因是②离子化合物
 常温下为液态而非固态,原因是
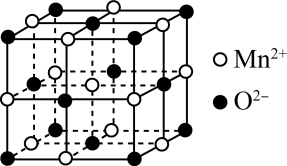
常温下为液态而非固态,原因是(3)一氧化锰在医药、冶炼上应用广泛,其立方晶胞如图所示,晶胞中距离最近的两个O2-之间的距离为a pm, MnO晶体的密度为ρg·cm-3,则阿伏加德罗常数的值为
(1)已知[Co(CN)6]4-是强还原剂,与水反应能生成[Co(CN)6]3-,写出该反应的离子方程式:
(2)已知H2O2难以将Co2+氧化为Co3+,若先将Co2+转化为[Co(NH3)6]2+,则H2O2能快速将其氧化为[Co(NH3)6]3+,该原因是
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:

①NH4CuSO3中金属阳离子的核外电子排布式为
②Cu(NH3)4SO4中所含的化学键有
(2)铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。根据等电子体原理,CO分子的结构式为
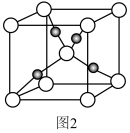
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图1所示),a位置上Cl原子的杂化轨道类型为

(4)Cu2O晶胞结构如图2所示,该晶胞的边长为a cm,则Cu2O的密度为



