1 . 磷锡青铜(一种磷、锡、铜合金)是有名的弹性材料,广泛应用于仪器仪表中耐磨零件和弹性元件。回答下列问题:
(1)白磷(P4)晶体熔点44.1℃、沸点280℃,质软,则白磷属于___________ 晶体(写“分子”、“共价”、“离子”)。
(2)Cu2+与NH3能形成的配离子为___________ (写化学式),该配离子水溶液的颜色为___________ 。该配离子具有对称的空间构型,若其中两个NH3被两个Cl-取代,能得到两种不同结构的产物,则该配离子的空间构型为___________ (填“正四面体”、“平面正方形”)。
(3)PO 中P原子的杂化方式为
中P原子的杂化方式为___________ 杂化,PO 的空间构型为
的空间构型为___________ 。
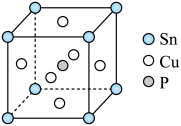
(4)磷锡青铜的立方晶胞结构如图所示,则该晶体的化学式为___________ 。
(1)白磷(P4)晶体熔点44.1℃、沸点280℃,质软,则白磷属于
(2)Cu2+与NH3能形成的配离子为
(3)PO
 中P原子的杂化方式为
中P原子的杂化方式为 的空间构型为
的空间构型为(4)磷锡青铜的立方晶胞结构如图所示,则该晶体的化学式为
您最近一年使用:0次
2 . 短周期元素A、B、C、D的原子序数依次增大,基态A原子核外电子占据3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中σ键和π键数目之比为1∶2,D的最高化合价和最低化合价代数和等于4。
(1)基态B原子的价电子排布图 为______________ ;基态D原子核外电子占据最高能级的电子云轮廓图为_____________ 形。
(2)氯元素与A、B、C元素组成的共价分子ACl3、BCl4、CCl3中,中心原子采用sp2杂化、空间结构为平面三角形的是_________ (填分子式,下同),属于极性分子的是_________ ,键角由大到小的顺序为_____________ 。
(3)(DC)4为热色性固体,且有色温效应,其颜色在低于-30℃时为淡黄色,室温下为橙黄色,高于100℃时为深红色。(DC)4属于_______ 晶体,在淡黄色→橙黄色→深红色的转化中,破坏的作用力是___________ ;在常压下,(DC)4高于130℃分解为相应的单质,这一变化中破坏的作用力是_________ 。
(4)A、C形成立方晶体,晶体结构类似于金刚石,如图所示(白色球代表A原子,黑色球代表C原子)。已知:该晶体边长为a nm,NA代表阿伏加德罗常数的值。_______________ ,晶体性脆的原因是_______________ 。
②该晶体的密度为_____________ g·cm-3(不必化简)。
(1)基态B原子的
(2)氯元素与A、B、C元素组成的共价分子ACl3、BCl4、CCl3中,中心原子采用sp2杂化、空间结构为平面三角形的是
(3)(DC)4为热色性固体,且有色温效应,其颜色在低于-30℃时为淡黄色,室温下为橙黄色,高于100℃时为深红色。(DC)4属于
(4)A、C形成立方晶体,晶体结构类似于金刚石,如图所示(白色球代表A原子,黑色球代表C原子)。已知:该晶体边长为a nm,NA代表阿伏加德罗常数的值。

②该晶体的密度为
您最近一年使用:0次
名校
解题方法
3 . 分子人工光合作用的光捕获原理如图所示,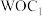 是水氧化催化剂WOC在水氧化过程中产生的中间体,
是水氧化催化剂WOC在水氧化过程中产生的中间体,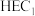 是析氢催化剂HEC在析氢过程中产生的中间体。
是析氢催化剂HEC在析氢过程中产生的中间体。
(1)与Fe元素同周期,基态原子有2个未成对电子的金属元素有___________ 种,下列状态的铁中,电离最外层一个电子所需能量最大的是___________ (填选项)。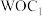 中通过螯合作用形成的配位键有
中通过螯合作用形成的配位键有___________ mol。
(3)在多原子分子中有相互平行的p轨道,它们连贯、重叠在一起,构成一个整体,p电子在多个原子间运动,像这样不局限在两个原子之间的 键称为离域
键称为离域 键,如苯分子中的离域
键,如苯分子中的离域 键可表示为
键可表示为 。N元素形成的两种微粒
。N元素形成的两种微粒 、
、 中,
中, 中的离域
中的离域 键可表示为
键可表示为___________ , 、
、 的键角由大到小的顺序为
的键角由大到小的顺序为_________________________________ 。
(4)水催化氧化是“分子人工光合作用”的关键步骤。水的晶体有普通冰和重冰等不同类型。普通冰的晶胞结构与水分子间的氢键如图甲、乙所示。晶胞参数分别为a pm、c pm,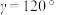 ;标注为1、2、3的氧原子在Z轴的分数坐标分别为:0.375c、0.5c、0.875c。
;标注为1、2、3的氧原子在Z轴的分数坐标分别为:0.375c、0.5c、0.875c。___________ pm。
②普通冰晶体的密度为______________________  (列出数学表达式,不必计算出结果)。
(列出数学表达式,不必计算出结果)。
 是水氧化催化剂WOC在水氧化过程中产生的中间体,
是水氧化催化剂WOC在水氧化过程中产生的中间体, 是析氢催化剂HEC在析氢过程中产生的中间体。
是析氢催化剂HEC在析氢过程中产生的中间体。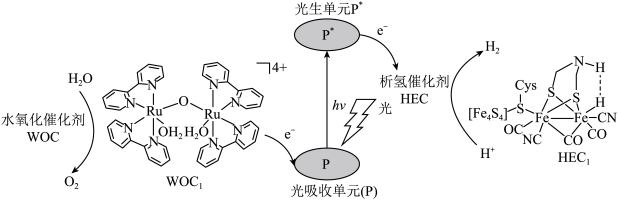
(1)与Fe元素同周期,基态原子有2个未成对电子的金属元素有
A. 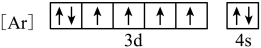
B.
C. 
D.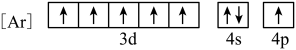
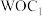 中通过螯合作用形成的配位键有
中通过螯合作用形成的配位键有(3)在多原子分子中有相互平行的p轨道,它们连贯、重叠在一起,构成一个整体,p电子在多个原子间运动,像这样不局限在两个原子之间的
 键称为离域
键称为离域 键,如苯分子中的离域
键,如苯分子中的离域 键可表示为
键可表示为 。N元素形成的两种微粒
。N元素形成的两种微粒 、
、 中,
中, 中的离域
中的离域 键可表示为
键可表示为 、
、 的键角由大到小的顺序为
的键角由大到小的顺序为(4)水催化氧化是“分子人工光合作用”的关键步骤。水的晶体有普通冰和重冰等不同类型。普通冰的晶胞结构与水分子间的氢键如图甲、乙所示。晶胞参数分别为a pm、c pm,
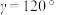 ;标注为1、2、3的氧原子在Z轴的分数坐标分别为:0.375c、0.5c、0.875c。
;标注为1、2、3的氧原子在Z轴的分数坐标分别为:0.375c、0.5c、0.875c。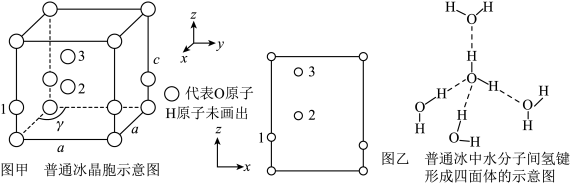
②普通冰晶体的密度为
 (列出数学表达式,不必计算出结果)。
(列出数学表达式,不必计算出结果)。
您最近一年使用:0次
名校
解题方法
4 .  、
、 是重要的电极材料,回答下列问题:
是重要的电极材料,回答下列问题:
(1)基态Co原子的价电子中,两种自旋状态的电子数之比为___________ 。
(2)Co(Ⅲ)可形成多种配合物。
①已知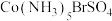 中Co(Ⅲ)的配位数为6,向该配合物的溶液中滴加
中Co(Ⅲ)的配位数为6,向该配合物的溶液中滴加 溶液无明显现象,滴加
溶液无明显现象,滴加 溶液有淡黄色沉淀生成,则该配合物可表示为
溶液有淡黄色沉淀生成,则该配合物可表示为______________________ 。
② 结构如图所示,
结构如图所示, 位于正八面体中心,若其中两个
位于正八面体中心,若其中两个 被
被 取代,则
取代,则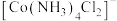 的空间结构有
的空间结构有___________ 种。 的结构如下图,该配合物中存在的作用力类型有
的结构如下图,该配合物中存在的作用力类型有___________ (填标号)。
(3) 、
、 在合成化学上应用广泛。
在合成化学上应用广泛。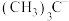 的空间结构为
的空间结构为___________ ;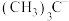 、
、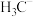 、
、 的稳定性随中心C原子上电子云密度增大而减小,其中稳定性最强的是
的稳定性随中心C原子上电子云密度增大而减小,其中稳定性最强的是______________ 。
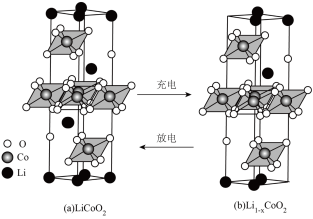
(4)①正极材料 的晶胞结构如图(a(部分O位于晶胞之外),每个晶胞中含有
的晶胞结构如图(a(部分O位于晶胞之外),每个晶胞中含有___________ 个O;充电时, 脱出部分
脱出部分 ,形成
,形成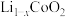 ,结构如图(b)则
,结构如图(b)则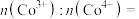
___________ 。 晶胞结构如图(c),
晶胞结构如图(c), 原子插入石墨层中间,若该晶胞中碳碳键键长为m pm。石墨层间距为n pm。该晶体的密度为
原子插入石墨层中间,若该晶胞中碳碳键键长为m pm。石墨层间距为n pm。该晶体的密度为______________________  (用
(用 表示阿伏伽德罗常数的值)。
表示阿伏伽德罗常数的值)。
 、
、 是重要的电极材料,回答下列问题:
是重要的电极材料,回答下列问题:(1)基态Co原子的价电子中,两种自旋状态的电子数之比为
(2)Co(Ⅲ)可形成多种配合物。
①已知
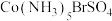 中Co(Ⅲ)的配位数为6,向该配合物的溶液中滴加
中Co(Ⅲ)的配位数为6,向该配合物的溶液中滴加 溶液无明显现象,滴加
溶液无明显现象,滴加 溶液有淡黄色沉淀生成,则该配合物可表示为
溶液有淡黄色沉淀生成,则该配合物可表示为②
 结构如图所示,
结构如图所示, 位于正八面体中心,若其中两个
位于正八面体中心,若其中两个 被
被 取代,则
取代,则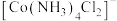 的空间结构有
的空间结构有
 的结构如下图,该配合物中存在的作用力类型有
的结构如下图,该配合物中存在的作用力类型有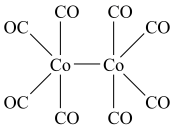
(3)
 、
、 在合成化学上应用广泛。
在合成化学上应用广泛。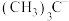 的空间结构为
的空间结构为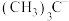 、
、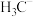 、
、 的稳定性随中心C原子上电子云密度增大而减小,其中稳定性最强的是
的稳定性随中心C原子上电子云密度增大而减小,其中稳定性最强的是(4)①正极材料
 的晶胞结构如图(a(部分O位于晶胞之外),每个晶胞中含有
的晶胞结构如图(a(部分O位于晶胞之外),每个晶胞中含有 脱出部分
脱出部分 ,形成
,形成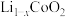 ,结构如图(b)则
,结构如图(b)则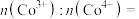
 晶胞结构如图(c),
晶胞结构如图(c), 原子插入石墨层中间,若该晶胞中碳碳键键长为m pm。石墨层间距为n pm。该晶体的密度为
原子插入石墨层中间,若该晶胞中碳碳键键长为m pm。石墨层间距为n pm。该晶体的密度为 (用
(用 表示阿伏伽德罗常数的值)。
表示阿伏伽德罗常数的值)。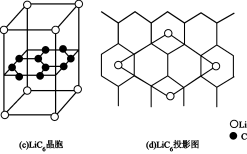
您最近一年使用:0次
名校
解题方法
5 . I.镍、锌等金属及其化合物在工业上有重要用途。回答下列问题:
(1)镍能形成多种配合物,其中K2[Ni(CO)4] 和 Ni(CO)4的相关信息如下:
①K2[Ni(CO)4]熔点高于Ni(CO)4的原因是___________ 。
②Ni(CO)4为___________ 分子(填“极性”或“非极性”);Ni提供的空轨道数目为___________ 。
(2)在催化作用下,呋喃(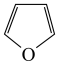 )可与氨反应,转化为吡咯(
)可与氨反应,转化为吡咯(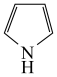 )。写出呋喃中的大π键
)。写出呋喃中的大π键___________ ,二者熔、沸点关系为呋喃___________ 吡咯(填“高于”或“低于”)。
II.抗坏血酸的分子结构如图所示。___________ ;其___________ (填“易”或“难”)溶于水,原因是___________ 。
(1)镍能形成多种配合物,其中K2[Ni(CO)4] 和 Ni(CO)4的相关信息如下:
| 配合物 | 状态 | 溶解性 |
| Ni(CO)4 | 无色易挥发性液体 | 不溶于水,易溶于苯、四氯化碳等有机溶剂 |
| K2[Ni(CO)4] | 红黄色单斜晶体 | 易溶于水 |
②Ni(CO)4为
(2)在催化作用下,呋喃(
 )可与氨反应,转化为吡咯(
)可与氨反应,转化为吡咯( )。写出呋喃中的大π键
)。写出呋喃中的大π键II.抗坏血酸的分子结构如图所示。

您最近一年使用:0次
名校
解题方法
6 . 我国科学家开发的 催化剂可实现
催化剂可实现 还原制
还原制 ,为资源回收利用提供新思路。请回答下列问题:
,为资源回收利用提供新思路。请回答下列问题:
(1)基态N原子的价层电子的轨道表示式为_______ 。
(2)题述物质所含的第二周期元素中,第一电离能由大到小的顺序为_______ (填元素符号,下同);电负性由小到大的顺序为_______ 。
(3)氨硼烷 是一种新型储氢材料。
是一种新型储氢材料。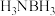 分子中B原子的杂化方式为
分子中B原子的杂化方式为_______ 。
(4)已知: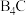 (碳化硼)、
(碳化硼)、 (氮化硼)的熔点依次为
(氮化硼)的熔点依次为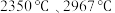 ,这两种物质的熔点存在差异的主要原因是
,这两种物质的熔点存在差异的主要原因是_______ 。
(5)已知 的晶胞结构如图1所示,该晶胞中含有的阳离子数为
的晶胞结构如图1所示,该晶胞中含有的阳离子数为_______ ,阳离子的配位数为_______ 。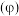 为
为_______ (用含π的式子表示);
②图3中晶胞的空间利用率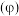 为
为_______ (用含%表示,保留2位有效数字,已知 =3.14,
=3.14, =1.414,
=1.414,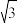 =1.732);
=1.732);
③已知图3中晶胞底边长为 ,高为
,高为 ,
, 代表阿伏加德罗常数的值,则该晶胞的密度为
代表阿伏加德罗常数的值,则该晶胞的密度为_______  (用含
(用含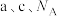 的式子表示)。
的式子表示)。
 催化剂可实现
催化剂可实现 还原制
还原制 ,为资源回收利用提供新思路。请回答下列问题:
,为资源回收利用提供新思路。请回答下列问题:(1)基态N原子的价层电子的轨道表示式为
(2)题述物质所含的第二周期元素中,第一电离能由大到小的顺序为
(3)氨硼烷
 是一种新型储氢材料。
是一种新型储氢材料。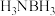 分子中B原子的杂化方式为
分子中B原子的杂化方式为(4)已知:
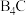 (碳化硼)、
(碳化硼)、 (氮化硼)的熔点依次为
(氮化硼)的熔点依次为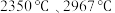 ,这两种物质的熔点存在差异的主要原因是
,这两种物质的熔点存在差异的主要原因是(5)已知
 的晶胞结构如图1所示,该晶胞中含有的阳离子数为
的晶胞结构如图1所示,该晶胞中含有的阳离子数为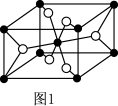
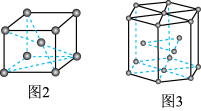
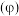 为
为②图3中晶胞的空间利用率
 为
为 =3.14,
=3.14, =1.414,
=1.414,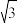 =1.732);
=1.732);③已知图3中晶胞底边长为
 ,高为
,高为 ,
, 代表阿伏加德罗常数的值,则该晶胞的密度为
代表阿伏加德罗常数的值,则该晶胞的密度为 (用含
(用含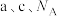 的式子表示)。
的式子表示)。
您最近一年使用:0次
名校
解题方法
7 . 根据要求回答下列问题:
(1)LiAlH4是有机合成中常用的还原剂,LiAlH4中阴离子的空间构型是___________ ,中心原子的杂化类型为___________ 。
(2)碳氧化物、氨氧化物、二氧化硫的处理和应用是世界各国研究的热点问题。SO2的VSEPR模型为___________ ;SO3的中心原子的杂化类型为___________ ;N2O与CO2互为等电子体,且N2O中O只与一个N相连,分子中的σ键和π键数目之比是___________ 。
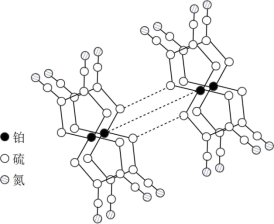
(3)某研究小组将平面形的铂配合物分子进行层状堆砌,使每个分子中的铂原子在某一方向上排列成行,构成能导电的“分子金属”,其结构如图所示。___________ 能沿着其中的金属原子链流动。
(1)LiAlH4是有机合成中常用的还原剂,LiAlH4中阴离子的空间构型是
(2)碳氧化物、氨氧化物、二氧化硫的处理和应用是世界各国研究的热点问题。SO2的VSEPR模型为
(3)某研究小组将平面形的铂配合物分子进行层状堆砌,使每个分子中的铂原子在某一方向上排列成行,构成能导电的“分子金属”,其结构如图所示。
您最近一年使用:0次
解题方法
8 . 硫铝酸钙化学式为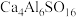 ,可写成
,可写成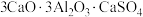 ,是一种常用的混凝土膨胀剂。回答下列问题:
,是一种常用的混凝土膨胀剂。回答下列问题:
(1)基态氧原子的价电子排布图为 ,而不是
,而不是 ,因为核外电子排布应遵循
,因为核外电子排布应遵循_____ (填“泡利原理”或“洪特规则”)。基态Ca原子核外电子占据的最高能层符号是_____ 。
(2) 的中心原子杂化方式为
的中心原子杂化方式为_____ , 可看成是
可看成是 中的一个氧原子被硫原子所替代,则
中的一个氧原子被硫原子所替代,则 -的VSEPR模型名称为
-的VSEPR模型名称为_____ 。
(3)Al的性质与Be的性质相似,可知熔点:
_____  (填“>”或“<”),理由是
(填“>”或“<”),理由是_____ 。
(4)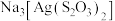 中存在的作用力有
中存在的作用力有_____ 。
A.离子键 B.共价键 C.范德华力 D.金属键 E.配位键
(5)在空气中灼烧 生成Ag和
生成Ag和 ,
, 分子空间构型为
分子空间构型为_____ ;与 相比,
相比, 的键角更
的键角更_____ (“大”、“小”、“相等”)。
(6)如图是金属氢化物储氢材料,其晶胞如图所示,其化学式为_____ ,已知该晶体的密度为 ,则该晶胞的体积为
,则该晶胞的体积为_____  (用含
(用含 、
、 的代数式表示)
的代数式表示)
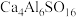 ,可写成
,可写成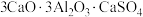 ,是一种常用的混凝土膨胀剂。回答下列问题:
,是一种常用的混凝土膨胀剂。回答下列问题:(1)基态氧原子的价电子排布图为
 ,而不是
,而不是 ,因为核外电子排布应遵循
,因为核外电子排布应遵循(2)
 的中心原子杂化方式为
的中心原子杂化方式为 可看成是
可看成是 中的一个氧原子被硫原子所替代,则
中的一个氧原子被硫原子所替代,则 -的VSEPR模型名称为
-的VSEPR模型名称为(3)Al的性质与Be的性质相似,可知熔点:

 (填“>”或“<”),理由是
(填“>”或“<”),理由是(4)
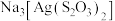 中存在的作用力有
中存在的作用力有A.离子键 B.共价键 C.范德华力 D.金属键 E.配位键
(5)在空气中灼烧
 生成Ag和
生成Ag和 ,
, 分子空间构型为
分子空间构型为 相比,
相比, 的键角更
的键角更(6)如图是金属氢化物储氢材料,其晶胞如图所示,其化学式为
 ,则该晶胞的体积为
,则该晶胞的体积为 (用含
(用含 、
、 的代数式表示)
的代数式表示)
您最近一年使用:0次
9 . 金属羰基配位化合物在催化反应中有着重要应用。HMn(CO)5是锰的一种简单羰基配位化合物,其结构示意图如下。

回答问题:
(1)基态锰原子的价层电子排布式为_______ 。
(2)配位化合物中的中心原子配位数是指和中心原子直接成键的原子的数目。HMn(CO)5中锰原子的配位数为_______ 。
(3)第一电离能的大小:C_______ O(填“大于”或“小于”)。
(4) 中碳原子的杂化轨道类型是
中碳原子的杂化轨道类型是_______ ,写出一种与具有相同空间结构的-1价无机酸根离子的化学式_______ 。
(5)CH3Mn(CO)5可看作是HMn(CO)5中的氢原子被甲基取代的产物。CH3Mn(CO)5与I2反应可用于制备CH3I,反应前后锰的配位数不变,CH3Mn(CO)5与I2反应的化学方程式为_______ 。
(6)MnS晶胞与NaCl晶胞属于同种类型,如图所示。前者的熔点明显高于后者,其主要原因是_______ 。


回答问题:
(1)基态锰原子的价层电子排布式为
(2)配位化合物中的中心原子配位数是指和中心原子直接成键的原子的数目。HMn(CO)5中锰原子的配位数为
(3)第一电离能的大小:C
(4)
 中碳原子的杂化轨道类型是
中碳原子的杂化轨道类型是(5)CH3Mn(CO)5可看作是HMn(CO)5中的氢原子被甲基取代的产物。CH3Mn(CO)5与I2反应可用于制备CH3I,反应前后锰的配位数不变,CH3Mn(CO)5与I2反应的化学方程式为
(6)MnS晶胞与NaCl晶胞属于同种类型,如图所示。前者的熔点明显高于后者,其主要原因是

您最近一年使用:0次
解题方法
10 . 乙炔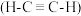 是有机合成工业的一种重要原料。下列两种方法可生产乙炔。
是有机合成工业的一种重要原料。下列两种方法可生产乙炔。
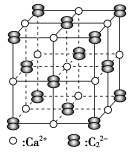
碳化钙晶胞示意图: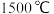 电弧中经极短时间加热分解产生乙炔。
电弧中经极短时间加热分解产生乙炔。
①反应的化学方程式为_______ 。
②上述反应中碳原子轨道杂化类型的变化为_______ 。
③乙炔分子中 键和
键和 键数目之比为
键数目之比为_______ 。
(2)工业上曾用电石(主要成分为碳化钙)与水反应生成乙炔。
① 基态核外电子排布式为
基态核外电子排布式为_______ 。
②碳化钙晶体中哑铃形 的存在,使晶胞沿一个方向拉长。碳化钙晶体中1个
的存在,使晶胞沿一个方向拉长。碳化钙晶体中1个 周围距离
周围距离最近 的 围成的几何图形为
围成的几何图形为_______ (填正方形、正四面体或正八面体)。
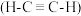 是有机合成工业的一种重要原料。下列两种方法可生产乙炔。
是有机合成工业的一种重要原料。下列两种方法可生产乙炔。碳化钙晶胞示意图:
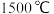 电弧中经极短时间加热分解产生乙炔。
电弧中经极短时间加热分解产生乙炔。①反应的化学方程式为
②上述反应中碳原子轨道杂化类型的变化为
③乙炔分子中
 键和
键和 键数目之比为
键数目之比为(2)工业上曾用电石(主要成分为碳化钙)与水反应生成乙炔。
①
 基态核外电子排布式为
基态核外电子排布式为②碳化钙晶体中哑铃形
 的存在,使晶胞沿一个方向拉长。碳化钙晶体中1个
的存在,使晶胞沿一个方向拉长。碳化钙晶体中1个 周围距离
周围距离 围成的几何图形为
围成的几何图形为
您最近一年使用:0次



