乙炔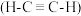 是有机合成工业的一种重要原料。下列两种方法可生产乙炔。
是有机合成工业的一种重要原料。下列两种方法可生产乙炔。
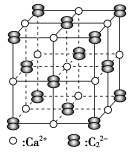
碳化钙晶胞示意图: 电弧中经极短时间加热分解产生乙炔。
电弧中经极短时间加热分解产生乙炔。
①反应的化学方程式为_______ 。
②上述反应中碳原子轨道杂化类型的变化为_______ 。
③乙炔分子中 键和
键和 键数目之比为
键数目之比为_______ 。
(2)工业上曾用电石(主要成分为碳化钙)与水反应生成乙炔。
① 基态核外电子排布式为
基态核外电子排布式为_______ 。
②碳化钙晶体中哑铃形 的存在,使晶胞延一个方向拉长。碳化钙晶体中1个
的存在,使晶胞延一个方向拉长。碳化钙晶体中1个 周围距离
周围距离最近 的 围成的几何图形为
围成的几何图形为_______ (填正方形、正四面体或正八面体)。
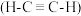 是有机合成工业的一种重要原料。下列两种方法可生产乙炔。
是有机合成工业的一种重要原料。下列两种方法可生产乙炔。碳化钙晶胞示意图:
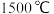 电弧中经极短时间加热分解产生乙炔。
电弧中经极短时间加热分解产生乙炔。①反应的化学方程式为
②上述反应中碳原子轨道杂化类型的变化为
③乙炔分子中
 键和
键和 键数目之比为
键数目之比为(2)工业上曾用电石(主要成分为碳化钙)与水反应生成乙炔。
①
 基态核外电子排布式为
基态核外电子排布式为②碳化钙晶体中哑铃形
 的存在,使晶胞延一个方向拉长。碳化钙晶体中1个
的存在,使晶胞延一个方向拉长。碳化钙晶体中1个 周围距离
周围距离 围成的几何图形为
围成的几何图形为
更新时间:2024-04-26 12:02:31
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
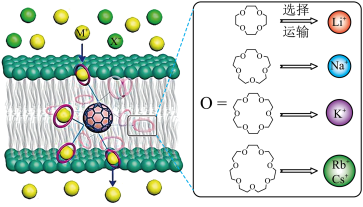
【推荐1】科学家借用 核心,成功实现了高效且选择性可精准定制的离子跨膜运输,如图甲所示。图甲中的有机物为“冠醚”命名规则是“环上原子的个数-冠(醚)-氧原子的个数”。几种冠醚与识别的碱金属离子的有关数据如下表所示。回答下列问题:
核心,成功实现了高效且选择性可精准定制的离子跨膜运输,如图甲所示。图甲中的有机物为“冠醚”命名规则是“环上原子的个数-冠(醚)-氧原子的个数”。几种冠醚与识别的碱金属离子的有关数据如下表所示。回答下列问题:
回答下列问题:
(1)基态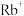 的最外层电子排布式为
的最外层电子排布式为_________ 。
(2)运输 的冠醚的名称是
的冠醚的名称是_________ 。冠醚与碱金属离子之间存在微弱的配位键,配位原子的杂化轨道类型是_________ 。
(3)18-冠-6不能识别和运输 和
和 的原因是
的原因是_________ 。图甲中冠醚不能识别和运输X-的主要原因可能是_________ 。
(4) 的结构如图乙所示。1mol
的结构如图乙所示。1mol 含
含_________ mol  键。
键。

(5) 铷晶胞为体心立方堆积,其原子的空间利用率为_________ (用含π的式子表示)。晶胞参数为a pm,设NA为阿伏加德罗常数的值,则物的密度为_________ 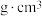 (列计算表达式)。
(列计算表达式)。
 核心,成功实现了高效且选择性可精准定制的离子跨膜运输,如图甲所示。图甲中的有机物为“冠醚”命名规则是“环上原子的个数-冠(醚)-氧原子的个数”。几种冠醚与识别的碱金属离子的有关数据如下表所示。回答下列问题:
核心,成功实现了高效且选择性可精准定制的离子跨膜运输,如图甲所示。图甲中的有机物为“冠醚”命名规则是“环上原子的个数-冠(醚)-氧原子的个数”。几种冠醚与识别的碱金属离子的有关数据如下表所示。回答下列问题:
甲
| 冠醚 | 冠醚空腔的直径/pm | 适合的粒子(直径)/pm |
| 12-冠-4 | 120~150 |  (152) (152) |
| 15-冠-5 | 170~220 |  (204) (204) |
| 18-冠-6 | 260~320 |  (276) (276) |
| _______ | 340~430 | 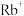 (304) (304) |
 (334) (334) |
(1)基态
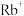 的最外层电子排布式为
的最外层电子排布式为(2)运输
 的冠醚的名称是
的冠醚的名称是(3)18-冠-6不能识别和运输
 和
和 的原因是
的原因是(4)
 的结构如图乙所示。1mol
的结构如图乙所示。1mol 含
含 键。
键。
(5) 铷晶胞为体心立方堆积,其原子的空间利用率为
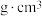 (列计算表达式)。
(列计算表达式)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】利用水热和有机溶剂等软化学方法,可合成出含有有机杂化锌、锗以及砷等金属的硒化物,且该硒化物具有离子交换、催化、吸附、半导体等性能,显示出良好的应用前景。回答下列问题:
(1)锌基态原子核外电子排布式为:___________________ 。
(2)元素锗与砷中,第一电离能较大的是:___________________ (填元素符号)。
(3)SeO32-离子中Se原子的杂化形式为:_____________ ,气态SeO3分子的立体构型为:__________ ,与SeO3互为等电子体的一种离子为:_________________ 。(填离子符号)。
(4)硒化锌是一种重要的半导体材料,其晶胞结构如下图所示(a代表Zn,b代表Se),该晶胞中Se原子周围与之紧邻的其他Se原子数为:_______________________ 。

(1)锌基态原子核外电子排布式为:
(2)元素锗与砷中,第一电离能较大的是:
(3)SeO32-离子中Se原子的杂化形式为:
(4)硒化锌是一种重要的半导体材料,其晶胞结构如下图所示(a代表Zn,b代表Se),该晶胞中Se原子周围与之紧邻的其他Se原子数为:

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】已知A、B、C、D、E为元素周期表中前四周期元素,且原子序数依次增大。A是短周期中原子半径最大的元素;B元素3p能级半充满,C是所在周期电负性最大的元素;D是第四周期未成对电子最多的元素;E元素位于元素周期表的第11列。试回答下列有关的问题:
(1)写出基态D原子的价电子排布式:_______ ,E元素位于元素周期表_______ 。
(2)A、B、C三种元素的第一电离能最大的是_______ (用素符号表示)。这三种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是_______ (写化学式)。
(3)D可形成化合物 。
。
① 中配位体的VSEPR模型名称是
中配位体的VSEPR模型名称是_______ 。该化合物中阴离子的中心原子的轨道杂化类型为_______ 。
②1个 中含有的
中含有的 键数目为
键数目为_______ 。
(4)已知B、C两种元素形成的化合物通常有两种。这两种化合物中_______ (填化学式)为非极性分子,另一种化合物的电子式为_______ 。
(5) 能与
能与 形成
形成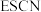 沉淀。
沉淀。 对应的酸有硫氰酸(
对应的酸有硫氰酸( )和异硫氰酸(
)和异硫氰酸( ),这两种酸沸点更高的是
),这两种酸沸点更高的是_______ (填名称),原因是_______ 。
(6)由A、C两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看作刚性圆球,并彼此“相切”。如图所示为A、C形成化合物的晶胞结构图以及晶胞的截面图,晶胞中距离一个 最近的
最近的 围成的图形是
围成的图形是_______ (写名称)。若晶体密度为 ,阿伏加德罗常数的值用
,阿伏加德罗常数的值用 表示,则
表示,则 的半径为
的半径为_______  (用含
(用含 与
与 的式子表达)。
的式子表达)。
(1)写出基态D原子的价电子排布式:
(2)A、B、C三种元素的第一电离能最大的是
(3)D可形成化合物
 。
。①
 中配位体的VSEPR模型名称是
中配位体的VSEPR模型名称是②1个
 中含有的
中含有的 键数目为
键数目为(4)已知B、C两种元素形成的化合物通常有两种。这两种化合物中
(5)
 能与
能与 形成
形成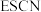 沉淀。
沉淀。 对应的酸有硫氰酸(
对应的酸有硫氰酸( )和异硫氰酸(
)和异硫氰酸( ),这两种酸沸点更高的是
),这两种酸沸点更高的是(6)由A、C两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看作刚性圆球,并彼此“相切”。如图所示为A、C形成化合物的晶胞结构图以及晶胞的截面图,晶胞中距离一个
 最近的
最近的 围成的图形是
围成的图形是 ,阿伏加德罗常数的值用
,阿伏加德罗常数的值用 表示,则
表示,则 的半径为
的半径为 (用含
(用含 与
与 的式子表达)。
的式子表达)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】第四周期有18种元素,其相关化合物在化工、医药、材料等领域均有着广泛的应用。请回答下列问题:
(1)基态钙原子核外电子云形状为____________ ,电子占据的最高能层符号是____________ 。
(2)五氧化二钒(V2O5)是硫酸工业中重要的催化剂,基态钒原子的价电子排布式为____________ 。
(3)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,其中“亚铁”是关键成分,K3[Fe(CN)6]溶液是检验Fe2+的试剂,1molCN-中含π键的数目为____________ ,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+易被氧化成Fe3+的原因是____________ 。
(4)镓、锗、砷、硒的第一电离能由大到小的顺序为____________ (用元素符号表示);其中锗的化合物四氯化锗可用作光导纤维渗杂剂,其熔点为-49.5℃,沸点为83.1℃,则其晶体类型为____________ ,中心原子的杂化类型为____________ ;砷酸酸性弱于硒酸,从分子结构的角度解释原因____________ ;砷化硼是一种新型材料,或成为最好的热导体,其结构与金刚石相似,已知砷化硼晶胞参数为bpm,则该晶体的密度为____________ g ·cm-3。(NA表示阿伏伽德罗常数的值)。
(1)基态钙原子核外电子云形状为
(2)五氧化二钒(V2O5)是硫酸工业中重要的催化剂,基态钒原子的价电子排布式为
(3)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,其中“亚铁”是关键成分,K3[Fe(CN)6]溶液是检验Fe2+的试剂,1molCN-中含π键的数目为
(4)镓、锗、砷、硒的第一电离能由大到小的顺序为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】含碳物质具有许多优良性质。
(一)2010年诺贝尔物理学奖所指向的是碳的又一张奇妙脸孔:人类已知的最薄材料——石墨烯。

(1)下列说法中,正确的是________。
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜等或合金,含碳源可以是乙炔、苯、乙醇等中的一种或任意组合。
①乙醇和二甲醚(H3C—O—CH3)是同分异构体,二甲醚的沸点比乙醇________ (填“高”或“低”),原因是________ 。
②铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是_______________________ 。
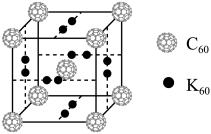
(二)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
(3)已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为 145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确,并阐述理由________ 。
(4)科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为________ 。
(5)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是________ ,Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为________ 。
(一)2010年诺贝尔物理学奖所指向的是碳的又一张奇妙脸孔:人类已知的最薄材料——石墨烯。

(1)下列说法中,正确的是________。
| A.固态时,碳的各种单质的晶体类型相同 |
| B.石墨烯只含有非极性键 |
| C.从石墨剥离得石墨烯需要破坏化学键 |
| D.石墨烯具有导电性 |
①乙醇和二甲醚(H3C—O—CH3)是同分异构体,二甲醚的沸点比乙醇
②铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是
(二)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
(3)已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为 145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确,并阐述理由
(4)科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为

(5)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是
您最近一年使用:0次
【推荐3】Li、Fe、As均为重要的合金材料,NA为阿伏加 德罗常数的值。回答下列问题:
(1)基态Li原子核外电子占据的空间运动状态有________ 个,占据最高能层电子的电子云轮廓图形状为_________ 。
(2)Li的焰色反应为紫红色,很多金属元素能产生焰色反应的原因为_________ 。
(3)基态Fe3+比基态Fe2+稳定的原因为____________ 。
(4)KSCN和K4[Fe(CN)6]均可用于检验Fe3+。
①SCN-的立体构型为_______ ,碳原子的杂化方式为_____________ 。
②K4[Fe(CN)6]中所含元素的第一电离能由大到小的顺序为__________ (用元素符号表示);1 mol [Fe(CN)6]4-中含有σ键的数目为____________ 。
(5)H3AsO3的酸性弱于H3AsO4的原因为____________________ 。
(6)Li、Fe和As可组成一种新型材料,其立方晶胞结构如图所示。若晶胞参数为a nm,阿伏加 德罗常数的值为NA,则该晶体的密度可表示为______ g●cm-3。(列式即可)

(1)基态Li原子核外电子占据的空间运动状态有
(2)Li的焰色反应为紫红色,很多金属元素能产生焰色反应的原因为
(3)基态Fe3+比基态Fe2+稳定的原因为
(4)KSCN和K4[Fe(CN)6]均可用于检验Fe3+。
①SCN-的立体构型为
②K4[Fe(CN)6]中所含元素的第一电离能由大到小的顺序为
(5)H3AsO3的酸性弱于H3AsO4的原因为
(6)Li、Fe和As可组成一种新型材料,其立方晶胞结构如图所示。若晶胞参数为a nm,阿伏加 德罗常数的值为NA,则该晶体的密度可表示为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】实验室常利用“棕色环”现象检验NO3—离子。其方法为:取含有NO3—的溶液于试管中,加入FeSO4溶液振荡,然后沿着试管内壁加入浓H2SO4,在溶液的界面上出现“棕色环”。回答下列问题:
(1)基态Fe2+核外未成对电子个数为_____ 。
(2)形成“棕色环”主要发生如下反应:
3[Fe( H2O)6]2++ NO3-+4H+=3[Fe(H2O)6]3++ NO ↑+2H2O
[Fe( H2O)6]2++ NO=[Fe(NO) (H2O)5]2+(棕色)+ H2O
[Fe(NO)(H2O)5]2+中,配体是______ 、______ ,配位数为______ 。
(3)与NO互为等电子体的微粒是_____ (任写一例)。
(4)SO42-的空间构型是_____ ,其中S原子的杂化方式是________ 。
(5)铁原子在不同温度下排列构成不同晶体结构,在912℃以下排列构成的晶体叫做α-铁;在912℃至1394℃之间排列构成的晶体叫做γ-铁;在1394℃以上排列构成的晶体,叫做δ-铁。晶胞剖面结构如图所示:

①α-铁的原子堆积方式为_____ 。δ-铁配位数为____ 。
②已知γ-铁晶体密度为d g/cm3,则Fe原子的半径为____ nm(用含d、NA的式子表示)。
(1)基态Fe2+核外未成对电子个数为
(2)形成“棕色环”主要发生如下反应:
3[Fe( H2O)6]2++ NO3-+4H+=3[Fe(H2O)6]3++ NO ↑+2H2O
[Fe( H2O)6]2++ NO=[Fe(NO) (H2O)5]2+(棕色)+ H2O
[Fe(NO)(H2O)5]2+中,配体是
(3)与NO互为等电子体的微粒是
(4)SO42-的空间构型是
(5)铁原子在不同温度下排列构成不同晶体结构,在912℃以下排列构成的晶体叫做α-铁;在912℃至1394℃之间排列构成的晶体叫做γ-铁;在1394℃以上排列构成的晶体,叫做δ-铁。晶胞剖面结构如图所示:

①α-铁的原子堆积方式为
②已知γ-铁晶体密度为d g/cm3,则Fe原子的半径为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】回答下列问题:
(1)Xe是第五周期的稀有气体元素,与 形成的
形成的 室温下易升华。
室温下易升华。 中心原子的价层电子对数为
中心原子的价层电子对数为_______ ,下列对 中心原子杂化方式推断合理的是
中心原子杂化方式推断合理的是_______ (填标号)。
A. B.
B. C.
C. D.
D.
(2)已知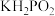 是次磷酸的正盐,
是次磷酸的正盐, 的结构式为
的结构式为_______ ,其中P采取_______ 杂化方式。
(3)氨硼烷在催化剂作用下水解释放氢气: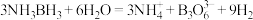 。
。 的结构为
的结构为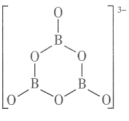 。在该反应中,B原子的杂化轨道类型由
。在该反应中,B原子的杂化轨道类型由_______ 变为_______ 。
(4)乙二胺 是一种有机化合物,分子中氮、碳的杂化类型分别是
是一种有机化合物,分子中氮、碳的杂化类型分别是_______ 、_______ 。
(1)Xe是第五周期的稀有气体元素,与
 形成的
形成的 室温下易升华。
室温下易升华。 中心原子的价层电子对数为
中心原子的价层电子对数为 中心原子杂化方式推断合理的是
中心原子杂化方式推断合理的是A.
 B.
B. C.
C. D.
D.
(2)已知
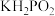 是次磷酸的正盐,
是次磷酸的正盐, 的结构式为
的结构式为(3)氨硼烷在催化剂作用下水解释放氢气:
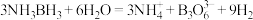 。
。 的结构为
的结构为 。在该反应中,B原子的杂化轨道类型由
。在该反应中,B原子的杂化轨道类型由(4)乙二胺
 是一种有机化合物,分子中氮、碳的杂化类型分别是
是一种有机化合物,分子中氮、碳的杂化类型分别是
您最近一年使用:0次
【推荐3】我国科学家首次报道了双金属Cu/Ni催化剂催化醛亚胺酯的不对称苄基化反应,获得了一系列含有苄基(-CH2C6H5)取代的季碳氨基酸衍生物。这是双金属催化剂在不对称合成领域的重大突破。
(1)基态Cu原子中,电子占据的最高能层的符号为_______ ,该能层具有的原子轨道数为_______ 。CuCl2在火焰上灼烧时火焰的颜色为绿色,从微观角度解释部分金属元素在火焰上灼烧呈现特殊颜色的原因_______ 。
(2)4-氯卞氯(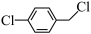 )可用于有机合成中间体。
)可用于有机合成中间体。
①L-苯丙氨酸( )分子中C、N、O三种元素原子的第一电离能由大到小的顺序为
)分子中C、N、O三种元素原子的第一电离能由大到小的顺序为_______ 。
②沸点比较:4-氯卞氯_______ (填“>”、“<”或“=”)L—苯丙氨酸(填“>”、“<”或“=”),主要原因为_______ 。
(3)[Ni(NH3)6]SO4晶体中,1 mol配离子含有的σ键个数为_______ 个, 的空间构型为
的空间构型为_______ 。
(4)Ni和La的合金是目前广泛使用的储氢材料,该合金的晶胞结构如图所示。已知该晶体摩尔质量为M g/mol,密度为d g/cm3,La元素和Ni元素的原子半径分别为r1cm、r2 cm。设NA为阿伏加德罗常数的值,则该晶体中原子的空间利用率(空间利用率:构成晶体的粒子总体积在整个晶体空间所占有的体积百分比)为_______ (写出表达式即可)。

(1)基态Cu原子中,电子占据的最高能层的符号为
(2)4-氯卞氯(
 )可用于有机合成中间体。
)可用于有机合成中间体。①L-苯丙氨酸(
 )分子中C、N、O三种元素原子的第一电离能由大到小的顺序为
)分子中C、N、O三种元素原子的第一电离能由大到小的顺序为②沸点比较:4-氯卞氯
(3)[Ni(NH3)6]SO4晶体中,1 mol配离子含有的σ键个数为
 的空间构型为
的空间构型为(4)Ni和La的合金是目前广泛使用的储氢材料,该合金的晶胞结构如图所示。已知该晶体摩尔质量为M g/mol,密度为d g/cm3,La元素和Ni元素的原子半径分别为r1cm、r2 cm。设NA为阿伏加德罗常数的值,则该晶体中原子的空间利用率(空间利用率:构成晶体的粒子总体积在整个晶体空间所占有的体积百分比)为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】三元锂电池性能优异、能量密度高,正极材料包含了Ni、Co、Mn三种过渡金属的氧化物。
(1)已知[Co(CN)6]4-是强还原剂,与水反应能生成[Co(CN)6]3-,写出该反应的离子方程式:________ ;1molCN-含有σ键的数目为_______ ,该离子中C的杂化方式为___________ 。
(2)已知H2O2难以将Co2+氧化为Co3+,若先将Co2+转化为[Co(NH3)6]2+,则H2O2能快速将其氧化为[Co(NH3)6]3+,该原因是_________ 。
(1)已知[Co(CN)6]4-是强还原剂,与水反应能生成[Co(CN)6]3-,写出该反应的离子方程式:
(2)已知H2O2难以将Co2+氧化为Co3+,若先将Co2+转化为[Co(NH3)6]2+,则H2O2能快速将其氧化为[Co(NH3)6]3+,该原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】铜是人类广泛使用的一种金属,含铜物质在生产、生活中有着广泛应用。回答下列问题:
(1)铜锰氧化物 能在常温下催化氧化一氧化碳和甲醛(
能在常温下催化氧化一氧化碳和甲醛( )。
)。
①基态 原子的M层电子排布式为
原子的M层电子排布式为_______ 。
② 和
和 互为等电子体。标准状况下
互为等电子体。标准状况下 分子中
分子中 键数目为
键数目为_______ 。
(2)钙铜合金可用作电解法制备金属钙的阴极电极材料。钙在元素周期表中位于_______ (填“s”“p”“d”或“ ”)区。一种钙铜合金的结构如图(III可看作是由I、II两种原子层交替堆积排列而形成的,其晶胞结构为Ⅳ)。该钙铜合金中铜原子与钙原子的个数比为
”)区。一种钙铜合金的结构如图(III可看作是由I、II两种原子层交替堆积排列而形成的,其晶胞结构为Ⅳ)。该钙铜合金中铜原子与钙原子的个数比为_______ 。

(3)已知硫酸铜稀溶液呈蓝色,判断硫酸铜稀溶液中不存在的作用力有_______ (填字母)。
A.配位键 B.金属键 C.离子键 D.氢键 E.范德华力
(4) 可形成
可形成 ,其中X代表
,其中X代表 。则
。则 微粒中
微粒中 模型为四面体的非金属原子共有
模型为四面体的非金属原子共有_______  。
。
(5)一种含有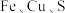 三种元素的矿物的晶胞(如图所示),属于四方晶系(晶胞底面为正方形),则该化合物的化学式为
三种元素的矿物的晶胞(如图所示),属于四方晶系(晶胞底面为正方形),则该化合物的化学式为_______ ;若晶胞的底面边长为 ,晶体的密度为
,晶体的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶胞的高为
,则该晶胞的高为_______  。
。
(1)铜锰氧化物
 能在常温下催化氧化一氧化碳和甲醛(
能在常温下催化氧化一氧化碳和甲醛( )。
)。①基态
 原子的M层电子排布式为
原子的M层电子排布式为②
 和
和 互为等电子体。标准状况下
互为等电子体。标准状况下 分子中
分子中 键数目为
键数目为(2)钙铜合金可用作电解法制备金属钙的阴极电极材料。钙在元素周期表中位于
 ”)区。一种钙铜合金的结构如图(III可看作是由I、II两种原子层交替堆积排列而形成的,其晶胞结构为Ⅳ)。该钙铜合金中铜原子与钙原子的个数比为
”)区。一种钙铜合金的结构如图(III可看作是由I、II两种原子层交替堆积排列而形成的,其晶胞结构为Ⅳ)。该钙铜合金中铜原子与钙原子的个数比为
(3)已知硫酸铜稀溶液呈蓝色,判断硫酸铜稀溶液中不存在的作用力有
A.配位键 B.金属键 C.离子键 D.氢键 E.范德华力
(4)
 可形成
可形成 ,其中X代表
,其中X代表 。则
。则 微粒中
微粒中 模型为四面体的非金属原子共有
模型为四面体的非金属原子共有 。
。(5)一种含有
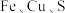 三种元素的矿物的晶胞(如图所示),属于四方晶系(晶胞底面为正方形),则该化合物的化学式为
三种元素的矿物的晶胞(如图所示),属于四方晶系(晶胞底面为正方形),则该化合物的化学式为 ,晶体的密度为
,晶体的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶胞的高为
,则该晶胞的高为 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】马氏体时效不锈钢(Cr12Ni10MoTi)具有良好的强韧性匹配和耐腐蚀性能,已经应用在航空航天、海洋建设和压力容器制造等领域。请回答下列问题:
(1)Cr在元素周期表中的位置是___________ ,Mo与Cr属于同一族且相邻的元素,则基态Mo原子的价电子排布图为___________
(2)NiO可用作电子元件材料、催化剂、搪瓷涂料和蓄电池材料等。NiO是离子晶体,其晶格能可通过如图所示的BornHaber循环计算得到。则Ni原子的第二电离能(I2)为___________ kJ·mol-1;NiO的晶格能为___________ kJ·mol-1

(3)Ti(BH4)2是一种过渡元素硼氢化物储氢材料,BH 的空间构型为
的空间构型为___________ ;与BH 互为等电子体的阳离子的结构式为
互为等电子体的阳离子的结构式为___________
(4)Cr元素形成的某种配合物的组成为CrCl3·6NH3,向1 mol该配合物中加入足量AgNO3溶液,能产生3 mol AgCl沉淀,若加入足量NaOH溶液、加热、无刺激性气味的气体产生,则1 mol该化合物中含有σ键的数目为___________
(5)TiCl4、TiBr4、TiI4均为分子晶体,则TiCl4、TiBr4、TiI4的熔、沸点由高到低的顺序为___________ (用化学式表示)
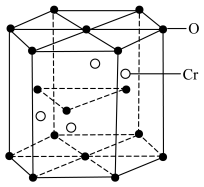
(6)铬的一种氧化物晶胞结构如图所示,该氧化物中铬元素的化合价为___________ 价;若六棱柱的底面边长为L nm,高为h nm,NA代表阿伏加德罗常数的值,则该晶体的密度ρ=___________ g·cm-3(用含L、h、NA的代数式表示,只列计算式)
(1)Cr在元素周期表中的位置是
(2)NiO可用作电子元件材料、催化剂、搪瓷涂料和蓄电池材料等。NiO是离子晶体,其晶格能可通过如图所示的BornHaber循环计算得到。则Ni原子的第二电离能(I2)为

(3)Ti(BH4)2是一种过渡元素硼氢化物储氢材料,BH
 的空间构型为
的空间构型为 互为等电子体的阳离子的结构式为
互为等电子体的阳离子的结构式为(4)Cr元素形成的某种配合物的组成为CrCl3·6NH3,向1 mol该配合物中加入足量AgNO3溶液,能产生3 mol AgCl沉淀,若加入足量NaOH溶液、加热、无刺激性气味的气体产生,则1 mol该化合物中含有σ键的数目为
(5)TiCl4、TiBr4、TiI4均为分子晶体,则TiCl4、TiBr4、TiI4的熔、沸点由高到低的顺序为
(6)铬的一种氧化物晶胞结构如图所示,该氧化物中铬元素的化合价为

您最近一年使用:0次



