Li、Fe、As均为重要的合金材料,NA为阿伏加 德罗常数的值。回答下列问题:
(1)基态Li原子核外电子占据的空间运动状态有________ 个,占据最高能层电子的电子云轮廓图形状为_________ 。
(2)Li的焰色反应为紫红色,很多金属元素能产生焰色反应的原因为_________ 。
(3)基态Fe3+比基态Fe2+稳定的原因为____________ 。
(4)KSCN和K4[Fe(CN)6]均可用于检验Fe3+。
①SCN-的立体构型为_______ ,碳原子的杂化方式为_____________ 。
②K4[Fe(CN)6]中所含元素的第一电离能由大到小的顺序为__________ (用元素符号表示);1 mol [Fe(CN)6]4-中含有σ键的数目为____________ 。
(5)H3AsO3的酸性弱于H3AsO4的原因为____________________ 。
(6)Li、Fe和As可组成一种新型材料,其立方晶胞结构如图所示。若晶胞参数为a nm,阿伏加 德罗常数的值为NA,则该晶体的密度可表示为______ g●cm-3。(列式即可)

(1)基态Li原子核外电子占据的空间运动状态有
(2)Li的焰色反应为紫红色,很多金属元素能产生焰色反应的原因为
(3)基态Fe3+比基态Fe2+稳定的原因为
(4)KSCN和K4[Fe(CN)6]均可用于检验Fe3+。
①SCN-的立体构型为
②K4[Fe(CN)6]中所含元素的第一电离能由大到小的顺序为
(5)H3AsO3的酸性弱于H3AsO4的原因为
(6)Li、Fe和As可组成一种新型材料,其立方晶胞结构如图所示。若晶胞参数为a nm,阿伏加 德罗常数的值为NA,则该晶体的密度可表示为

2020·广东·模拟预测 查看更多[2]
四省(河南、广东、湖南、湖北四省)肇庆中学等部分学校2020届高三联考理综化学试题(已下线)01 物质结构与性质综合题型集训(1) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
更新时间:2020-04-01 20:22:31
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】据世界权威刊物《自然》最近报道, 选择碲化锆 (ZrTe5)为材料验证了三维量子霍尔效应, 并发现了金属-绝缘体的转换。Te属于ⅥA元素。回答下列问题:
(1)锆(Zr)的简化电子排布式为[Kr]4d25s2,锆原子中d轨道上的电子数是___ ,Zr2+的价电子排布图是___ 。
(2)O、Se、Te的第一电离能由大到小的顺序是___ ,H2O、H2Se、H2Te的沸点由高到低的顺序是___ 。
(3)H2Te和CO2均为三原子分子,但它们的键角差别较大,试用杂化轨道理论解释,理由是___ 。
(4) [Zr(C2H5O)2]2+是Zr4+形成的一种配离子,其中的配位原子是___ (填符号), 1个[Zr(C2H5O)2]2+离子中含共价键的数目是___ 。
(5)立方氧化锆是一种人工合成的氧化物,其硬度极高,可用于陶瓷和耐火材料,其晶胞结构如图所示。Zr原子的配位数是___ 。若晶胞中距离最近的两个氧原子间的距离为anm,则立方氧化锆的密度为___ g/cm3。
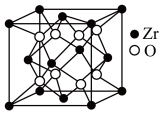
(1)锆(Zr)的简化电子排布式为[Kr]4d25s2,锆原子中d轨道上的电子数是
(2)O、Se、Te的第一电离能由大到小的顺序是
(3)H2Te和CO2均为三原子分子,但它们的键角差别较大,试用杂化轨道理论解释,理由是
(4) [Zr(C2H5O)2]2+是Zr4+形成的一种配离子,其中的配位原子是
(5)立方氧化锆是一种人工合成的氧化物,其硬度极高,可用于陶瓷和耐火材料,其晶胞结构如图所示。Zr原子的配位数是

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】有A、B、C、D四种元素,已知A元素原子的第一层和第三层电子数相同;B元素原子的第二层比第一层电子数多5个;C元素的+3价阳离子和氖原子具有相同的电子数;D元素的原子核外有4个电子层,第一层与第二层电子数之和等于第三层与第四层电子数之和。根据题意,完成下列填空:
(1)元素符号:A__ ,B__ ,C__ ,D___ 。
(2)A的原子结构示意图__ ,B的阴离子结构示意图___ ,C的阳离子结构示意图__ ,D的原子结构示意图__ 。
(1)元素符号:A
(2)A的原子结构示意图
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】镍及其化合物在工业生产中具有重要作用,回答下列问题:
(1)层状镍钴锰三元材料可用作锂离子电池正极材料,化学式可表示为LiNixCoyMnzO2,其五种组成元素中第一电离能最小的是___________ ;基态Ni2+与Co2+离子中未成对电子数之比为___________ 。
(2)镍的配合物[Ni(CN)4]SO4中,配位数为___________ ,配体的空间构型为___________ ,S原子的杂化轨道类型为___________ 。
(3)镍的另一种配合物Ni(CO)4的熔点、沸点分别为-25℃、43℃,其晶体中存在的作用力有___________ (填标号);
A.离子键B.极性键C.非极性键D.配位键E.范德华力
Ni(CO)4___________ (填“能”或“不能")溶于水,其判断理由是___________ 。
(4)某镧镍合金的结构属六方晶系(晶胞参数为apm、apm、cpm,α=β=90°,γ=120°),是一种储氢材料,储氢后的晶胞结构如图。若储氢前后晶胞参数不变,则储氢后晶体的密度为___________ g·cm-3(设阿伏加德罗常数的值为NA)。
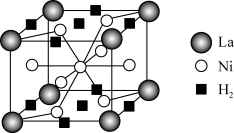
(1)层状镍钴锰三元材料可用作锂离子电池正极材料,化学式可表示为LiNixCoyMnzO2,其五种组成元素中第一电离能最小的是
(2)镍的配合物[Ni(CN)4]SO4中,配位数为
(3)镍的另一种配合物Ni(CO)4的熔点、沸点分别为-25℃、43℃,其晶体中存在的作用力有
A.离子键B.极性键C.非极性键D.配位键E.范德华力
Ni(CO)4
(4)某镧镍合金的结构属六方晶系(晶胞参数为apm、apm、cpm,α=β=90°,γ=120°),是一种储氢材料,储氢后的晶胞结构如图。若储氢前后晶胞参数不变,则储氢后晶体的密度为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】一桥连三地,天堑变通途。举世瞩目的港珠澳大桥于2018年10月23日正式通车,体现了我国工程建设自主创新能力实现大跨越,尤其在新材料研究方面有重大突破,回答下列问题:
(1)钛是一种新兴的结构材料,比钢轻、比铝硬。
①基态钛原子的价电子排布式为______ ,与钛同周期的元素中,基态原子的未成对电子数与钛相同的有_____ 种
②钛的硬度比铝大的原因是_______________________________ 。
③工业上制金属钛采用金属还原四氧化钛。先将TiO2和足量炭粉混合加热至1000~1100K进行氯化处理,生成TiCl4。该反应的化学反应方程式为_______________________ 。
(2)跨海桥梁的主要结构材料为钢铁。铁能与三氮唑(Bipy,结构见图)形成多种配合物。

①1mol Bipy中所含 键
键_____ mol;碳原子杂化方式是___________________ 。
②Bipy的沸点为260℃、结构相似且相对分子质量接近的环戊二烯(结构见上图)的沸点为42.5℃.前者较大的原因是______________________________ 。
(3)碳化钨是耐高温耐磨材料。下图为化晶体的部分结构,碳原子嵌入金属的晶格间隙,并不破坏原有金属的晶格,形成填隙+固溶体、也称为填隙化合物。

①在该结构中,每个钨原子周围距离钨原子最近的碳原子有____ 个。
②假设该部分晶体的体积为d/cm3,碳化的摩尔质量为Mg/mol,密度为dg/cm3,则阿伏伽德罗常数NA用上述数据表示为______ 。
(1)钛是一种新兴的结构材料,比钢轻、比铝硬。
①基态钛原子的价电子排布式为
②钛的硬度比铝大的原因是
③工业上制金属钛采用金属还原四氧化钛。先将TiO2和足量炭粉混合加热至1000~1100K进行氯化处理,生成TiCl4。该反应的化学反应方程式为
(2)跨海桥梁的主要结构材料为钢铁。铁能与三氮唑(Bipy,结构见图)形成多种配合物。

①1mol Bipy中所含
 键
键②Bipy的沸点为260℃、结构相似且相对分子质量接近的环戊二烯(结构见上图)的沸点为42.5℃.前者较大的原因是
(3)碳化钨是耐高温耐磨材料。下图为化晶体的部分结构,碳原子嵌入金属的晶格间隙,并不破坏原有金属的晶格,形成填隙+固溶体、也称为填隙化合物。

①在该结构中,每个钨原子周围距离钨原子最近的碳原子有
②假设该部分晶体的体积为d/cm3,碳化的摩尔质量为Mg/mol,密度为dg/cm3,则阿伏伽德罗常数NA用上述数据表示为
您最近一年使用:0次
【推荐2】Ⅰ.已知A、B、C、D四种分子所含原子的数目依次为1、3、6、6,且都含有18个电子,B、C是由两种元素的原子组成,且分子中两种原子的个数比均为1∶2。D是一种有毒的有机物。
(1)组成A分子的原子的元素符号是________ 。
(2)从B分子的立体结构判断,该分子属于________ 分子(填“极性”或“非极性”)。
(3)C分子中都包含________ 个σ键,________ 个π键。
(4)D的熔、沸点比C2H6的熔、沸点高,其主要原因是(需指明D是何物质):________ 。
Ⅱ.CO的结构可表示为CO,N2的结构可表示为NN。
(5)下表是两者的键能数据:(单位:kJ·mol-1)

结合数据说明CO比N2活泼的原因:____________________ 。
Ⅲ.Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关。
(6)基态Ni原子的核外电子排布式为________ ,基态Cu原子的价电子排布式为________ 。
(7)Fe(CO)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于________ (填晶体类型)。
(1)组成A分子的原子的元素符号是
(2)从B分子的立体结构判断,该分子属于
(3)C分子中都包含
(4)D的熔、沸点比C2H6的熔、沸点高,其主要原因是(需指明D是何物质):
Ⅱ.CO的结构可表示为CO,N2的结构可表示为NN。
(5)下表是两者的键能数据:(单位:kJ·mol-1)

结合数据说明CO比N2活泼的原因:
Ⅲ.Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关。
(6)基态Ni原子的核外电子排布式为
(7)Fe(CO)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】氮、磷、砷、锑为元素周期表中原子序数依次增大的同族元素。
(1)除 外,科学家还先后研究出了
外,科学家还先后研究出了 、
、 、
、 、高聚氮等氮的单质。
、高聚氮等氮的单质。 为正四面体结构,高聚氮具有空间网状结构,如图所示。
为正四面体结构,高聚氮具有空间网状结构,如图所示。

① 分子是一种
分子是一种_______ (填“极性”或“非极性”)分子。
② 的沸点
的沸点_______ (填“>”、“<”或“=”)高聚氮的沸点,原因是_______ 。
(2)热稳定性:
_______  (填“>”“<”),判断依据是
(填“>”“<”),判断依据是_______ 。
(3) 链状分子中所有原子都满足8电子稳定结构,则其分子中
链状分子中所有原子都满足8电子稳定结构,则其分子中 键与
键与 键之比为
键之比为_______ ,C原子的杂化类型为_______ 。
(1)除
 外,科学家还先后研究出了
外,科学家还先后研究出了 、
、 、
、 、高聚氮等氮的单质。
、高聚氮等氮的单质。 为正四面体结构,高聚氮具有空间网状结构,如图所示。
为正四面体结构,高聚氮具有空间网状结构,如图所示。
①
 分子是一种
分子是一种②
 的沸点
的沸点(2)热稳定性:

 (填“>”“<”),判断依据是
(填“>”“<”),判断依据是(3)
 链状分子中所有原子都满足8电子稳定结构,则其分子中
链状分子中所有原子都满足8电子稳定结构,则其分子中 键与
键与 键之比为
键之比为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】铁及其化合物在生活中有广泛应用。
(1)Fe3+基态核外电子排布式为______ 。
(2)实验室用KSCN溶液、苯酚检验Fe3+。
①1mol苯酚分子中含有σ键的数目为______ 。
②类卤素离子 可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸
可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸 和异硫氰酸
和异硫氰酸 ,这两种酸中沸点较高的是
,这两种酸中沸点较高的是______
(3)氮化铁晶体的晶胞结构如图−1所示。该晶体中铁、氮的微粒个数之比为______ 。

(4)某铁的化合物结构简式如图−2所示

①上述化合物中所含有的非金属元素的电负性由大到小的顺序为______ (用元素符号表示)。
②上述化合物中氮原子的杂化方式为______ 。
(1)Fe3+基态核外电子排布式为
(2)实验室用KSCN溶液、苯酚检验Fe3+。
①1mol苯酚分子中含有σ键的数目为
②类卤素离子
 可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸
可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸 和异硫氰酸
和异硫氰酸 ,这两种酸中沸点较高的是
,这两种酸中沸点较高的是(3)氮化铁晶体的晶胞结构如图−1所示。该晶体中铁、氮的微粒个数之比为

(4)某铁的化合物结构简式如图−2所示

①上述化合物中所含有的非金属元素的电负性由大到小的顺序为
②上述化合物中氮原子的杂化方式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】回答下列问题
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是___________。
(2)Sm的价层电子排布式为 ,
, 价层电子排布式为
价层电子排布式为___________ 。比较离子半径:
___________ (填“大于”“小于”或“等于”) 。
。
(3)在周期表中,与Li的化学性质最相似的邻族元素是___________ ,该元素基态原子核外M层电子的自旋___________ (填“相同”或“相反”)。 中,电负性最高的元素是
中,电负性最高的元素是___________ 。
(4) 基态核外电子排布式为
基态核外电子排布式为___________ 。
(5) 的空间结构为
的空间结构为___________ 形,其中心原子的杂化轨道类型为___________ 。
(6) 元素位于周期表的
元素位于周期表的___________ 区。已知: ,
,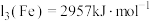 。Mn的第三电离能大于Fe的第三电离能,其主要原因是
。Mn的第三电离能大于Fe的第三电离能,其主要原因是___________ 。
(7) 、
、 、
、 键角由大到小的顺序为
键角由大到小的顺序为___________ 。 与
与 键角由大到小的顺序为
键角由大到小的顺序为___________ 。
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是___________。
A. | B. | C.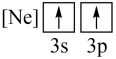 | D.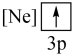 |
(2)Sm的价层电子排布式为
 ,
, 价层电子排布式为
价层电子排布式为
 。
。(3)在周期表中,与Li的化学性质最相似的邻族元素是
 中,电负性最高的元素是
中,电负性最高的元素是(4)
 基态核外电子排布式为
基态核外电子排布式为(5)
 的空间结构为
的空间结构为(6)
 元素位于周期表的
元素位于周期表的 ,
,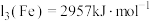 。Mn的第三电离能大于Fe的第三电离能,其主要原因是
。Mn的第三电离能大于Fe的第三电离能,其主要原因是(7)
 、
、 、
、 键角由大到小的顺序为
键角由大到小的顺序为 与
与 键角由大到小的顺序为
键角由大到小的顺序为
您最近一年使用:0次
【推荐3】镍(Ni)、钴(Co) 、钛(Ti)是重要的金属,在材料科学等领域应用广泛。
(1)Ni在元素周期表中的位置是_______ , 其价电子层中有______ 个未成对电子。
(2)纳米结构氧化钴可在室温下将甲醛(HCHO)完全催化氧化,已知甲醛各原子均满足稳定结构,甲醛分子属于______ ( 填“极性”“非极性”)分子,其立体构型为_______ 。
(3)铁、钴、镍三种元素并称铁系元素,它们的性质相似。某含镍化合物的结构如图所示,则分子内不可能含有_ (填字母)。
A.离子键 B.共价键 C.金属键 D.配位键 E.氢键

(4)TiO2能溶于浓硫酸并析出一种离子晶体,已知其中阳离子是以链状聚合物形式存在的钛酰阳离子,其结构如图所示,其化学式为____ 。阴离子 中硫原子的杂化方式为
中硫原子的杂化方式为________ ,写出一种与 互为等电子体的分子:
互为等电子体的分子:_______ 。
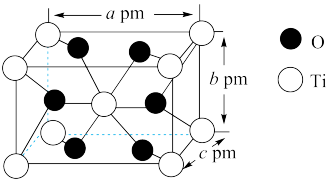
(5)自然界的钛主要以金红石(主要成分为TiO2 )的形式存在。TiO2的晶胞属于四方晶系,其长方体结构如图所示,已知TiO2的摩尔质量为Mg·mol-1,阿伏加 德罗常数的数值为NA,根据图中所示数据可知该晶体的密度ρ=______ (用NA表示阿伏加 德罗常数的数值,用含M、a、b、c、NA的代数式表示)g·cm-3。
(1)Ni在元素周期表中的位置是
(2)纳米结构氧化钴可在室温下将甲醛(HCHO)完全催化氧化,已知甲醛各原子均满足稳定结构,甲醛分子属于
(3)铁、钴、镍三种元素并称铁系元素,它们的性质相似。某含镍化合物的结构如图所示,则分子内不可能含有
A.离子键 B.共价键 C.金属键 D.配位键 E.氢键

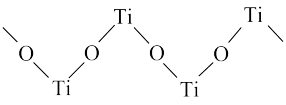
(4)TiO2能溶于浓硫酸并析出一种离子晶体,已知其中阳离子是以链状聚合物形式存在的钛酰阳离子,其结构如图所示,其化学式为
 中硫原子的杂化方式为
中硫原子的杂化方式为 互为等电子体的分子:
互为等电子体的分子:
(5)自然界的钛主要以金红石(主要成分为TiO2 )的形式存在。TiO2的晶胞属于四方晶系,其长方体结构如图所示,已知TiO2的摩尔质量为Mg·mol-1,阿伏加 德罗常数的数值为NA,根据图中所示数据可知该晶体的密度ρ=

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】硼及其化合物在工业上有重要的用途,回答下列问题:
(1)基态硼原子有___ 个不同运动状态的电子,其电子云轮廓图为哑铃形的电子有___ 个,基态硼原子最高能级的电子排布式为___ 。
(2)BF3能与多种物质化合。
①BF3的空间结构为___ ,其分子的极性为___ 。
②气态BF3与无水乙醚可化合生成 ,该产物中硼原子的杂化类型为
,该产物中硼原子的杂化类型为___ ,该产物熔点为-58℃,沸点为126℃~129℃,据此判断该产物的晶体类型为___ 。
③BF3与NH3可形成“H3N-BF3”分子,其原因是___ 。
(3)硼原子和磷原子能形成原子晶体磷化硼,其密度为ρg/cm3,晶胞如图所示:

磷化硼的化学式为:___ 。
硼原子的配位数为:___ 。
③其晶胞参数a=___ pm(B的相对原子质量为10.8,P的相对原子质量为31,阿伏加 德罗常数值用NA表示。
(1)基态硼原子有
(2)BF3能与多种物质化合。
①BF3的空间结构为
②气态BF3与无水乙醚可化合生成
 ,该产物中硼原子的杂化类型为
,该产物中硼原子的杂化类型为③BF3与NH3可形成“H3N-BF3”分子,其原因是
(3)硼原子和磷原子能形成原子晶体磷化硼,其密度为ρg/cm3,晶胞如图所示:

磷化硼的化学式为:
硼原子的配位数为:
③其晶胞参数a=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】青蒿素(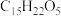 )是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体,含4个青蒿素分子)及分子结构如下图所示。
)是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体,含4个青蒿素分子)及分子结构如下图所示。

(1)提取青蒿素
在浸取、蒸馏过程中,发现用沸点比乙醇低的乙醚(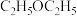 )提取,效果更好。乙醇的沸点高于乙醚,原因是
)提取,效果更好。乙醇的沸点高于乙醚,原因是_______ 。
(2)确定结构
①图中晶胞的棱长分别为 ,晶体的密度为
,晶体的密度为_______  。(用
。(用 表示阿伏加德罗常数,青蒿素的相对分子质量为282)
表示阿伏加德罗常数,青蒿素的相对分子质量为282)
②能确定晶体中哪些原子间存在化学键、并能确定键长和键角,从而得出分子空间结构的一种方法是_______ 。
a.质谱法 b.X射线衍射 c.核磁共振氢谱 d.红外光谱
(3)修饰结构,提高疗效
一定条件下,用 将青蒿素选择性还原生成双氢青蒿素。
将青蒿素选择性还原生成双氢青蒿素。

①双氢青蒿素分子中碳原子的杂化轨道类型为_______ 。
② 的空间结构为
的空间结构为_______ 。
双氢青蒿素比青蒿素水溶性更好,治疗疟疾的效果更好。
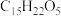 )是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体,含4个青蒿素分子)及分子结构如下图所示。
)是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体,含4个青蒿素分子)及分子结构如下图所示。
(1)提取青蒿素
在浸取、蒸馏过程中,发现用沸点比乙醇低的乙醚(
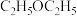 )提取,效果更好。乙醇的沸点高于乙醚,原因是
)提取,效果更好。乙醇的沸点高于乙醚,原因是(2)确定结构
①图中晶胞的棱长分别为
 ,晶体的密度为
,晶体的密度为 。(用
。(用 表示阿伏加德罗常数,青蒿素的相对分子质量为282)
表示阿伏加德罗常数,青蒿素的相对分子质量为282)②能确定晶体中哪些原子间存在化学键、并能确定键长和键角,从而得出分子空间结构的一种方法是
a.质谱法 b.X射线衍射 c.核磁共振氢谱 d.红外光谱
(3)修饰结构,提高疗效
一定条件下,用
 将青蒿素选择性还原生成双氢青蒿素。
将青蒿素选择性还原生成双氢青蒿素。
①双氢青蒿素分子中碳原子的杂化轨道类型为
②
 的空间结构为
的空间结构为双氢青蒿素比青蒿素水溶性更好,治疗疟疾的效果更好。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】第四周期过渡元素如铁、锰、铜、锌等在太阳能电池、磁性材料等科技方面有广泛的应用,回答下列问题:
(1)Fe的基态原子共有____ 种不同能级的电子。
(2)已知高温下CuO→Cu2O+O2,从铜原子价层电子结构(3d和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是___ 。比较铁与锰的第三电离能(I3):铁__ 锰(填“>”、 “=”或“<”),原因是___ 。
(3)某含铜化合物的离子结构如图所示。

①该离子中存在的作用力有______________ ;
a.离子键 b.共价键 c.配位键 d.氢键 e.范德华力
②该离子中N原子的杂化类型有____________ 。
(4)如图是晶体Fe3O4的晶胞,该晶体是一种磁性材料,能导电。
①晶胞中二价铁离子处于氧离子围成的______ (填空间结构)空隙。
②晶胞中氧离子的堆积方式与某金属晶体原子堆积方式相同,该堆积方式名称为________ 。
③解释Fe3O4晶体能导电的原因__________ ;若晶胞的体对角线长为anm,则 Fe3O4晶体的密度为______ g·cm-3(阿伏伽德罗常数用NA表示)。

(1)Fe的基态原子共有
(2)已知高温下CuO→Cu2O+O2,从铜原子价层电子结构(3d和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是
(3)某含铜化合物的离子结构如图所示。

①该离子中存在的作用力有
a.离子键 b.共价键 c.配位键 d.氢键 e.范德华力
②该离子中N原子的杂化类型有
(4)如图是晶体Fe3O4的晶胞,该晶体是一种磁性材料,能导电。
①晶胞中二价铁离子处于氧离子围成的
②晶胞中氧离子的堆积方式与某金属晶体原子堆积方式相同,该堆积方式名称为
③解释Fe3O4晶体能导电的原因

您最近一年使用:0次



