名校
解题方法
1 . Ⅰ:下列结论错误的是_________ (填序号)
①单质的熔点:Li>Na>K ②氢化物的稳定性:HF>H2S>PH3>SiH4
③还原性:H2S>HCl>HBr>HI ④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO ⑥密度:F2>Cl2>Br2 ⑦沸点:NH3>PH3
Ⅱ:(1)下列几种物质: ①MgCl2 ②HCl ③Na ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦NH3 ⑧I2 ⑨Ne。含有非极性共价键的离子化合物是___________ ;不存在化学键的是__________ 。(填序号)
(2)CO2的电子式为__________ ;NH3的结构式为__________ ;
(3)分析在下列变化中,微粒间作用力的变化(填选项):
①碘的升华破坏______________ ②HCl溶于水破坏_________________ 。
A.离子键 B.极性共价键 C.非极性共价键 D.分子间作用力
Ⅲ:(1)下列变化完全符合下图图示的是:_______________ 。(填选项)
①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④生石灰溶于水 ⑤二氧化碳与灼热的碳反应 ⑥碘的升华 ⑦Ba(OH)2·8H2O与NH4Cl反应
A.①②⑥ B.②⑤⑦ C.①②⑤⑥⑦ D.②⑤⑥⑦

(2)化学反应可视为旧键断裂和新键形成的过程。已知断开1mol下列化学键时需要吸收的能量分别为:P-P a kJ、 P-O b kJ、 O=O c kJ。已知:白磷(P4)和P4O6的分子结构如图所示(分子中所有原子均达到8电子稳定结构)。则1mol白磷(P4)燃烧生成P4O6放出_________ kJ热量。

①单质的熔点:Li>Na>K ②氢化物的稳定性:HF>H2S>PH3>SiH4
③还原性:H2S>HCl>HBr>HI ④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO ⑥密度:F2>Cl2>Br2 ⑦沸点:NH3>PH3
Ⅱ:(1)下列几种物质: ①MgCl2 ②HCl ③Na ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦NH3 ⑧I2 ⑨Ne。含有非极性共价键的离子化合物是
(2)CO2的电子式为
(3)分析在下列变化中,微粒间作用力的变化(填选项):
①碘的升华破坏
A.离子键 B.极性共价键 C.非极性共价键 D.分子间作用力
Ⅲ:(1)下列变化完全符合下图图示的是:
①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④生石灰溶于水 ⑤二氧化碳与灼热的碳反应 ⑥碘的升华 ⑦Ba(OH)2·8H2O与NH4Cl反应
A.①②⑥ B.②⑤⑦ C.①②⑤⑥⑦ D.②⑤⑥⑦

(2)化学反应可视为旧键断裂和新键形成的过程。已知断开1mol下列化学键时需要吸收的能量分别为:P-P a kJ、 P-O b kJ、 O=O c kJ。已知:白磷(P4)和P4O6的分子结构如图所示(分子中所有原子均达到8电子稳定结构)。则1mol白磷(P4)燃烧生成P4O6放出

您最近一年使用:0次
名校
解题方法
2 . 螯合树脂吸附法处理废水具有吸附容量大、速度快以及选择性好等特点,已成为近年来的研究热点。螯合树脂M与Cu2+形成新的螯合物Q,从而达到去除Cu2+的效果,吸附机理如图所示。

资料:
①吸附原理
螯合树脂M中的—OH解离出H+,变成—COO-,而且树脂中含有N原子,在与Cu2+接触时,树脂中的—COO-、N原子与Cu2+形成配位键,形成新的螯合物Q,从而达到去除Cu2+的目的。
②在体系酸性较强情况下,氮原子与氢离子具有较强的配位能力。
(1)基态Cu的价层电子排布的轨道表示式是____ 。
(2)M中四种元素电负性由大到小的顺序为(用元素符号表示)____ 。
(3)M中N原子的杂化轨道类型为____ 。
(4)Q中存在配位键,其中提供空轨道的是____ 。
(5)在螯合树脂M处理含铜废水过程中,发现体系pH对Cu2+的吸附量(Qe)有影响,实验结果如图所示。
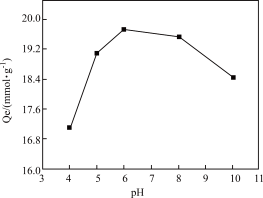
①吸附去除Cu2+的过程中需保持体系处于适宜的pH,其中pH约为____ 时吸附效果最好。
②从平衡移动角度解释,体系碱性过强时,吸附能力下降的原因____ 。
③从结构角度解释:体系酸性较强时,吸附能力下降的原因____ 。

资料:
①吸附原理
螯合树脂M中的—OH解离出H+,变成—COO-,而且树脂中含有N原子,在与Cu2+接触时,树脂中的—COO-、N原子与Cu2+形成配位键,形成新的螯合物Q,从而达到去除Cu2+的目的。
②在体系酸性较强情况下,氮原子与氢离子具有较强的配位能力。
(1)基态Cu的价层电子排布的轨道表示式是
(2)M中四种元素电负性由大到小的顺序为(用元素符号表示)
(3)M中N原子的杂化轨道类型为
(4)Q中存在配位键,其中提供空轨道的是
(5)在螯合树脂M处理含铜废水过程中,发现体系pH对Cu2+的吸附量(Qe)有影响,实验结果如图所示。

①吸附去除Cu2+的过程中需保持体系处于适宜的pH,其中pH约为
②从平衡移动角度解释,体系碱性过强时,吸附能力下降的原因
③从结构角度解释:体系酸性较强时,吸附能力下降的原因
您最近一年使用:0次
名校
3 . Ⅰ.溴化铜 Ⅱ
Ⅱ 甲基咪唑配合物是一种制备有机玻璃的催化剂,其合成方法如下:
甲基咪唑配合物是一种制备有机玻璃的催化剂,其合成方法如下:

 溴化铜
溴化铜 Ⅱ
Ⅱ 甲基咪唑中
甲基咪唑中 与
与 甲基咪唑间形成的化学键称为
甲基咪唑间形成的化学键称为_______________ ; 基态核外电子排布式为
基态核外电子排布式为_________________________________ 。
 与
与 互为等电子体的阴离子为
互为等电子体的阴离子为_______________ 。
 中碳原子杂化轨道类型为
中碳原子杂化轨道类型为_______________ ;1molMIm中含 键数目为
键数目为______ mol。
Ⅱ.碳、氧、氮、镁、铬、铁、铜是几种重要的元素,请回答下列问题:
(4)Mg、O、C、N四种元素的第一电离能从大到小的顺序为________ 。
(5)查阅相关资料发现MgO的熔点比CuO的熔点高得多,其原因是_______ 。
(6)金属铬是一种银白色,极硬,耐腐蚀的金属,铬的化合物种类繁多,如:Cr2(SO4)3、 以及配离子
以及配离子 。
。
 具有很强的氧化性,能直接将
具有很强的氧化性,能直接将 氧化成
氧化成 ,试写出基态铬原子的价层电子排布式:
,试写出基态铬原子的价层电子排布式:__________________________________________ 。
 该配离子
该配离子 中,中心离子的配位数为
中,中心离子的配位数为______________ , 的VSEPR模型为
的VSEPR模型为________________________ 。
 已知晶胞中Cr和Cu原子间的最近距离为
已知晶胞中Cr和Cu原子间的最近距离为 ,则该晶体的密度为
,则该晶体的密度为___________ 
 用含a的代数式表示,设N
用含a的代数式表示,设N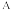 为阿伏加 德罗常数的值
为阿伏加 德罗常数的值 。
。
 Ⅱ
Ⅱ 甲基咪唑配合物是一种制备有机玻璃的催化剂,其合成方法如下:
甲基咪唑配合物是一种制备有机玻璃的催化剂,其合成方法如下:
 溴化铜
溴化铜 Ⅱ
Ⅱ 甲基咪唑中
甲基咪唑中 与
与 甲基咪唑间形成的化学键称为
甲基咪唑间形成的化学键称为 基态核外电子排布式为
基态核外电子排布式为 与
与 互为等电子体的阴离子为
互为等电子体的阴离子为 中碳原子杂化轨道类型为
中碳原子杂化轨道类型为 键数目为
键数目为Ⅱ.碳、氧、氮、镁、铬、铁、铜是几种重要的元素,请回答下列问题:
(4)Mg、O、C、N四种元素的第一电离能从大到小的顺序为
(5)查阅相关资料发现MgO的熔点比CuO的熔点高得多,其原因是
(6)金属铬是一种银白色,极硬,耐腐蚀的金属,铬的化合物种类繁多,如:Cr2(SO4)3、
 以及配离子
以及配离子 。
。 具有很强的氧化性,能直接将
具有很强的氧化性,能直接将 氧化成
氧化成 ,试写出基态铬原子的价层电子排布式:
,试写出基态铬原子的价层电子排布式: 该配离子
该配离子 中,中心离子的配位数为
中,中心离子的配位数为 的VSEPR模型为
的VSEPR模型为 已知晶胞中Cr和Cu原子间的最近距离为
已知晶胞中Cr和Cu原子间的最近距离为 ,则该晶体的密度为
,则该晶体的密度为
 用含a的代数式表示,设N
用含a的代数式表示,设N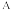 为阿伏加 德罗常数的值
为阿伏加 德罗常数的值 。
。
您最近一年使用:0次
4 . 邻羟基苯甲酸俗称水杨酸,具有抗炎、抗菌、角质调节等作用。其分子结构如图所示。
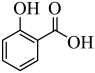
回答下列问题:
(1)下列关于水杨酸的说法中合理的是_______ (填标号)。
a.属于分子晶体 b.沸点高于对羟基苯甲酸 c.相同条件下,在水中的溶解度小于对羟基苯甲酸
(2)具有酚羟基的物质通常能与 溶液发生显色反应。其显色原理是苯酚电离出的
溶液发生显色反应。其显色原理是苯酚电离出的 和
和 形成配位键,得到的
形成配位键,得到的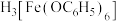 显紫色。
显紫色。
①基态 的核外电子排布式为
的核外电子排布式为_______ 。
②实验发现对羟基苯甲酸不能与 溶液发生显色反应,从电离平衡的角度解释其原因可能是
溶液发生显色反应,从电离平衡的角度解释其原因可能是_______ 。
③查阅资料可知,对甲基苯酚与 溶液作用显蓝色,不同的酚类物质与
溶液作用显蓝色,不同的酚类物质与 显示不同的颜色,从分子结构的角度解释其原因可能是
显示不同的颜色,从分子结构的角度解释其原因可能是_______ 。
(3)理论上可以通过乙酸和邻羟基苯甲酸反应制备阿司匹林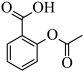 ,然而实际生产中该反应产率极低。
,然而实际生产中该反应产率极低。
已知:i.乙醇和乙酸在酸性条件下发生酯化反应,部分反应机理如下:
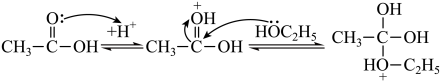
ii.苯酚中氧原子 轨道与碳原子
轨道与碳原子 轨道平行,氧原子p轨道电子云与苯环大
轨道平行,氧原子p轨道电子云与苯环大 键电子云发生重叠,电子向苯环偏移,降低了氧原子周围的电子云密度。
键电子云发生重叠,电子向苯环偏移,降低了氧原子周围的电子云密度。
①H、O、C电负性由大到小的顺序为_______ 。
②苯酚中氧原子的杂化方式为_______ 。
③该方法产率极低的原因可能有两种:原因一是邻羟基苯甲酸可以形成分子内氢键,阻碍酯化反应发生;原因二是_______ 。

回答下列问题:
(1)下列关于水杨酸的说法中合理的是
a.属于分子晶体 b.沸点高于对羟基苯甲酸 c.相同条件下,在水中的溶解度小于对羟基苯甲酸
(2)具有酚羟基的物质通常能与
 溶液发生显色反应。其显色原理是苯酚电离出的
溶液发生显色反应。其显色原理是苯酚电离出的 和
和 形成配位键,得到的
形成配位键,得到的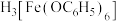 显紫色。
显紫色。①基态
 的核外电子排布式为
的核外电子排布式为②实验发现对羟基苯甲酸不能与
 溶液发生显色反应,从电离平衡的角度解释其原因可能是
溶液发生显色反应,从电离平衡的角度解释其原因可能是③查阅资料可知,对甲基苯酚与
 溶液作用显蓝色,不同的酚类物质与
溶液作用显蓝色,不同的酚类物质与 显示不同的颜色,从分子结构的角度解释其原因可能是
显示不同的颜色,从分子结构的角度解释其原因可能是(3)理论上可以通过乙酸和邻羟基苯甲酸反应制备阿司匹林
 ,然而实际生产中该反应产率极低。
,然而实际生产中该反应产率极低。已知:i.乙醇和乙酸在酸性条件下发生酯化反应,部分反应机理如下:

ii.苯酚中氧原子
 轨道与碳原子
轨道与碳原子 轨道平行,氧原子p轨道电子云与苯环大
轨道平行,氧原子p轨道电子云与苯环大 键电子云发生重叠,电子向苯环偏移,降低了氧原子周围的电子云密度。
键电子云发生重叠,电子向苯环偏移,降低了氧原子周围的电子云密度。①H、O、C电负性由大到小的顺序为
②苯酚中氧原子的杂化方式为
③该方法产率极低的原因可能有两种:原因一是邻羟基苯甲酸可以形成分子内氢键,阻碍酯化反应发生;原因二是
您最近一年使用:0次
名校
解题方法
5 . ZnS硫化锌是一种重要的半导体材料,广泛应用于发光、传感、红外的窗口材料、光催化等诸多领域。ZnS不溶于水,它溶于硝酸溶液中发生反应:ZnS+HNO3→Zn(NO3)2+S↓+NO↑+H2O(未配平)。
(1)对反应中相关晶体中的作用力判断正确的是______ 。
(2)反应中涉及的非金属元素的微粒半径比较正确的是______ 。
(3)对该反应的说法正确的是______ 。
(4)配平该反应方程式并求示出电子转移的方向和数目。______
_______ZnS+_______HNO3——________Zn(NO3)2+________S↓+_______NO↑+_______H2O
(5)若在反应中ZnS______ (填“失去”或“得到”)0.6mol电子,则可生成_____ L气体(标准状况下测定)。
(6)Zn在周期表中的位置是______ ,S原子的电子排布式是______ 。
(7)已知ZnS有两种晶型,其中一种晶体的晶胞如图所示。1个晶胞中,Zn2+离子的数目为_______ 。已知该晶胞边长为anm,这种ZnS的密度是______ 。

(8)NO 的空间构型为
的空间构型为______ ,其中N原子的轨道杂化类型是______ 。
(9)Zn的氯化物与氨水反应可形成配合物[Zn(NH3)4]Cl2,1mol该配合物中含有共价键的数目为______ 。
(1)对反应中相关晶体中的作用力判断正确的是
| A.HNO3晶体中含离子键 | B.Zn(NO3)2晶体中含共价键 |
| C.S晶体中只含共价键 | D.H2O晶体只含氢键 |
| A.S<O | B.O>N | C.S2->O2- | D.O2->N3- |
| A.氧化产物是S | B.还原产物是Zn(NO3)2和NO |
| C.氧化性:ZnS>S | D.还原性:HNO3>NO |
_______ZnS+_______HNO3——________Zn(NO3)2+________S↓+_______NO↑+_______H2O
(5)若在反应中ZnS
(6)Zn在周期表中的位置是
(7)已知ZnS有两种晶型,其中一种晶体的晶胞如图所示。1个晶胞中,Zn2+离子的数目为

(8)NO
 的空间构型为
的空间构型为(9)Zn的氯化物与氨水反应可形成配合物[Zn(NH3)4]Cl2,1mol该配合物中含有共价键的数目为
您最近一年使用:0次
名校
解题方法
6 . 碳、氧、氮、镁、铬、铁、铜是几种重要的元素,请回答下列问题:
(1) 在第二周期的元素中,第一电离能介于B 与N之间的元素有_________ 种。
(2)查阅相关资料发现MgO的熔点比CuO的熔点高得多,其原因是____________________ 。
(3)Fe 与CO能形成一种重要的催化剂Fe(CO)5,该分子中σ键与π键个数比为______________ 。请写出一个与CO互为等电子体的离子:____________________ 。
(4)金属铬是一种银白色,极硬,耐腐蚀的金属,铬的化合物种类繁多,如:Cr2(SO4)3、K2Cr2O7以及配离子[Cr(H2O)3(NH3)3]3+。
①K2Cr2O7具有很强的氧化性,能直接将CH3CH2OH 氧化成CH3COOH,试写出基态铬原子的价层电子排布式:_______________ ;CH3COOH 分子中碳原子的杂化类型为_________________ ;乙醇和丙烷相对分子质量相近,但乙醇的熔、沸点比丙烷高很多,试解释其主要原因:____________________________________ 。
②该配离子[Cr(H2O)3(NH3)3]3+中,中心离子的配位数为_______ ,NH3的VSEPR模型为_______ 。
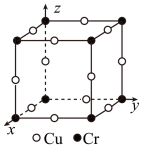
③图为Cu-Cr形成的一种合金的晶胞(假设晶体中原子之间彼此相切),单独属于该晶胞的Cu原子共有三个,其原子坐标可分别表示为:( ,0,0)、 (0,
,0,0)、 (0, ,0)、
,0)、_______ ;已知晶胞中Cr 和Cu原子间的最近距离为 a pm,则该晶体的密度为
a pm,则该晶体的密度为_______ g·cm-3 (用含a的代数式表示,设N A为阿伏伽德罗常数的值)。
(1) 在第二周期的元素中,第一电离能介于B 与N之间的元素有
(2)查阅相关资料发现MgO的熔点比CuO的熔点高得多,其原因是
(3)Fe 与CO能形成一种重要的催化剂Fe(CO)5,该分子中σ键与π键个数比为
(4)金属铬是一种银白色,极硬,耐腐蚀的金属,铬的化合物种类繁多,如:Cr2(SO4)3、K2Cr2O7以及配离子[Cr(H2O)3(NH3)3]3+。
①K2Cr2O7具有很强的氧化性,能直接将CH3CH2OH 氧化成CH3COOH,试写出基态铬原子的价层电子排布式:
②该配离子[Cr(H2O)3(NH3)3]3+中,中心离子的配位数为
③图为Cu-Cr形成的一种合金的晶胞(假设晶体中原子之间彼此相切),单独属于该晶胞的Cu原子共有三个,其原子坐标可分别表示为:(
 ,0,0)、 (0,
,0,0)、 (0, ,0)、
,0)、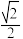 a pm,则该晶体的密度为
a pm,则该晶体的密度为
您最近一年使用:0次
解题方法
7 . 现有1~20号元素A、B、C、D所对应的物质的性质或微粒结构如下表:
(1)元素A的原子最外层共有________ 种不同运动状态的电子,有________ 种能量不同的电子。
(2)C的氢化物固态时属于________ 晶体,其中C原子杂化方式为________ ,C的氢化物比D的氢化物更易溶于水的主要原因是________ 。
(3)元素B形成带2个单位负电荷的离子 ,其电子式为
,其电子式为________ (用元素符号表示,下同)。
(4)B的一种氧化物容易引起中毒,根据等电子原理写出其结构式_________ 。
(5)下列表述正确且能证明元素A与元素D非金属性强弱的是________ 。
A.A的氢化物比D的氢化物稳定
B.常温下A的单质和D的单质状态不同
C.D的氢化物的酸性比A的氢化物的酸性强
D.一定条件下D的单质能从A的氢化物水溶液中置换出A单质
E.D的氢化物的还原性比A的氢化物的还原性强
(6)测知D的钠盐晶体中相邻的Na+与D-的距离为acm,该晶体密度为dg•cm-3,则阿伏加 德罗常数可表示为_______ 。
A. B.
B. C.
C. D.
D.

元素 | 物质性质或微粒结构 |
A | M层上有2对成对电子 |
B | B的一种核素在考古时常用来鉴定一些文物的年代 |
C | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
D | 元素最高正价是+7价 |
(1)元素A的原子最外层共有
(2)C的氢化物固态时属于
(3)元素B形成带2个单位负电荷的离子
 ,其电子式为
,其电子式为(4)B的一种氧化物容易引起中毒,根据等电子原理写出其结构式
(5)下列表述正确且能证明元素A与元素D非金属性强弱的是
A.A的氢化物比D的氢化物稳定
B.常温下A的单质和D的单质状态不同
C.D的氢化物的酸性比A的氢化物的酸性强
D.一定条件下D的单质能从A的氢化物水溶液中置换出A单质
E.D的氢化物的还原性比A的氢化物的还原性强
(6)测知D的钠盐晶体中相邻的Na+与D-的距离为acm,该晶体密度为dg•cm-3,则阿伏加 德罗常数可表示为
A.
 B.
B. C.
C. D.
D.

您最近一年使用:0次
名校
解题方法
8 . 氮族和碳族元素的单质及其化合物在研究和生产中有着广泛的应用。试回答下列问题:
(1) 是一种重要的化工原料,有毒,
是一种重要的化工原料,有毒, 也是一种食品添加剂,使用时须严格控制用量。已知:
也是一种食品添加剂,使用时须严格控制用量。已知: 有强氧化性,酸性
有强氧化性,酸性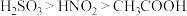 。
。
①亚硝酰氯 是一种红褐色液体,每个原子最外层都达到8电子结构,则其电子式为
是一种红褐色液体,每个原子最外层都达到8电子结构,则其电子式为_____ ,其与水反应会生成两种酸,写出该化学方程式_______ 。
②往冷的 溶液中加入下列某种物质可得
溶液中加入下列某种物质可得 稀溶液,该物质是
稀溶液,该物质是______ (填字母)。
a.稀硫酸 b.二氧化碳 c.二氧化硫 d.醋酸
(2)硅和氯气单质反应可以得到 。
。
①和 互为等电子体的阴离子有
互为等电子体的阴离子有___________ 。(写一种)___________ ,1个 中含有
中含有___________ 个 键。
键。
(3)砷化镓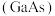 是当前最重要,技术成熟度最高的半导体材料之一,我国“玉兔二号”月球车就是通过砷化镓太阳能电池提供能量。
是当前最重要,技术成熟度最高的半导体材料之一,我国“玉兔二号”月球车就是通过砷化镓太阳能电池提供能量。
①基态 原子外围电子轨道表示式为
原子外围电子轨道表示式为___________ ,N、 、
、 第一电离能由大到小的顺序是
第一电离能由大到小的顺序是___________ 。
②砷化镓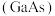 太阳能电池为我国“玉兔二号”月球车提供充足能量。
太阳能电池为我国“玉兔二号”月球车提供充足能量。 的晶胞结构如图甲所示,将
的晶胞结构如图甲所示,将 掺杂到
掺杂到 的晶体中得到稀磁性半导体材料如图乙所示。
的晶体中得到稀磁性半导体材料如图乙所示。 中
中 的化合价为
的化合价为___________ 。在 掺杂到
掺杂到 的晶体中每个
的晶体中每个 最近且等距离的
最近且等距离的 的数目为
的数目为___________ 。
(1)
 是一种重要的化工原料,有毒,
是一种重要的化工原料,有毒, 也是一种食品添加剂,使用时须严格控制用量。已知:
也是一种食品添加剂,使用时须严格控制用量。已知: 有强氧化性,酸性
有强氧化性,酸性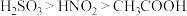 。
。①亚硝酰氯
 是一种红褐色液体,每个原子最外层都达到8电子结构,则其电子式为
是一种红褐色液体,每个原子最外层都达到8电子结构,则其电子式为②往冷的
 溶液中加入下列某种物质可得
溶液中加入下列某种物质可得 稀溶液,该物质是
稀溶液,该物质是a.稀硫酸 b.二氧化碳 c.二氧化硫 d.醋酸
(2)硅和氯气单质反应可以得到
 。
。①和
 互为等电子体的阴离子有
互为等电子体的阴离子有② 与
与 -甲基咪唑(
-甲基咪唑(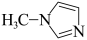 )反应可以得到
)反应可以得到 ,其结构如图所示:
,其结构如图所示:
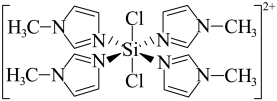
 中含有
中含有 键。
键。(3)砷化镓
 是当前最重要,技术成熟度最高的半导体材料之一,我国“玉兔二号”月球车就是通过砷化镓太阳能电池提供能量。
是当前最重要,技术成熟度最高的半导体材料之一,我国“玉兔二号”月球车就是通过砷化镓太阳能电池提供能量。①基态
 原子外围电子轨道表示式为
原子外围电子轨道表示式为 、
、 第一电离能由大到小的顺序是
第一电离能由大到小的顺序是②砷化镓
 太阳能电池为我国“玉兔二号”月球车提供充足能量。
太阳能电池为我国“玉兔二号”月球车提供充足能量。 的晶胞结构如图甲所示,将
的晶胞结构如图甲所示,将 掺杂到
掺杂到 的晶体中得到稀磁性半导体材料如图乙所示。
的晶体中得到稀磁性半导体材料如图乙所示。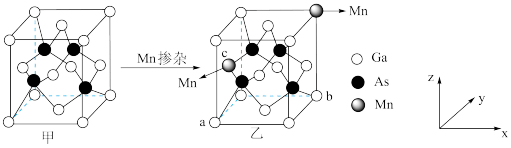
 中
中 的化合价为
的化合价为 掺杂到
掺杂到 的晶体中每个
的晶体中每个 最近且等距离的
最近且等距离的 的数目为
的数目为
您最近一年使用:0次
9 . 卤族元素相关物质在生产、生活中应用广泛。回答下列问题:
(1)卤族元素在周期表中处于_______ 区。
(2)卤族元素化合物的性质有相似性和递变性,下列说法不正确 的是_______。
(3)NF3的结构与NH3类似,但是性质差异较大。
①NF3的空间结构名称为_______ 。N原子的轨道杂化类型为_______ 。
②NH3具有碱性(可与H+结合)而NF3没有碱性,原因是_______ 。
(4)某晶体含有K、I、O三种元素,是一种性能良好的非线性光学材料,其晶胞结构如下图所示。晶胞中K、I、O分别处于顶角、体心、面心位置,边长为anm。
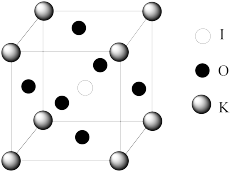
①该晶体的化学式为_______ 。
②与钾原子紧邻的氧原子个数为_______ 。
③已知阿伏加德罗常数的值为NA,则该晶体的密度为_______ g·cm-3(列式表示)。
| 元素 | H | N | F | Cl | Br | I |
| 电负性 | 2.1 | 3.0 | 4.0 | 3.0 | 2.8 | 2.5 |
(2)卤族元素化合物的性质有相似性和递变性,下列说法
| A.HF、HCl、HBr的沸点依次升高 |
| B.Cl2、ICl、IBr沸点依次升高 |
| C.NaF、NaCl、NaBr熔点依次降低 |
| D.H-O-X(X代表Cl、Br、I)的酸性随着X的原子序数递增逐渐增强 |
①NF3的空间结构名称为
②NH3具有碱性(可与H+结合)而NF3没有碱性,原因是
(4)某晶体含有K、I、O三种元素,是一种性能良好的非线性光学材料,其晶胞结构如下图所示。晶胞中K、I、O分别处于顶角、体心、面心位置,边长为anm。

①该晶体的化学式为
②与钾原子紧邻的氧原子个数为
③已知阿伏加德罗常数的值为NA,则该晶体的密度为
您最近一年使用:0次
10 . A、B、C、D、E为原子序数依次增大的五种前四周期元素。A的核外电子总数与其 周期数相同;B的价电子排布式为nsnnpn+2;C、D为同周期元素,C是同周期元素中离子半径最小的元素,D元素最外层有一个未成对电子;E位于元素周期表的第四周期第IVB族,常用加热ED4溶液的方法制备纳米材料。
回答下列问题:
(1)D原子的价电子排布图为___________ ,E原子核外有_____ 个未成对电子,五种元素中电负性最大的是___________ (填元素符号)。
(2)化合物D2B的中心原子的杂化方式为______________ ,它的VSEPR模型名称____________ ,分子的立体构型为_____________ 。
(3)与分子晶体D2B3互为等电子体的一种分子为____________ (填化学式)。
(4)由A、B、D三种元素所形成的一系列化合物中氧化性最强的是_______ (填化学式,下同),酸性最强的是_________________ 。
(5)单质B有两种同素异形体,其中沸点高的是______ (填分子式),原因是__________ 。
(6)C与D能形成化合物Q。在1.01×105Pa、T1℃时,气体摩尔体积为53.4L/mol,实验测得Q的气态密度为5.00g/L,则此时Q的化学式为____________________ 。
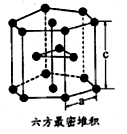
(7)E单质有两种同素异形体,高温下是体心立方堆积,但在常温下的晶体结构为如图所示的六方最密堆积。已知晶胞参数分别为acm和ccm,则该晶体的密度可表示为______ g·cm-3。(用含a和c的式子表示,用NA表示阿伏伽德罗常数的值)。
 。
。
回答下列问题:
(1)D原子的价电子排布图为
(2)化合物D2B的中心原子的杂化方式为
(3)与分子晶体D2B3互为等电子体的一种分子为
(4)由A、B、D三种元素所形成的一系列化合物中氧化性最强的是
(5)单质B有两种同素异形体,其中沸点高的是
(6)C与D能形成化合物Q。在1.01×105Pa、T1℃时,气体摩尔体积为53.4L/mol,实验测得Q的气态密度为5.00g/L,则此时Q的化学式为
(7)E单质有两种同素异形体,高温下是体心立方堆积,但在常温下的晶体结构为如图所示的六方最密堆积。已知晶胞参数分别为acm和ccm,则该晶体的密度可表示为
 。
。
您最近一年使用:0次



