1 . 硝基胍是固体火箭推进剂的重要组分,其结构简式如图所示。
(1)硝基胍分子中含有的共价键类型为___________ (从成键方式角度考虑)。
(2)硝基胍分子中C、H、O、N四种元素,这四种元素___________ (填“能”或“不能”)形成离子化合物。
(3)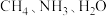 三种分子的中心原子杂化类型相同,但键角大小为
三种分子的中心原子杂化类型相同,但键角大小为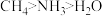 ,原因是
,原因是___________ 。
(4)硝基胍中N原子的杂化方式为___________ 。从结构上分析硝基胍___________ (填“易”或“不”)溶于水,原因是___________ 。
(5)下图中表示的碳原子能量最高的是___________(填字母)。

(1)硝基胍分子中含有的共价键类型为
(2)硝基胍分子中C、H、O、N四种元素,这四种元素
(3)
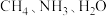 三种分子的中心原子杂化类型相同,但键角大小为
三种分子的中心原子杂化类型相同,但键角大小为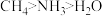 ,原因是
,原因是(4)硝基胍中N原子的杂化方式为
(5)下图中表示的碳原子能量最高的是___________(填字母)。
A.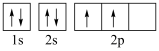 | B.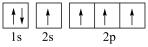 |
C.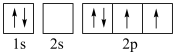 | D.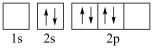 |
您最近一年使用:0次
解题方法
2 . 按要求回答下列问题:
(1)根据价层电子对互斥模型,H2S 、SO2 、SO3 的气态分子中,中心原子价层电子对数不同于其他分子的是___________ 。
(2)晶体中H2O 和 中心原子的杂化轨道类型分别为
中心原子的杂化轨道类型分别为___________ ,试判断 H2O 和  的键角大小关系并说明原因:
的键角大小关系并说明原因:___________ 。
(3)成语“信口雌黄 ”中的雌黄分子式为 As2S3,分子结构如图,As 原子的杂化方式为___________ , 雌黄和 SnCl2 在盐酸中反应转化为雄黄(As4S4)和 SnCl4 并放出 H2S 气体。___________ 。
(5)Zn2+的核外电子排布式为___________ ,在元素周期表中,该元素在___________ (填“s”“p”“d”“f”或“ds”)区。。
(6)S8与热的浓NaOH 溶液反应的产物之一为Na2S3,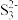 的空间结构为
的空间结构为___________ 。
(7)[H2F]+[SbF6]-(氟酸锑)是一种超强酸,则[H2F]+ 的空间结构为___________ 。
(8)Na3AsO4 中含有的化学键类型包括___________ ; 的空间结构为
的空间结构为 ___________ 。
(1)根据价层电子对互斥模型,H2S 、SO2 、SO3 的气态分子中,中心原子价层电子对数不同于其他分子的是
(2)晶体中H2O 和
 中心原子的杂化轨道类型分别为
中心原子的杂化轨道类型分别为 的键角大小关系并说明原因:
的键角大小关系并说明原因:(3)成语“信口雌黄 ”中的雌黄分子式为 As2S3,分子结构如图,As 原子的杂化方式为

(5)Zn2+的核外电子排布式为
(6)S8与热的浓NaOH 溶液反应的产物之一为Na2S3,
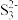 的空间结构为
的空间结构为(7)[H2F]+[SbF6]-(氟酸锑)是一种超强酸,则[H2F]+ 的空间结构为
(8)Na3AsO4 中含有的化学键类型包括
 的空间结构为
的空间结构为
您最近一年使用:0次
名校
解题方法
3 . 碱金属及其化合物在科学研究、生产生活中有广泛应用。请回答下列问题:
(1)基态钠原子核外电子占据能级数为________ ,核外电子共有________ 种不同的运动状态。
(2)与K同周期的元素中,最外层电子数与K相同的为________ (写元素符号)。
(3)在同周期元素中,碱金属元素的________ (填“电负性”“原子半径”或“第一电离能”)最小。
(4)氢化钠晶胞类似氯化钠晶胞(晶胞结构如图1所示)。设氢化钠晶体中钠离子半径为 ,氢离子半径为
,氢离子半径为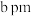 ,并且它们在晶体中紧密堆积,则氢化钠晶胞中离子的空间利用率为
,并且它们在晶体中紧密堆积,则氢化钠晶胞中离子的空间利用率为________ 。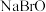 、
、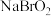 、
、 、
、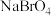 四种钠盐中,Br的杂化方式均为
四种钠盐中,Br的杂化方式均为________ 。
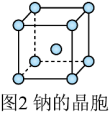
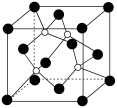
(6)钠晶胞结构如图2所示,配位数为________ 。若钠晶胞的边长为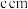 ,
, 代表阿伏加德罗常数的值,则钠晶体的密度为
代表阿伏加德罗常数的值,则钠晶体的密度为________  。
。
(1)基态钠原子核外电子占据能级数为
(2)与K同周期的元素中,最外层电子数与K相同的为
(3)在同周期元素中,碱金属元素的
(4)氢化钠晶胞类似氯化钠晶胞(晶胞结构如图1所示)。设氢化钠晶体中钠离子半径为
 ,氢离子半径为
,氢离子半径为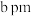 ,并且它们在晶体中紧密堆积,则氢化钠晶胞中离子的空间利用率为
,并且它们在晶体中紧密堆积,则氢化钠晶胞中离子的空间利用率为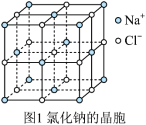
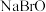 、
、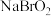 、
、 、
、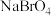 四种钠盐中,Br的杂化方式均为
四种钠盐中,Br的杂化方式均为(6)钠晶胞结构如图2所示,配位数为
 ,
, 代表阿伏加德罗常数的值,则钠晶体的密度为
代表阿伏加德罗常数的值,则钠晶体的密度为 。
。
您最近一年使用:0次
名校
解题方法
4 . 锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]________ ,有________ 个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是__________________ 。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因___________________ 。
(4)光催化还原 制备
制备 反应中,带状纳米
反应中,带状纳米 是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是
是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是________________ 。
(5) 分子的空间构形为
分子的空间构形为________ ,其中Ge原子的杂化方式为________ 。
(1)基态Ge原子的核外电子排布式为[Ar]
(2)Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因
 | 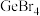 | 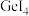 | |
| 熔点/℃ | 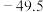 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
 制备
制备 反应中,带状纳米
反应中,带状纳米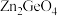 是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是
是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是(5)
 分子的空间构形为
分子的空间构形为
您最近一年使用:0次
解题方法
5 . 依据物质结构知识回答下列问题。
Ⅰ.硒是一种非金属,可以用作光敏材料、电解锰行业的催化剂。
(1)Se是元素周期表中第34号元素,其基态原子的核外电子简化电子排布式为___________ 。
(2)根据价层电子对互斥理论,可以推知 的空间构型为
的空间构型为___________ ,其中Se原子采用的轨道杂化方式为___________ 。
(3)已知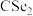 与
与 结构相似,①
结构相似,①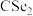 分子内的键角
分子内的键角 、②
、② 分子内的键角
分子内的键角 、③
、③ 分子内的键角
分子内的键角 ,三种键角由大到小的顺序为
,三种键角由大到小的顺序为___________ (填序号)。
Ⅱ.碳是一种重要元素,可形成多种单质及化合物。
(4)已知 与
与 结构相似,推算HCN分子中
结构相似,推算HCN分子中 键与
键与 键数目之比为
键数目之比为___________ 。氨基氰( )为原料可制得类石墨相氮化碳(
)为原料可制得类石墨相氮化碳( ),氨基氰(
),氨基氰( )分子中碳、氮原子均满足8电子稳定结构,则该分子的结构式为
)分子中碳、氮原子均满足8电子稳定结构,则该分子的结构式为___________ 。
(5)“C919”飞机机身使用的复合材料——碳纤维和环氧树脂。下列电子排布图能表示碳原子的最低能量状态的是___________。
Ⅰ.硒是一种非金属,可以用作光敏材料、电解锰行业的催化剂。
(1)Se是元素周期表中第34号元素,其基态原子的核外电子简化电子排布式为
(2)根据价层电子对互斥理论,可以推知
 的空间构型为
的空间构型为(3)已知
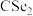 与
与 结构相似,①
结构相似,①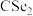 分子内的键角
分子内的键角 、②
、② 分子内的键角
分子内的键角 、③
、③ 分子内的键角
分子内的键角 ,三种键角由大到小的顺序为
,三种键角由大到小的顺序为Ⅱ.碳是一种重要元素,可形成多种单质及化合物。
(4)已知
 与
与 结构相似,推算HCN分子中
结构相似,推算HCN分子中 键与
键与 键数目之比为
键数目之比为 )为原料可制得类石墨相氮化碳(
)为原料可制得类石墨相氮化碳( ),氨基氰(
),氨基氰( )分子中碳、氮原子均满足8电子稳定结构,则该分子的结构式为
)分子中碳、氮原子均满足8电子稳定结构,则该分子的结构式为(5)“C919”飞机机身使用的复合材料——碳纤维和环氧树脂。下列电子排布图能表示碳原子的最低能量状态的是___________。
A. | B. |
C.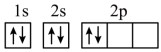 | D.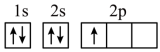 |
您最近一年使用:0次
名校
6 . 氯吡苯脲是一种常用的膨大剂,是经过国家批准的植物生长调节剂,实践证明长期使用对人体无害。其结构简式如图:
(1)按照核外电子的排布,氯吡苯脲中涉及的元素属于元素周期表的s区和_______ 区。
(2)氯吡苯脲的晶体中,氮原子的杂化轨道类型为_______ ,H原子可以与Cl原子通过_______ (填“s-pσ键”或“p-pσ键”)形成H-Cl共价键。
(3)氯吡苯脲晶体中,微粒间的作用力类型有_______ (填字母)。
A.离子键 B.极性键 C.非极性键 D.π键 E.氢键
(4)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲。_______ 个σ键、断裂_______ 个π键。
(5)膨大剂能在动物体内代谢,其产物较为复杂,其中有H2O、NH3、CO2等,请用共价键理论解释H2O分子比NH3分子稳定的原因:_______ 。
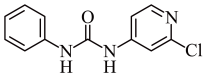
(1)按照核外电子的排布,氯吡苯脲中涉及的元素属于元素周期表的s区和
(2)氯吡苯脲的晶体中,氮原子的杂化轨道类型为
(3)氯吡苯脲晶体中,微粒间的作用力类型有
A.离子键 B.极性键 C.非极性键 D.π键 E.氢键
(4)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲。
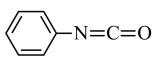 +
+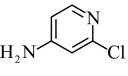 →
→
(5)膨大剂能在动物体内代谢,其产物较为复杂,其中有H2O、NH3、CO2等,请用共价键理论解释H2O分子比NH3分子稳定的原因:
您最近一年使用:0次
解题方法
7 . 回答下列问题:
(1)1 mol CO2中含有的σ键数目为_______ ,π键数目为_______ 。
(2)CH4、NH3、H2O、HF分子中共价键的极性由强到弱的顺序是_______ 。
(3)铜原子的价层电子排布图:_______ ,写出钴的简化电子排布式_______ ,基态Fe2+与Fe3+离子中未成对的电子数之比为_______ 。
(4)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_______ 、_______ (填标号)。
A. B.
B. 
C.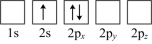 D.
D. 
(5)bte的分子式为C6H8N6,其结构简式如图所示:

①bte分子中碳原子轨道杂化类型为_______ 。
②1 mol bte分子中含σ键的数目为_______ mol。
(6)一个Cu2O晶胞(见图)中,Cu原子的数目为_______ 。

(1)1 mol CO2中含有的σ键数目为
(2)CH4、NH3、H2O、HF分子中共价键的极性由强到弱的顺序是
(3)铜原子的价层电子排布图:
(4)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为
A.
 B.
B. 
C.
 D.
D. 
(5)bte的分子式为C6H8N6,其结构简式如图所示:

①bte分子中碳原子轨道杂化类型为
②1 mol bte分子中含σ键的数目为
(6)一个Cu2O晶胞(见图)中,Cu原子的数目为

您最近一年使用:0次
名校
解题方法
8 . 中科院大连化学物理研究所科学家用Ni-BaH3/Al2O3、Ni-LiH等作催化剂,实现了在常压、100~300℃的条件下合成氨,这一成果发表在《Nature Energy》杂志上。
(1)基态 的核外电子排布式为
的核外电子排布式为___________ ,若该离子核外电子空间运动状态有15种,则该离子处于___________ (填“基”或“激发”)态。
(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(NH2CH2COOH)是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
①硝酸溶液中 的空间构型为
的空间构型为___________ 。
②甘氨酸中C原子的杂化方式为___________ ,晶体类型是___________ ,其熔、沸点远高于相对分子质量几乎相等的丙酸(熔点为-21℃,沸点为141℃)的主要原因:一是甘氨酸能形成内盐;二是___________ 。
(3)比较NH3分子(前者)和在 中NH3(后者)分子中∠H-N-H的键角大小,前者
中NH3(后者)分子中∠H-N-H的键角大小,前者___________ 后者。(填“>”、“<”或“=”)
(4)亚氨基锂(Li2NH,摩尔质量为M g/mol),是一种储氢容量高、安全性能好的固体储氢材料,其晶胞结构如图所示,若晶胞参数为dpm,密度为ρg/cm3,则阿伏加德罗常数
___________  (列出表达式)。
(列出表达式)。

(1)基态
 的核外电子排布式为
的核外电子排布式为(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(NH2CH2COOH)是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
①硝酸溶液中
 的空间构型为
的空间构型为②甘氨酸中C原子的杂化方式为
(3)比较NH3分子(前者)和在
 中NH3(后者)分子中∠H-N-H的键角大小,前者
中NH3(后者)分子中∠H-N-H的键角大小,前者(4)亚氨基锂(Li2NH,摩尔质量为M g/mol),是一种储氢容量高、安全性能好的固体储氢材料,其晶胞结构如图所示,若晶胞参数为dpm,密度为ρg/cm3,则阿伏加德罗常数

 (列出表达式)。
(列出表达式)。
您最近一年使用:0次
2023-09-13更新
|
270次组卷
|
2卷引用:甘肃省民乐县第一中学2023-2024学年高三10月月考化学试题
名校
9 . 氮、磷及其化合物在工农业生产中都有重要用途。
(1)基态磷原子的价层电子的轨道表示式为___________ 。
(2)元素B、N、O的第一电离能由大到小的顺序为___________ 。
(3)一种食品添加剂NaNO2中 的中心原子的杂化类型是
的中心原子的杂化类型是___________ 。
(4)N2H4可用作火箭燃料,其相对分子质量与氧气相同,它在常温常压下是液态,而氧气是气态,造成这种差异的主要原因是___________ 。
(5)磷化硼晶体晶胞结构如图所示,其中大球为磷原子,在一个晶胞中磷原子的配位数为___________ ;已知该晶胞边长为apm,阿伏加德罗常数的值为NA,则磷化硼晶体的密度为___________  (用含a、NA的代数式表示)。
(用含a、NA的代数式表示)。
(1)基态磷原子的价层电子的轨道表示式为
(2)元素B、N、O的第一电离能由大到小的顺序为
(3)一种食品添加剂NaNO2中
 的中心原子的杂化类型是
的中心原子的杂化类型是(4)N2H4可用作火箭燃料,其相对分子质量与氧气相同,它在常温常压下是液态,而氧气是气态,造成这种差异的主要原因是
(5)磷化硼晶体晶胞结构如图所示,其中大球为磷原子,在一个晶胞中磷原子的配位数为
 (用含a、NA的代数式表示)。
(用含a、NA的代数式表示)。
您最近一年使用:0次
名校
10 . H、C、N、O、S是重要的非金属元素,请按要求回答下列问题:
(1)C元素的一种氢化物(分子中含有6个原子)是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是___________ (填字母)。
a.该氢化物分子中C原子采取sp2杂化
b.6个原子不在同一平面上
c.只含有4个 键和1个p-pπ键
键和1个p-pπ键
d.分子既含有极性键又含有非极性键
(2)相同条件下比较CO2与SO2分子在水中的溶解度理由是:___________ 。 中的O-C-O键角
中的O-C-O键角___________ (填“>”“<”或“=”) 中的O—S—O键角。
中的O—S—O键角。
(3)已知(CN)2是直线形分子,且有对称性,则(CN)2分子的结构式为___________ ;其中π键与σ键的个数比为___________ 。
(1)C元素的一种氢化物(分子中含有6个原子)是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是
a.该氢化物分子中C原子采取sp2杂化
b.6个原子不在同一平面上
c.只含有4个
 键和1个p-pπ键
键和1个p-pπ键d.分子既含有极性键又含有非极性键
(2)相同条件下比较CO2与SO2分子在水中的溶解度理由是:
 中的O-C-O键角
中的O-C-O键角 中的O—S—O键角。
中的O—S—O键角。(3)已知(CN)2是直线形分子,且有对称性,则(CN)2分子的结构式为
您最近一年使用:0次



