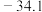名校
解题方法
1 . X、Y、Z、M、Q、R是元素周期表前四周期元素,且原子序数依次增大,根据下表相关信息完成以下问题:
(1)X的简单气态氢化物分子的空间结构名称为___________ 。
(2)X、Y对应的简单气态氢化物稳定性由大到小的顺序___________ (用物质化学式表示)。
(3)X、Y、Z、M四种元素的简单离子半径由大到小的顺序是___________ (用离子符号表示)。试从原子结构的角度解释,X的第一电离能比Y大的原因___________ 。
(4)请写出Q元素基态原子的价电子排布图___________ 。
(5)R元素可形成R2+和R3+离子,其中较稳定的是R3+,原因是___________ 。
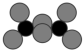
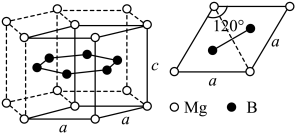
(6)实验发现M的氯化物处于熔融状态时常以二聚态(M2Cl6)形式存在。其球棍模型如图。___________ 杂化。M的氟化物的熔点为1090℃,远高于M氯化物的熔点192℃,请解释原因___________ 。
| 元素 | 相关信息 |
| X | 原子核外有7种不同运动状态的电子 |
| Y | 基态原子中s电子总数与p电子总数相等 |
| Z | 位于第三周期,原子半径在同周期元素中最大 |
| M | 逐级电离能(kJ·mol-1)依次为578、1817、2745、11575、14830、18376 |
| Q | 基态原子的最外层p轨道上有两个电子的自旋方向与其他电子的自旋方向相反 |
| R | 基态原子核外有4个未成对电子 |
(2)X、Y对应的简单气态氢化物稳定性由大到小的顺序
(3)X、Y、Z、M四种元素的简单离子半径由大到小的顺序是
(4)请写出Q元素基态原子的价电子排布图
(5)R元素可形成R2+和R3+离子,其中较稳定的是R3+,原因是
(6)实验发现M的氯化物处于熔融状态时常以二聚态(M2Cl6)形式存在。其球棍模型如图。

您最近一年使用:0次
名校
解题方法
2 . 中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量橄榄石矿物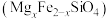 。回答下列问题:
。回答下列问题:
(1)已知一些物质的熔点数据如下表:
Na与Si均为第三周期元素, 熔点明显高于
熔点明显高于 ,原因是
,原因是______________________ 。
分析同族元素的氯化物 、
、 、
、 熔点变化趋势及其原因
熔点变化趋势及其原因________________ 。
 的空间结构为
的空间结构为__________ ,其中Si的轨道杂化形式为__________ 。
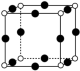
(2)一种硼镁化合物具有超导性能,晶体结构属于立方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,晶胞中含有__________ 个Mg。该物质化学式为__________ ,B——B最近距离为__________ 。 通常以二聚体
通常以二聚体 的形式存在,其空间结构如图a所示,二聚体中Al的轨道杂化类型为
的形式存在,其空间结构如图a所示,二聚体中Al的轨道杂化类型为__________ 。 的熔点为1090℃,远高于
的熔点为1090℃,远高于 的192℃,由此可以判断铝氟之间的化学键为
的192℃,由此可以判断铝氟之间的化学键为__________ 。 结构属立方晶系,晶胞如图b所示,
结构属立方晶系,晶胞如图b所示, 的配位数为
的配位数为__________ 。若晶胞参数为a pm,晶体密度
__________  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
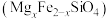 。回答下列问题:
。回答下列问题:(1)已知一些物质的熔点数据如下表:
物质 |
|
|
|
|
熔点/℃ | 800.7 |
|
|
|
 熔点明显高于
熔点明显高于 ,原因是
,原因是分析同族元素的氯化物
 、
、 、
、 熔点变化趋势及其原因
熔点变化趋势及其原因 的空间结构为
的空间结构为(2)一种硼镁化合物具有超导性能,晶体结构属于立方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,晶胞中含有
 通常以二聚体
通常以二聚体 的形式存在,其空间结构如图a所示,二聚体中Al的轨道杂化类型为
的形式存在,其空间结构如图a所示,二聚体中Al的轨道杂化类型为 的熔点为1090℃,远高于
的熔点为1090℃,远高于 的192℃,由此可以判断铝氟之间的化学键为
的192℃,由此可以判断铝氟之间的化学键为 结构属立方晶系,晶胞如图b所示,
结构属立方晶系,晶胞如图b所示, 的配位数为
的配位数为
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
名校
3 . 回答下列问题
(1)Si原子结构示意图为___________ ,在硅酸盐中, 四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,Si与O的原子数之比为
四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,Si与O的原子数之比为___________ 。___________ ,写出检验过程中生成配位数为6的配合物的离子方程式 ___________ 。
(3)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示,石墨烯是从石墨材料中剥离出来的,下列说法正确的是___________ 。
B.石墨中的碳原子采取sp2杂化,金刚石晶体中,C原子采取 杂化
杂化
C.石墨属于混合型晶体,层与层之间存在分子间作用力
D.在金刚石晶体中,C原子所连接的最小环为六元环,每个C原子连接12个六元环,六元环中最多有4个C原子在同一平面
E.石墨烯中平均每个六元碳环含有3个碳原子
(4)经X射线衍射测定发现,晶体钴的晶胞和堆积方式剖面图如下图所示,则该晶胞中含钴原子个数为___________ 个,若该堆积方式下钴原子的半径为r,则该晶体的空间利用率为___________ (用含π的代数式表示。空间利用率=原子总体积与晶胞体积之比)。
(1)Si原子结构示意图为
 四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,Si与O的原子数之比为
四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,Si与O的原子数之比为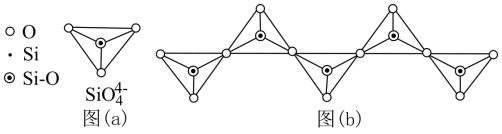
(3)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示,石墨烯是从石墨材料中剥离出来的,下列说法正确的是
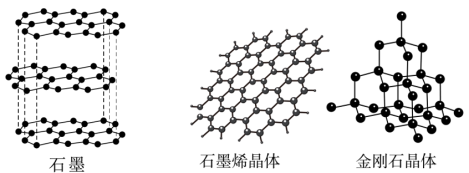
B.石墨中的碳原子采取sp2杂化,金刚石晶体中,C原子采取
 杂化
杂化C.石墨属于混合型晶体,层与层之间存在分子间作用力
D.在金刚石晶体中,C原子所连接的最小环为六元环,每个C原子连接12个六元环,六元环中最多有4个C原子在同一平面
E.石墨烯中平均每个六元碳环含有3个碳原子
(4)经X射线衍射测定发现,晶体钴的晶胞和堆积方式剖面图如下图所示,则该晶胞中含钴原子个数为


您最近一年使用:0次
名校
解题方法
4 . 铜是常见的、用途广泛的金属元素之一、
(1)基态Cu原子核外未成对电子所在的原子轨道是_______ 。
(2)一价铜离子某配合物的结构如图所示:_______ 。
②上述配合物中所含元素电负性由大到小的顺序为_______ (用元素符号表示)。
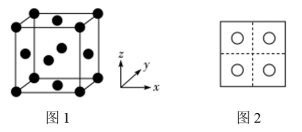
(3)常见的铜的氧化物有CuO和 两种。已知:CuO晶胞中
两种。已知:CuO晶胞中 的位置如图1所示;两种晶胞中
的位置如图1所示;两种晶胞中 和
和 的位置相同,其在晶胞侧视图中的位置相同(如图2),假设两种晶胞的参数相同,CuO晶体的密度是
的位置相同,其在晶胞侧视图中的位置相同(如图2),假设两种晶胞的参数相同,CuO晶体的密度是 。
。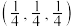 、
、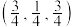 、
、_______ 和_______ 。
② 晶体的密度是
晶体的密度是_______  (用含
(用含 的代数式表示)。
的代数式表示)。
(1)基态Cu原子核外未成对电子所在的原子轨道是
(2)一价铜离子某配合物的结构如图所示:

②上述配合物中所含元素电负性由大到小的顺序为
(3)常见的铜的氧化物有CuO和
 两种。已知:CuO晶胞中
两种。已知:CuO晶胞中 的位置如图1所示;两种晶胞中
的位置如图1所示;两种晶胞中 和
和 的位置相同,其在晶胞侧视图中的位置相同(如图2),假设两种晶胞的参数相同,CuO晶体的密度是
的位置相同,其在晶胞侧视图中的位置相同(如图2),假设两种晶胞的参数相同,CuO晶体的密度是 。
。
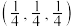 、
、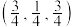 、
、②
 晶体的密度是
晶体的密度是 (用含
(用含 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
解题方法
5 . 含硒(Se)化合物在材料药物领域有重要应用。
(1)Se与S同族,基态Se原子的简化电子排布式为___________ ,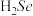 的沸点高于
的沸点高于 ,原因是
,原因是___________ 。
(2)一种含硒的新型 (聚集诱导发光)分子Ⅳ的合成路线如下,下列关于路线中I~Ⅳ的说法正确的有___________。
(聚集诱导发光)分子Ⅳ的合成路线如下,下列关于路线中I~Ⅳ的说法正确的有___________。
(3)硒的两种含氧酸的酸性强弱为
___________  (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠 可减轻重金属铊(
可减轻重金属铊( )引起的中毒,
)引起的中毒, 的空间结构为
的空间结构为___________ 。
(4)铊( )与
)与 同族,第一电离能
同族,第一电离能
___________  (填“>”或“<”)。
(填“>”或“<”)。
(5)根据下表中元素的电负性数值判断, 为
为___________ (填“离子化合物”或“共价化合物”,下同), 为
为___________ 。
(6)气态 通常以二聚体
通常以二聚体 的形式存在,其空间结构如图a所示,二聚体中
的形式存在,其空间结构如图a所示,二聚体中 的轨道杂化类型为
的轨道杂化类型为___________ 。 结构如图b所示,若晶胞参数(立方体棱长)为
结构如图b所示,若晶胞参数(立方体棱长)为 ,则晶体密度
,则晶体密度
___________  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
(1)Se与S同族,基态Se原子的简化电子排布式为
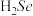 的沸点高于
的沸点高于 ,原因是
,原因是(2)一种含硒的新型
 (聚集诱导发光)分子Ⅳ的合成路线如下,下列关于路线中I~Ⅳ的说法正确的有___________。
(聚集诱导发光)分子Ⅳ的合成路线如下,下列关于路线中I~Ⅳ的说法正确的有___________。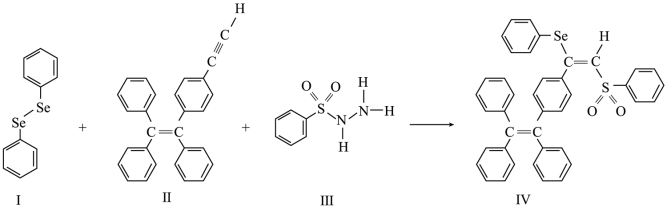
A.Ⅰ中含有两种元素, 键为非极性键 键为非极性键 |
B.Ⅱ中C原子的杂化轨道类型有 与 与 |
| C.Ⅲ中含有的元素中,O的电负性最大 |
D.Ⅳ中 原子的杂化轨道类型为 原子的杂化轨道类型为 |
(3)硒的两种含氧酸的酸性强弱为

 (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠 可减轻重金属铊(
可减轻重金属铊( )引起的中毒,
)引起的中毒, 的空间结构为
的空间结构为(4)铊(
 )与
)与 同族,第一电离能
同族,第一电离能
 (填“>”或“<”)。
(填“>”或“<”)。(5)根据下表中元素的电负性数值判断,
 为
为 为
为| 元素 | F |  |  |
| 电负性 | 4.0 | 1.5 | 3.0 |
(6)气态
 通常以二聚体
通常以二聚体 的形式存在,其空间结构如图a所示,二聚体中
的形式存在,其空间结构如图a所示,二聚体中 的轨道杂化类型为
的轨道杂化类型为 结构如图b所示,若晶胞参数(立方体棱长)为
结构如图b所示,若晶胞参数(立方体棱长)为 ,则晶体密度
,则晶体密度
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
|
|
| 图a | 图b |
您最近一年使用:0次
名校
解题方法
6 . 第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
(1)镓的基态原子电子排布式是
(2)多酚氧化酶与植物的抗病性有关。配合物
 是多酚氧化酶的模型配合物(如图所示)。
是多酚氧化酶的模型配合物(如图所示)。
①EDTA中N的杂化轨道类型为
②一个邻苯二胺分子中σ键的数目为
③EDTB分子中所含元素的电负性由小到大的顺序为
④配离子 中的配位原子是
中的配位原子是
(3)向盛有硫酸铜水溶液的试管中加入氨水,首先形成蓝色沉淀,继续加入氨水,沉淀溶解得到深蓝色透明溶液,蓝色沉淀溶解的原因是
(4)铁和氮组成一种过渡金属氮化物,其结构如图所示。直六棱柱的底边边长为xpm,高为ypm,阿伏加德罗常数的值为NA,则晶体的密度表达式为

您最近一年使用:0次
名校
解题方法
7 . 过渡金属及其化合物在生产、生活中有重要的应用。回答下列问题:
(1)一种含Ti的催化剂X能催化乙烯、丙烯等的聚合,其结构如图所示。X中C原子的杂化类型有________ ,含有的作用力类型有________ (填字母),非金属元素电负性由大到小的顺序为________ 。
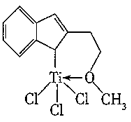
A.π键 B.氢键 C.配位键 D.σ键 E.离子键
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于_______ (填晶体类型)。Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=_______ 。
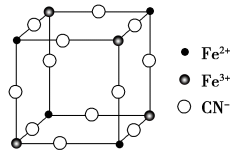
(3)有一种蓝色晶体可表示为MxFey(CN)6,经X射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上。其晶体中阴离子的最小结构单元如图所示,通过计算x和y的数值,可进一步确定该晶体的化学式为_______ ,该晶体属于_______ 晶体,M呈_______ 价。
(1)一种含Ti的催化剂X能催化乙烯、丙烯等的聚合,其结构如图所示。X中C原子的杂化类型有

A.π键 B.氢键 C.配位键 D.σ键 E.离子键
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于
(3)有一种蓝色晶体可表示为MxFey(CN)6,经X射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上。其晶体中阴离子的最小结构单元如图所示,通过计算x和y的数值,可进一步确定该晶体的化学式为

您最近一年使用:0次
名校
解题方法
8 . 《自然·通讯》近日发表了我国复旦大学魏大程团队开发的一种共形六方氮化硼修饰技术,可直接在二氧化硅表面生长高质量六方氮化硼薄膜。
(1)基态B原子的电子排布式为________ ,第二周期主族元素中,第一电离能在B和N之间的元素有________ 种。
(2)Na与N形成的NaN3可用于制造汽车的安全气囊,其中阴离子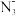 的空间构型为
的空间构型为________ ,Na在空气中燃烧发出黄色火焰,这种焰色用光谱仪摄取的光谱为________ 光谱(填“发射”或“吸收”)。
(3)BH3.NH3是一种有效、安全的固体储氢材料,可由BH3与NH3反应生成,BH3.NH3分子中B与N之间形成配位键,提供空轨道的原子为________ (填元素符号),分子中B原子的杂化类型为________ 。
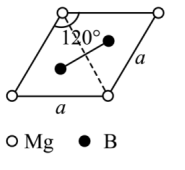
(4)一种硼镁化合物具有超导性能,晶体结构属于立方晶系,其晶体结构、晶胞沿c轴的投影图如图所示,该物质化学式为________ ,B—B键最近距离为________ 。

(1)基态B原子的电子排布式为
(2)Na与N形成的NaN3可用于制造汽车的安全气囊,其中阴离子
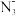 的空间构型为
的空间构型为(3)BH3.NH3是一种有效、安全的固体储氢材料,可由BH3与NH3反应生成,BH3.NH3分子中B与N之间形成配位键,提供空轨道的原子为
(4)一种硼镁化合物具有超导性能,晶体结构属于立方晶系,其晶体结构、晶胞沿c轴的投影图如图所示,该物质化学式为


您最近一年使用:0次
名校
9 . 卤族元素的单质和化合物在生产生活中有重要的用途。请回答:
(1)卤素元素位于元素周期表的___________ 区,溴原子的原子核外有___________ 种不同运动状态的电子,其M能层电子排布式为___________ 。
(2) 中心原子的杂化类型为
中心原子的杂化类型为___________ , 的空间构型为
的空间构型为___________ 。
(3)一定条件下 与
与 以物质的量之比为
以物质的量之比为 混舍得到一种固态离子化合物,其结构组成可能为:(a)
混舍得到一种固态离子化合物,其结构组成可能为:(a)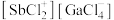 或(b)
或(b)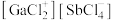 ,该离子化合物最可能的结构组成为
,该离子化合物最可能的结构组成为___________ (填“a”或“b”),理由是___________ 。
(4)在离子晶体中,当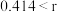 (阳离子)
(阳离子)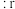 (阴离子)
(阴离子)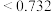 时,
时, 型化合物往往采用和
型化合物往往采用和 晶体相同的晶体结构(如下图1)。已知
晶体相同的晶体结构(如下图1)。已知 ,但在室温下,
,但在室温下, 的晶体结构如下图2所示,称为六方碘化银。
的晶体结构如下图2所示,称为六方碘化银。 的配位数为
的配位数为___________ ,造成 晶体结构不同于
晶体结构不同于 晶体结构的原因不可能是
晶体结构的原因不可能是___________ 。
a.几何因素 b.电荷因素 c.键性因素
若六方碘化银晶胞底边边长为 ,高为
,高为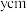 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,碘化银晶体的密度为
,碘化银晶体的密度为___________ 列出计算式。
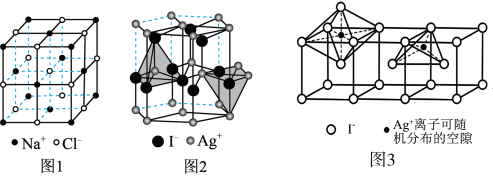
(5)当温度处于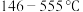 间时,六方碘化银转化为
间时,六方碘化银转化为 (如图3),
(如图3), 可随机地分布在四面体空隙和八面体空隙中,多面体空隙间又彼此共面相连,则在
可随机地分布在四面体空隙和八面体空隙中,多面体空隙间又彼此共面相连,则在 晶体中,
晶体中, (八面体空隙):n(四面体空隙)=
(八面体空隙):n(四面体空隙)=___________ 。
(1)卤素元素位于元素周期表的
(2)
 中心原子的杂化类型为
中心原子的杂化类型为 的空间构型为
的空间构型为(3)一定条件下
 与
与 以物质的量之比为
以物质的量之比为 混舍得到一种固态离子化合物,其结构组成可能为:(a)
混舍得到一种固态离子化合物,其结构组成可能为:(a)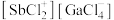 或(b)
或(b)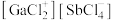 ,该离子化合物最可能的结构组成为
,该离子化合物最可能的结构组成为(4)在离子晶体中,当
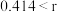 (阳离子)
(阳离子)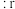 (阴离子)
(阴离子)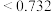 时,
时, 型化合物往往采用和
型化合物往往采用和 晶体相同的晶体结构(如下图1)。已知
晶体相同的晶体结构(如下图1)。已知 ,但在室温下,
,但在室温下, 的晶体结构如下图2所示,称为六方碘化银。
的晶体结构如下图2所示,称为六方碘化银。 的配位数为
的配位数为 晶体结构不同于
晶体结构不同于 晶体结构的原因不可能是
晶体结构的原因不可能是a.几何因素 b.电荷因素 c.键性因素
若六方碘化银晶胞底边边长为
 ,高为
,高为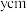 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,碘化银晶体的密度为
,碘化银晶体的密度为
(5)当温度处于
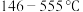 间时,六方碘化银转化为
间时,六方碘化银转化为 (如图3),
(如图3), 可随机地分布在四面体空隙和八面体空隙中,多面体空隙间又彼此共面相连,则在
可随机地分布在四面体空隙和八面体空隙中,多面体空隙间又彼此共面相连,则在 晶体中,
晶体中, (八面体空隙):n(四面体空隙)=
(八面体空隙):n(四面体空隙)=
您最近一年使用:0次
名校
解题方法
10 . 2021年5月中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量橄榄石矿物 。回答下列问题:
。回答下列问题:
(1)基态 原子的价电子排布式为
原子的价电子排布式为___________ , 元素电负性由大到小顺序为
元素电负性由大到小顺序为___________ 。橄榄石中,铁的化合价为___________ 。
(2)已知 的熔点数据如下表:
的熔点数据如下表:
 与
与 均为第三周期元素,
均为第三周期元素, 熔点明显高于
熔点明显高于 ,原因是
,原因是___________ 。已知同族元素的氯化物 晶体类型相同,推测三者熔点由小到大的顺序是
晶体类型相同,推测三者熔点由小到大的顺序是___________ 。SiCl4的空间结构为___________ ,其中Si的轨道杂化形式为___________ 。
(3)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿 轴的投影图如图所示,该物质化学式为
轴的投影图如图所示,该物质化学式为___________ 。已知在投影图中, 位于三个
位于三个 形成的正三角形的中心,则
形成的正三角形的中心,则 最近距离为
最近距离为___________ 。
 。回答下列问题:
。回答下列问题:(1)基态
 原子的价电子排布式为
原子的价电子排布式为 元素电负性由大到小顺序为
元素电负性由大到小顺序为(2)已知
 的熔点数据如下表:
的熔点数据如下表:| 物质 |  |  |
熔点 | 800.7 |  |
 与
与 均为第三周期元素,
均为第三周期元素, 熔点明显高于
熔点明显高于 ,原因是
,原因是 晶体类型相同,推测三者熔点由小到大的顺序是
晶体类型相同,推测三者熔点由小到大的顺序是(3)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿
 轴的投影图如图所示,该物质化学式为
轴的投影图如图所示,该物质化学式为 位于三个
位于三个 形成的正三角形的中心,则
形成的正三角形的中心,则 最近距离为
最近距离为
您最近一年使用:0次
2024-02-19更新
|
223次组卷
|
4卷引用:黑龙江省哈尔滨市双城区兆麟中学2023-2024学年高二下学期4月月考化学试题