1 . 中国幅员辽阔,有丰富的金、银、铜、铅等矿产资源。根据所学知识回答下列问题:
(1)已知金的价电子排布式为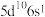 ,则其位于元素周期表
,则其位于元素周期表___________ 区。
(2)某种配合物结构如图(H原子未给出)。___________ (填元素符号)。
②该配合物中N、O、S三种元素的第一电离能由大到小的顺序为___________ 。
③该配合物中键角∠O—S—O___________ (填“>”“<”或“=”)∠C—N—C。
(3)铜及其化合物常用作催化剂,如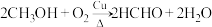 。
。
① 分子中O原子的杂化轨道类型为
分子中O原子的杂化轨道类型为___________ 。
② 易溶于水,原因是
易溶于水,原因是___________ 、___________ 。
③ 的立体构型为
的立体构型为___________ ,其分子中含有的 键与
键与 键数目之比为
键数目之比为___________ 。
(4)Pb、S形成的某种晶体结构示意图如图,设晶胞参数为a pm, 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。___________ 。
②该晶体的密度为___________  。
。
(1)已知金的价电子排布式为
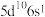 ,则其位于元素周期表
,则其位于元素周期表(2)某种配合物结构如图(H原子未给出)。
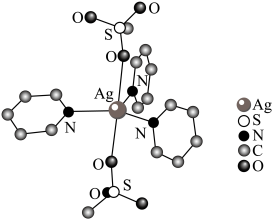
②该配合物中N、O、S三种元素的第一电离能由大到小的顺序为
③该配合物中键角∠O—S—O
(3)铜及其化合物常用作催化剂,如
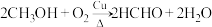 。
。①
 分子中O原子的杂化轨道类型为
分子中O原子的杂化轨道类型为②
 易溶于水,原因是
易溶于水,原因是③
 的立体构型为
的立体构型为 键与
键与 键数目之比为
键数目之比为(4)Pb、S形成的某种晶体结构示意图如图,设晶胞参数为a pm,
 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。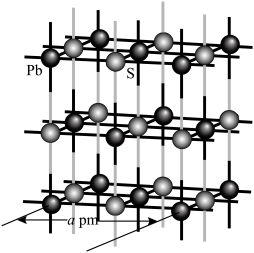
②该晶体的密度为
 。
。
您最近一年使用:0次
解题方法
2 . 羰基钻催化剂可在温和条件下催化氢甲酰化反应,其结构为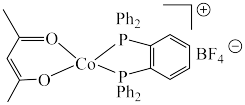 (Ph代表苯基)。回答下列问题:
(Ph代表苯基)。回答下列问题:
(2)羰基钴催化剂中位于第二周期的元素中,电负性由小到大的顺序为
 的晶体类型相同,
的晶体类型相同,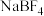 的熔点高于羰基钴催化剂的原因是
的熔点高于羰基钴催化剂的原因是(3)羰基钴催化剂阳离子中Co处于平面四边形中心,羰基钴催化剂中采取
 杂化的元素种数为
杂化的元素种数为 形成羰基钴催化剂过程中,
形成羰基钴催化剂过程中,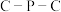 键角
键角(4)一种掺Co催化剂的晶胞结构及晶胞沿面对角线投影如下图所示。晶胞中与Co最近的氧原子所构成的几何形状为
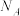 ,晶体的密度为
,晶体的密度为 ,则距离最近的两个氧原子间的距离为
,则距离最近的两个氧原子间的距离为 、
、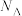 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2024-06-01更新
|
76次组卷
|
2卷引用:2024届青海省西宁市大通县高三下学期三模理科综合试题-高中化学
解题方法
3 . 航空材料、医药、电池工业的发展都离不开化学。砷化镓(GaAs)、碳化硅等是制作半导体芯片的关键材料,磷酸铁锂( )和三元锂电池(正极含有Ni、Co、Mn三种元素)是新能源汽车的常用电池。回答以下问题:
)和三元锂电池(正极含有Ni、Co、Mn三种元素)是新能源汽车的常用电池。回答以下问题:
(1)基态Ga原子的价层电子排布式为________ 。
(2)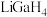 是一种温和的还原剂,可通过反应:
是一种温和的还原剂,可通过反应: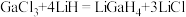 制得。已知
制得。已知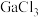 的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为
的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为________ 。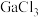 在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:
在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:________ 。
(3) 中四种元素的第一电离能由大到小的顺序是
中四种元素的第一电离能由大到小的顺序是________ (填元素符号),其阴离子的立体构型名称是________ 。
(4)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物 和
和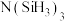 的结构如图所示,
的结构如图所示,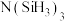 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为________ ,二者中更易与 形成配位键的是
形成配位键的是________ 。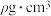 ,晶胞中原子的空间利用率(即晶胞中原子体积占空间体积的百分率为
,晶胞中原子的空间利用率(即晶胞中原子体积占空间体积的百分率为________ 。(用含a、b、p、 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
 )和三元锂电池(正极含有Ni、Co、Mn三种元素)是新能源汽车的常用电池。回答以下问题:
)和三元锂电池(正极含有Ni、Co、Mn三种元素)是新能源汽车的常用电池。回答以下问题:(1)基态Ga原子的价层电子排布式为
(2)
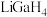 是一种温和的还原剂,可通过反应:
是一种温和的还原剂,可通过反应: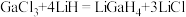 制得。已知
制得。已知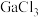 的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为
的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为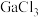 在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:
在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:(3)
 中四种元素的第一电离能由大到小的顺序是
中四种元素的第一电离能由大到小的顺序是(4)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物
 和
和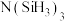 的结构如图所示,
的结构如图所示,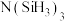 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为 形成配位键的是
形成配位键的是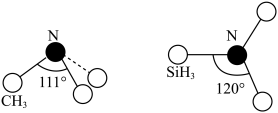
 ,晶胞中原子的空间利用率(即晶胞中原子体积占空间体积的百分率为
,晶胞中原子的空间利用率(即晶胞中原子体积占空间体积的百分率为 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。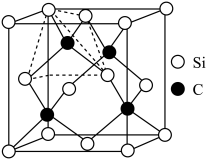
您最近一年使用:0次
4 . 利用钛铁矿(主要成分为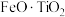 ,还含有少量
,还含有少量 、
、 、
、 等杂质)制备磷酸铁和锂离子电池正极材料(
等杂质)制备磷酸铁和锂离子电池正极材料( )的部分工业流程如图所示:
)的部分工业流程如图所示: (
(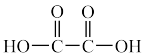 )、
)、 ,中C原子的杂化方式依次为
,中C原子的杂化方式依次为___________ 、___________ 。
(2) 、
、 的熔、沸点:
的熔、沸点: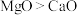 ,原因为
,原因为___________ 。
(3)已知 的配合物有多种,如
的配合物有多种,如 、
、 (
( )等。
)等。
① 的VSEPR模型名称为
的VSEPR模型名称为___________ 。
②从原子结构角度预测 具有较强的还原性,原因为
具有较强的还原性,原因为___________ 。
③配合物 (
( )与游离的
)与游离的 分子相比,配合物中的
分子相比,配合物中的 键角
键角___________ (填“>”“<”或“=”) 中的,原因是
中的,原因是___________ 。
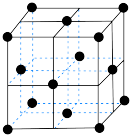
(4)在一定条件下铁形成的晶体的基本结构单元如图所示,设铁原子的半径为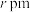 ,则
,则 原子的配位数为
原子的配位数为___________ ,该晶体的密度为___________ (列出计算式) 。
。
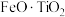 ,还含有少量
,还含有少量 、
、 、
、 等杂质)制备磷酸铁和锂离子电池正极材料(
等杂质)制备磷酸铁和锂离子电池正极材料( )的部分工业流程如图所示:
)的部分工业流程如图所示: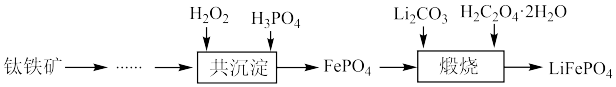
 (
(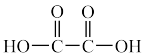 )、
)、 ,中C原子的杂化方式依次为
,中C原子的杂化方式依次为(2)
 、
、 的熔、沸点:
的熔、沸点: ,原因为
,原因为(3)已知
 的配合物有多种,如
的配合物有多种,如 、
、 (
( )等。
)等。①
 的VSEPR模型名称为
的VSEPR模型名称为②从原子结构角度预测
 具有较强的还原性,原因为
具有较强的还原性,原因为③配合物
 (
( )与游离的
)与游离的 分子相比,配合物中的
分子相比,配合物中的 键角
键角 中的,原因是
中的,原因是(4)在一定条件下铁形成的晶体的基本结构单元如图所示,设铁原子的半径为
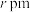 ,则
,则 原子的配位数为
原子的配位数为 。
。
您最近一年使用:0次
2024-05-24更新
|
103次组卷
|
4卷引用:2024届青海省西宁市大通县高三下学期高考四模理科综合试卷-高中化学
解题方法
5 . 元素周期表中第四周期的某些元素在生产、生活中有着广泛的应用。回答下列问题:
(1)砷在自然界中分布广泛,主要用于制砷铅合金、砷铜合金。基态砷原子的价电子排布式为___________ ,砷、硒、溴三种元素电负性由小到大的顺序为___________ (填元素符号), 的空间构型是
的空间构型是___________ 形。
(2)科学家在研究金属矿物质组分的过程中,发现了 等多种金属互化物。确定某种金属互化物是晶体还是非晶体的实验是
等多种金属互化物。确定某种金属互化物是晶体还是非晶体的实验是___________ 。
(3) 能与
能与 反应生成
反应生成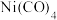 ,其中碳原子的杂化方式是
,其中碳原子的杂化方式是___________ , 键和
键和 键数目之比为
键数目之比为___________ 。
(4) 是钴的一种配合物,向
是钴的一种配合物,向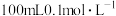 该配合物的溶液中加入足量
该配合物的溶液中加入足量 溶液,生成
溶液,生成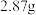 白色沉淀,则该配合物的化学式为
白色沉淀,则该配合物的化学式为___________ ,中心离子的配位数为___________ 。
(5)某离子型铁的氧化物晶胞如图所示,它由X、Y组成,则该氧化物的化学式为___________ 。已知该晶体的密度为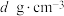 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体的晶胞参数
,则该晶体的晶胞参数
___________  (用含
(用含 和
和 的代数式表示)。
的代数式表示)。
(1)砷在自然界中分布广泛,主要用于制砷铅合金、砷铜合金。基态砷原子的价电子排布式为
 的空间构型是
的空间构型是(2)科学家在研究金属矿物质组分的过程中,发现了
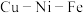 等多种金属互化物。确定某种金属互化物是晶体还是非晶体的实验是
等多种金属互化物。确定某种金属互化物是晶体还是非晶体的实验是(3)
 能与
能与 反应生成
反应生成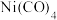 ,其中碳原子的杂化方式是
,其中碳原子的杂化方式是 键和
键和 键数目之比为
键数目之比为(4)
 是钴的一种配合物,向
是钴的一种配合物,向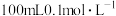 该配合物的溶液中加入足量
该配合物的溶液中加入足量 溶液,生成
溶液,生成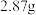 白色沉淀,则该配合物的化学式为
白色沉淀,则该配合物的化学式为(5)某离子型铁的氧化物晶胞如图所示,它由X、Y组成,则该氧化物的化学式为
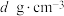 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体的晶胞参数
,则该晶体的晶胞参数
 (用含
(用含 和
和 的代数式表示)。
的代数式表示)。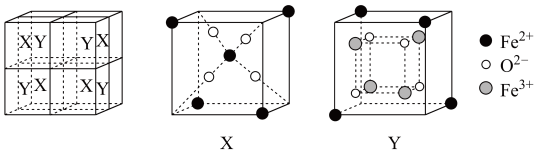
您最近一年使用:0次
6 . 砷化硼和化镓是两种半导体材料。回答下列问题:
(1)基态B原子的核外电子空间运动状态有_____ 种,基态As原子的未成对电子数是_____ 。
(2)镓失去电子的逐级电离能依次为577 、1984
、1984 、2961.8
、2961.8 ,6192
,6192 ,由此推知镓的氧化物化学式可能为
,由此推知镓的氧化物化学式可能为____ 。
(3)通过反应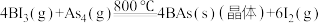 可制备BAs晶体。
可制备BAs晶体。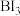 分子中键角为
分子中键角为_______ ;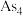 结构与白磷相似,其中As原子杂化方式是
结构与白磷相似,其中As原子杂化方式是_______ ,成键电子对与孤电子对数目之比为______ 。
(4) 的熔点为-126℃,而
的熔点为-126℃,而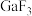 的熔点超过1000℃,二者熔点差异大的原因为
的熔点超过1000℃,二者熔点差异大的原因为______ 。
(5)GaAs的晶胞结构如图所示.它可以看作As作_____ 堆积(填堆积方式),Ga原子处于As原子形成的_____ (填“正四面体”或“正八面体”)空隙中,As原子的配位数为_____ ;GaAs的密度为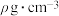 ,Ga和As的相对原子质量分别为a和b,晶胞中Ga与As原子之间最短距离为d pm,则阿伏加德罗常数NA=
,Ga和As的相对原子质量分别为a和b,晶胞中Ga与As原子之间最短距离为d pm,则阿伏加德罗常数NA=______ (列出计算式即可)。
(1)基态B原子的核外电子空间运动状态有
(2)镓失去电子的逐级电离能依次为577
 、1984
、1984 、2961.8
、2961.8 ,6192
,6192 ,由此推知镓的氧化物化学式可能为
,由此推知镓的氧化物化学式可能为(3)通过反应
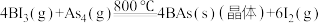 可制备BAs晶体。
可制备BAs晶体。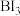 分子中键角为
分子中键角为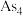 结构与白磷相似,其中As原子杂化方式是
结构与白磷相似,其中As原子杂化方式是(4)
 的熔点为-126℃,而
的熔点为-126℃,而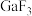 的熔点超过1000℃,二者熔点差异大的原因为
的熔点超过1000℃,二者熔点差异大的原因为(5)GaAs的晶胞结构如图所示.它可以看作As作
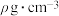 ,Ga和As的相对原子质量分别为a和b,晶胞中Ga与As原子之间最短距离为d pm,则阿伏加德罗常数NA=
,Ga和As的相对原子质量分别为a和b,晶胞中Ga与As原子之间最短距离为d pm,则阿伏加德罗常数NA=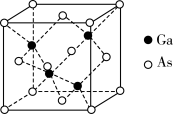
您最近一年使用:0次
解题方法
7 . 氮族元素包括氮(N)、磷(P)、砷( )、锑(
)、锑(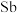 )、铋(
)、铋( )和镆(
)和镆(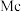 )六种,它们的单质及其化合物在工农业生产中有着重要的用途。回答下列问题:
)六种,它们的单质及其化合物在工农业生产中有着重要的用途。回答下列问题:
(1) 基态原子核外电子排布式为
基态原子核外电子排布式为___________ ,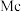 基态原子核外有
基态原子核外有___________ 个未成对电子。
(2) 与同周期元素
与同周期元素 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为___________ 。
(3)氮气分子内存在氮氮三键,性质稳定,试从分子结构的角度解释P、 的单质化学性质比
的单质化学性质比 活泼的原因是
活泼的原因是___________ 。
(4) 离子中P的杂化类型为
离子中P的杂化类型为___________ , 分子的空间构型均为
分子的空间构型均为___________ ,其键角依次减小的原因是___________ 。
(5)氮和铜形成的一种二元化合物具有良好的电学和光学性能,其晶胞结构如图所示,则N的配位数为___________ ,该晶体密度为___________  (列出计算式,
(列出计算式, 代表阿伏加德罗常数的值)。
代表阿伏加德罗常数的值)。
 )、锑(
)、锑(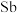 )、铋(
)、铋( )和镆(
)和镆(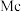 )六种,它们的单质及其化合物在工农业生产中有着重要的用途。回答下列问题:
)六种,它们的单质及其化合物在工农业生产中有着重要的用途。回答下列问题:(1)
 基态原子核外电子排布式为
基态原子核外电子排布式为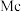 基态原子核外有
基态原子核外有(2)
 与同周期元素
与同周期元素 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为(3)氮气分子内存在氮氮三键,性质稳定,试从分子结构的角度解释P、
 的单质化学性质比
的单质化学性质比 活泼的原因是
活泼的原因是(4)
 离子中P的杂化类型为
离子中P的杂化类型为 分子的空间构型均为
分子的空间构型均为(5)氮和铜形成的一种二元化合物具有良好的电学和光学性能,其晶胞结构如图所示,则N的配位数为
 (列出计算式,
(列出计算式, 代表阿伏加德罗常数的值)。
代表阿伏加德罗常数的值)。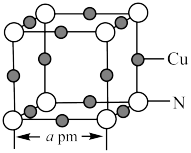
您最近一年使用:0次
2024-04-19更新
|
140次组卷
|
2卷引用:2024届青海省西宁市大通县高三下学期第二次模拟考试理科综合试题-高中化学
8 . 中国科学家合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料: ,并获得该化合物的LED器件,为白光的应用提供新材料支持。
,并获得该化合物的LED器件,为白光的应用提供新材料支持。
(1)已知 与
与 同族,基态
同族,基态 原子价层电子的运动状态有
原子价层电子的运动状态有__________ 种,基态O原子的电子排布式不能表示为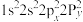 ,因为这违背了
,因为这违背了__________ (填选项)。
A.能量最低原理 B.泡利不相容原理 C.洪特规则
(2) 、P与S是同周期中相邻的元素,
、P与S是同周期中相邻的元素, 、P、S的电负性由大到小的顺序是
、P、S的电负性由大到小的顺序是__________ ,第一电离能由大到小的顺序是__________ .
(3)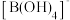 中硼原子的杂化轨道类型为
中硼原子的杂化轨道类型为__________ 。 中,
中, 与0之间不存在的化学键是
与0之间不存在的化学键是__________ (填选项)。
A. 键 B.
键 B. 键 C.配位键 D.极性键
键 C.配位键 D.极性键
(4)碳酸钡、碳酸镁分解得到的金属氧化物中,熔点较低的是__________ ,其原因是_______________ 。
(5)超高热导率半导体材料砷化硼(BAs)的晶胞结构如图所示,则1号砷原子的原子坐标为__________ 。已知阿伏加德罗常数的值为 ,若晶胞中
,若晶胞中 原子到B原子最近距离为
原子到B原子最近距离为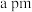 ,则该晶体的密度为
,则该晶体的密度为__________ (列出含a、 的计算式即可)。
的计算式即可)。
 ,并获得该化合物的LED器件,为白光的应用提供新材料支持。
,并获得该化合物的LED器件,为白光的应用提供新材料支持。(1)已知
 与
与 同族,基态
同族,基态 原子价层电子的运动状态有
原子价层电子的运动状态有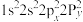 ,因为这违背了
,因为这违背了A.能量最低原理 B.泡利不相容原理 C.洪特规则
(2)
 、P与S是同周期中相邻的元素,
、P与S是同周期中相邻的元素, 、P、S的电负性由大到小的顺序是
、P、S的电负性由大到小的顺序是(3)
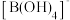 中硼原子的杂化轨道类型为
中硼原子的杂化轨道类型为 中,
中, 与0之间不存在的化学键是
与0之间不存在的化学键是A.
 键 B.
键 B. 键 C.配位键 D.极性键
键 C.配位键 D.极性键(4)碳酸钡、碳酸镁分解得到的金属氧化物中,熔点较低的是
(5)超高热导率半导体材料砷化硼(BAs)的晶胞结构如图所示,则1号砷原子的原子坐标为
 ,若晶胞中
,若晶胞中 原子到B原子最近距离为
原子到B原子最近距离为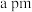 ,则该晶体的密度为
,则该晶体的密度为 的计算式即可)。
的计算式即可)。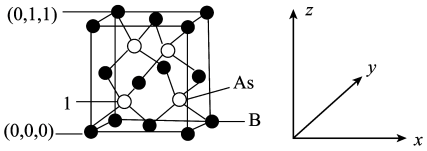
您最近一年使用:0次
名校
解题方法
9 . 四氟化硅、二氟甲烷(CH2F2)等含氟化合物在生产、生活中有重要的应用。回答下列问题:
(1)基态氟原子核外电子的空间运动状态有___________ 种,核外电子的最高能级符号为___________ ,最高能级电子的电子云形状为___________ 。
(2)F与N可形成化合物N2F2,分子中各原子均满足8电子稳定结构。
①分子中氮原子的杂化方式为___________ 。
②N2F2结构式为___________ ,其分子中。σ键与π键的数目之比为___________ 。
(3)氢氟酸能腐蚀玻璃生成SiF4,SiF4中Si的杂化方式为___________ ,SiF4的空间构型为___________ 。
(4) CH2F2难溶于水,而三氟甲烷(CHF3)可溶于水,其可能的原因是___________ 。
(1)基态氟原子核外电子的空间运动状态有
(2)F与N可形成化合物N2F2,分子中各原子均满足8电子稳定结构。
①分子中氮原子的杂化方式为
②N2F2结构式为
(3)氢氟酸能腐蚀玻璃生成SiF4,SiF4中Si的杂化方式为
(4) CH2F2难溶于水,而三氟甲烷(CHF3)可溶于水,其可能的原因是
您最近一年使用:0次
2023-12-26更新
|
213次组卷
|
6卷引用:青海省海南州高级中学、共和县高级中学2023-2024学年高二上学期期中联考化学试题
10 . 单原子合金成功用于多种异相催化剂的设计,某研究所成功研制出了单原子Bi修饰的Cu催化剂(BiCu一SAA),该催化剂能够在电催化还原CO2的过程中生成C2+而不是生成C1产物。

回答下列问题:
(1)写出基态Cu原子的价电子排布式:_________ 。铜元素的焰色试验呈绿色,下列三种波长为橙、黄、绿色对应的辐射波长,则绿色对应的辐射波长为________ (填标号)。
A.577~492nm B.597~577nm C.622~597nm
(2)与C同周期的p区主族元素第一电离能由大到小的顺序为_______ 。
(3)C2H4、CH3CH2OH中碳原子杂化方式有_______ ,催化还原CO2的过程中可能产生CO ,该离子的空间结构为
,该离子的空间结构为________ 。
(4)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1mol该配合物中含有的π键数目为________ (NA表示阿伏加德罗常数的值)。
(5)晶体铜的晶胞结构如图甲所示,原子之间相对位置关系的平面图如图乙所示,铜原子的配位数为________ ,铜原子的半径为apm,NA表示阿伏加德罗常数的值,晶体铜的密度为_________ (列出计算式即可)g•cm-3。


回答下列问题:
(1)写出基态Cu原子的价电子排布式:
A.577~492nm B.597~577nm C.622~597nm
(2)与C同周期的p区主族元素第一电离能由大到小的顺序为
(3)C2H4、CH3CH2OH中碳原子杂化方式有
 ,该离子的空间结构为
,该离子的空间结构为(4)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1mol该配合物中含有的π键数目为
(5)晶体铜的晶胞结构如图甲所示,原子之间相对位置关系的平面图如图乙所示,铜原子的配位数为

您最近一年使用:0次



