名校
解题方法
1 . X、Y、Z、R、W为前四周期元素,且原子序数依次增大。YZ2是红棕色气体,X、Y形成YX3,基态R原子M层与K层电子数相等,W2+的3d轨道中有9个电子,上述元素中仅有Y、Z位于同一周期。回答下列问题;
(1)基态R原子的价层轨道表示式为___________ ,
(2) 的空间结构为
的空间结构为___________ ,其中心原子的杂化方式为___________ 。
(3)稳定性:Y2___________ (填“>”、“<”或“=”)Z2,原因为___________ 。
(4)仅由X、Y两种元素可形成18电子的分子,该分子为___________ (填化学式)。
(5)仅由X、Y、Z三种元素可形成一种离子化合物,该化合物所含共价键的类型有___________ 。
(6)将W单质的粉末加入YX3的浓溶液,通入Z2,充分反应后溶液呈深蓝色,该反应的离子方程式为___________ ,从结构的角度,解释该反应可以发生的原因:___________ 。
(1)基态R原子的价层轨道表示式为
(2)
 的空间结构为
的空间结构为(3)稳定性:Y2
(4)仅由X、Y两种元素可形成18电子的分子,该分子为
(5)仅由X、Y、Z三种元素可形成一种离子化合物,该化合物所含共价键的类型有
(6)将W单质的粉末加入YX3的浓溶液,通入Z2,充分反应后溶液呈深蓝色,该反应的离子方程式为
您最近一年使用:0次
2 . 半导体在集成电路、消费电子,通信系统、光伏发电、照明,大功率电源转换等领域都有应用。
(1)硅是常见的半导体材料。金刚石和硅相比较,熔点更高的是___________ ,原因是___________ 。硅有晶体硅和无定形硅,可以用___________ (填方法名称)来区分晶体硅和无定形硅。
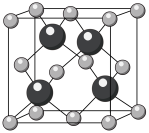
(2)2022年,科研人员发现立方砷化硼是科学界已知的最好的半导体之一,其结构如图所示。基态As原子的简化电子排布式为___________ ;立方砷化硼中,___________ (填“含有”或“不含有”)配位键。
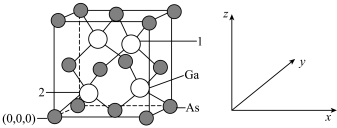
(4)砷化镓被誉为“半导体贵族”,是雷达、电子计算机、人造卫星、宇宙飞船等高新产品中不可或缺的材料。已知GaAs晶胞结构如图所示,其晶胞参数为apm。1号原子的分数坐标为___________ ;1号原子和2号原子之间的距离为___________ pm;晶胞密度为___________ g·cm-3(阿伏加德罗常数的值用NA表示)。
(1)硅是常见的半导体材料。金刚石和硅相比较,熔点更高的是
(2)2022年,科研人员发现立方砷化硼是科学界已知的最好的半导体之一,其结构如图所示。基态As原子的简化电子排布式为
| A.石墨为混合型晶体 |
| B.甲分子中的氮原子的杂化方式均为sp2 |
| C.乙分子图示结构部分中,1个Cu2+形成了2个配位键 |
| D.丙分子中存在氢键 |
(4)砷化镓被誉为“半导体贵族”,是雷达、电子计算机、人造卫星、宇宙飞船等高新产品中不可或缺的材料。已知GaAs晶胞结构如图所示,其晶胞参数为apm。1号原子的分数坐标为
您最近一年使用:0次
3 . 镍(Ni)是一种制造合金和催化剂的重要金属。如:镍钴合金是一种永磁材料;镍还可作反应CH3CHO+H2 CH3CH2OH的催化剂。
CH3CH2OH的催化剂。
(1)基态Ni原子中,核外电子占据最高能层符号是___________ ,未成对电子数为___________ 。
(2)1molCH3CHO中含有的σ键的数目为___________ ,碳原子的杂化类型为___________ 。
(3)乙醛的沸点___________ (填“高于”或“低于”)乙醇的沸点,原因为___________ 。
(4)某含镍配合物(NH4)2[Ni(OCN)4],其配离子中σ键与π键的个数比为___________ ,OCN-中元素N、O、C的第一电离能由大到小为___________ , 的空间构型为
的空间构型为___________ 。
(5)金属镍的原子堆积方式为面心立方堆积(如图所示),已知:已知镍的相对原子质量为59,阿伏加德罗常数为NA,金属镍的密度为ρg/cm3,则金属镍晶体中距离最近的镍原子间的距离为___________ pm(填表达式)。
 CH3CH2OH的催化剂。
CH3CH2OH的催化剂。(1)基态Ni原子中,核外电子占据最高能层符号是
(2)1molCH3CHO中含有的σ键的数目为
(3)乙醛的沸点
(4)某含镍配合物(NH4)2[Ni(OCN)4],其配离子中σ键与π键的个数比为
 的空间构型为
的空间构型为(5)金属镍的原子堆积方式为面心立方堆积(如图所示),已知:已知镍的相对原子质量为59,阿伏加德罗常数为NA,金属镍的密度为ρg/cm3,则金属镍晶体中距离最近的镍原子间的距离为

您最近一年使用:0次
名校
4 . 请回答下列问题:
(1)非金属氟化物在生产、生活和科研中应用广泛。OF2分子的空间结构为___________ ;OF2的熔、沸点___________ (填“高于”或“低于”)Cl2O,原因是___________ 。
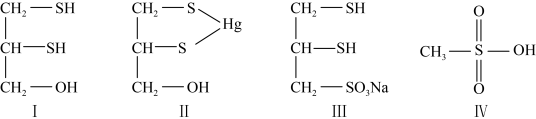
(2)很多含巯基(—SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物II。___________ 。
②化合物III也是一种汞解毒剂。化合物IV是一种强酸。下列说法正确的有___________ 。
A.在I中S原子采取sp3杂化
B.在II中S元素的电负性最大
C.在III中C—C—C键角是180°
D.在III中存在离子键与共价键
E.在IV中硫氧键的键能均相等
(3)硅和卤素单质反应可以得到SiX4.SiX4的熔、沸点如下表:
①0℃时,SiF4、SiCl4、SiBr4、SiI4呈液态的是___________ (填化学式),气态SiX4分子的空间结构是___________ 。___________ ,H、C、N的电负性由大到小的顺序为___________ ,1个M2+中含有___________ 个σ键。
(1)非金属氟化物在生产、生活和科研中应用广泛。OF2分子的空间结构为
(2)很多含巯基(—SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物II。
②化合物III也是一种汞解毒剂。化合物IV是一种强酸。下列说法正确的有
A.在I中S原子采取sp3杂化
B.在II中S元素的电负性最大
C.在III中C—C—C键角是180°
D.在III中存在离子键与共价键
E.在IV中硫氧键的键能均相等
(3)硅和卤素单质反应可以得到SiX4.SiX4的熔、沸点如下表:
| SiF4 | SiCl4 | SiBr4 | SiI4 | |
| 熔点/K | 183.0 | 203.2 | 278.6 | 393.7 |
| 沸点/K | 187.2 | 330.8 | 427.2 | 560.7 |
②SiCl4与N甲基咪唑(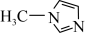 )反应可以得到M2+,其结构如图所示:
)反应可以得到M2+,其结构如图所示:
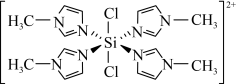
您最近一年使用:0次
解题方法
5 . 硼是一种用途广泛的工业原料,除了用于生产硼砂、硼酸和硼的各种化合物外,在制备储氢材料方面也有重要的用途,试回答下列问题:
(1)Ti(BH4)3是一种储氢材料,由TiCl4和LiBH4反应制得。基态Ti原子的核外电子排布式为___________ , 的价层电子对数是
的价层电子对数是___________ 。
(2)过渡金属Q与镧形成的合金是一种储氢材料,其中基态Q原子的价电子排布式为nd2n+2(n+1)sn-1,则Q元素的名称为___________ ;基态Q原子核外成对电子数和未成对电子数之比为___________ 。
(3)氨硼烷(NH3BH3)含氢量高,热稳定性好,是一种具有潜力的固体储氢材料,在四氢呋喃(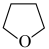 )作溶剂的条件下可合成氨硼烷:
)作溶剂的条件下可合成氨硼烷: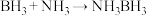 。
。
①测定晶体结构最常用的方法为___________ 。
②常温下,四氢呋喃在水中的溶解度大于环戊烷,其原因可能是___________ 。_
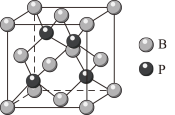
③硼与磷形成的一种晶体结构如图,晶体中离B原子最近的P原子有___________ 个;每个晶胞中的原子总数为___________ 。
(1)Ti(BH4)3是一种储氢材料,由TiCl4和LiBH4反应制得。基态Ti原子的核外电子排布式为
 的价层电子对数是
的价层电子对数是(2)过渡金属Q与镧形成的合金是一种储氢材料,其中基态Q原子的价电子排布式为nd2n+2(n+1)sn-1,则Q元素的名称为
(3)氨硼烷(NH3BH3)含氢量高,热稳定性好,是一种具有潜力的固体储氢材料,在四氢呋喃(
 )作溶剂的条件下可合成氨硼烷:
)作溶剂的条件下可合成氨硼烷: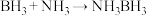 。
。①测定晶体结构最常用的方法为
②常温下,四氢呋喃在水中的溶解度大于环戊烷,其原因可能是
③硼与磷形成的一种晶体结构如图,晶体中离B原子最近的P原子有

您最近一年使用:0次
名校
解题方法
6 . A、B、C、D、E是原子序数依次增大的短周期主族元素,B、C同周期,C的电负性数值最大,A、D同主族,E元素原子最外层的p能级电子数是s能级电子数的一半。A、B能形成一种液态高能燃料,其分子中含有18个电子。根据以上信息回答下列问题:
(1)A、B形成的液态高能燃料分子的电子式是____ ;其中B原子的杂化方式为____ 。
(2)基态D原子的核外电子排布式为[Ne]______ 。
(3)C、D、E的离子半径由大到小的顺序为_______ (填离子符号)。
(4)E的单质与D的最高价氧化物对应的水化物发生反应的化学方程式是______ ;该反应涉及的物质中不存在的晶体类型是_______ (填序号)。
①金属晶体 ②离子晶体 ③共价晶体 ④分子晶体
(5)C、D、E可组成离子化合物,其晶胞结构如图所示,每个晶胞中阳离子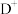 有
有_____ 个,阴离子 有
有______ 个。该化合物的化学式是____ 。
(1)A、B形成的液态高能燃料分子的电子式是
(2)基态D原子的核外电子排布式为[Ne]
(3)C、D、E的离子半径由大到小的顺序为
(4)E的单质与D的最高价氧化物对应的水化物发生反应的化学方程式是
①金属晶体 ②离子晶体 ③共价晶体 ④分子晶体
(5)C、D、E可组成离子化合物,其晶胞结构如图所示,每个晶胞中阳离子
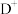 有
有 有
有
您最近一年使用:0次
解题方法
7 . 金属铁、铜、锌及其化合物在人类生产生活中起着重要作用.结合信息回答下列问题:
Ⅰ.在 催化作用下可利用
催化作用下可利用 制备甲酸
制备甲酸
(1)基态 原子的外围电子排布式为
原子的外围电子排布式为____________________________________ ;
(2) 分子中碳原子的杂化轨道类型为
分子中碳原子的杂化轨道类型为____________ ,分子中σ键和π键数目之比为____________ ;
(3)键角比较:
____________ (填“>”“<”或“=”) ;
;
(4)一种 的立方晶胞如图所示.
的立方晶胞如图所示.

① 周围距离最近且等距的
周围距离最近且等距的 数目为
数目为____________ .
②设晶胞边长为 ,
, 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为____________  .
.
Ⅱ.工业中可利用生产钛白的副产物 和硫铁矿
和硫铁矿 联合制备铁精粉
联合制备铁精粉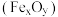 和硫酸,实现能源及资源的有效利用,
和硫酸,实现能源及资源的有效利用, 的结构示意图如图.
的结构示意图如图.

(5) 晶体中
晶体中 与
与 的作用力类型是
的作用力类型是____________ , 的空间构型为
的空间构型为____________ .
Ⅰ.在
 催化作用下可利用
催化作用下可利用 制备甲酸
制备甲酸(1)基态
 原子的外围电子排布式为
原子的外围电子排布式为(2)
 分子中碳原子的杂化轨道类型为
分子中碳原子的杂化轨道类型为(3)键角比较:

 ;
;(4)一种
 的立方晶胞如图所示.
的立方晶胞如图所示.
①
 周围距离最近且等距的
周围距离最近且等距的 数目为
数目为②设晶胞边长为
 ,
, 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为 .
.Ⅱ.工业中可利用生产钛白的副产物
 和硫铁矿
和硫铁矿 联合制备铁精粉
联合制备铁精粉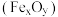 和硫酸,实现能源及资源的有效利用,
和硫酸,实现能源及资源的有效利用, 的结构示意图如图.
的结构示意图如图.
(5)
 晶体中
晶体中 与
与 的作用力类型是
的作用力类型是 的空间构型为
的空间构型为
您最近一年使用:0次
名校
解题方法
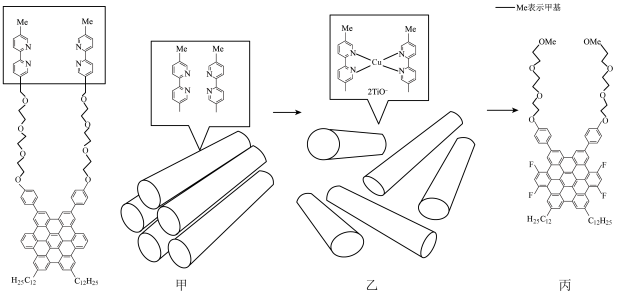
8 . 将酞菁—钴钛菁—三氯化铝复合嵌接在碳纳米管上,制得一种高效催化还原二氧化碳的催化剂。回答下列问题:
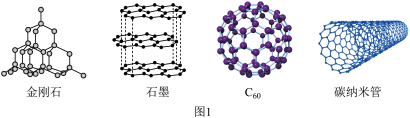
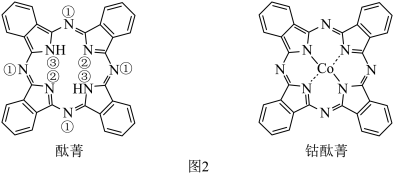
(1)如图1所示的几种碳单质,它们互为___________ ,其中属于原子晶体的是___________ ,C60间的作用力是___________ 。___________ (填图2酞菁中N原子的标号)。钴酞菁分子中,钴离子的化合价为___________ ,氮原子提供孤对电子与钴离子形成___________ 键。___________ 。
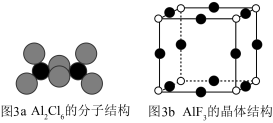
②AlF3的熔点为1090℃,远高于AlCl3的192℃,原因为___________ 。
③AlF3结构属立方晶系,晶胞如图3b所示,F-的配位数为___________ 。若晶胞参数为apm,晶体密度ρ=___________ g/cm3(列出计算式,阿伏加德罗常数的值为NA)。___________ ;钛原子和镍原子的半径分别为r1和r2,该晶体的空间利用率为___________ (用含r的代数式表示,不必化简﹐空间利用率= ×100%)。
×100%)。
(1)如图1所示的几种碳单质,它们互为
②AlF3的熔点为1090℃,远高于AlCl3的192℃,原因为
③AlF3结构属立方晶系,晶胞如图3b所示,F-的配位数为
 ×100%)。
×100%)。
您最近一年使用:0次
2024-02-26更新
|
409次组卷
|
2卷引用:河北省石家庄市第十七中学2023-2024高二上学期期末考试化学试题
名校
9 . 2023年8月1日起,我国对镓(Ga)等相关物项实施出口管制。Ga与B、A1位于同一主族。回答下列问题:
(1)写出基态Ga原子的价电子排布图:_______ 。
(2)硼的氢化物叫硼烷 ,如
,如 (乙硼烷-6)、
(乙硼烷-6)、 (丁硼烷-10)等。
(丁硼烷-10)等。
①下列说法错误的是_______ 。
A.B原子由 需吸收能量
需吸收能量
B. 的结构式:
的结构式:
C.同周期相邻元素的电负性大小:
D. 与
与 反应生成
反应生成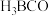 ,
,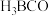 分子中
分子中 键与
键与 键数目之比为
键数目之比为
② 极易发生水解生成
极易发生水解生成 和
和 ,请写出反应的化学方程式:
,请写出反应的化学方程式:_______ 。
(3)氮和硼形成的化合物 ,通常存在石墨型与金刚石型两种结构,可发生转化:
,通常存在石墨型与金刚石型两种结构,可发生转化: (石墨型)
(石墨型) (金刚石型)。石墨型与金刚石型两类化合物中B原子的杂化方式依次为
(金刚石型)。石墨型与金刚石型两类化合物中B原子的杂化方式依次为_______ ;金刚石型的 的硬度大于金刚石,原因是
的硬度大于金刚石,原因是_______ 。
(4)近年来,人们发现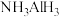 可与多种小分子氢化物形成双氢键。双氢键是指带正电的H原子与带负电的H原子之间的一种弱电性相互作用,其结构可用如图表示。
可与多种小分子氢化物形成双氢键。双氢键是指带正电的H原子与带负电的H原子之间的一种弱电性相互作用,其结构可用如图表示。
根据上述信息,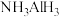 与
与 形成的双氢键可表示为
形成的双氢键可表示为_______ 。
(5)广义酸碱理论认为,中心原子可以接受电子对的分子为酸,可以提供电子对的分子为碱。按照该理论, 属于
属于_______ (填“酸”或“碱”)。下列物质均能与 发生配位反应,其中形成
发生配位反应,其中形成 键最强的是
键最强的是_______ (填字母)。
A.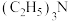 B.
B. C.
C.
(6)太阳能材料 晶体为四方晶系,其晶胞参数及结构如图所示,晶胞棱边夹角均为90°。已知:A处In原子坐标为
晶体为四方晶系,其晶胞参数及结构如图所示,晶胞棱边夹角均为90°。已知:A处In原子坐标为 ,B处Cu原子坐标为
,B处Cu原子坐标为 。
。

设阿伏加德罗常数的值为 ,则该晶体密度为
,则该晶体密度为_______  。
。
(1)写出基态Ga原子的价电子排布图:
(2)硼的氢化物叫硼烷
 ,如
,如 (乙硼烷-6)、
(乙硼烷-6)、 (丁硼烷-10)等。
(丁硼烷-10)等。①下列说法错误的是
A.B原子由
 需吸收能量
需吸收能量B.
 的结构式:
的结构式:
C.同周期相邻元素的电负性大小:

D.
 与
与 反应生成
反应生成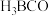 ,
,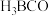 分子中
分子中 键与
键与 键数目之比为
键数目之比为
②
 极易发生水解生成
极易发生水解生成 和
和 ,请写出反应的化学方程式:
,请写出反应的化学方程式:(3)氮和硼形成的化合物
 ,通常存在石墨型与金刚石型两种结构,可发生转化:
,通常存在石墨型与金刚石型两种结构,可发生转化: (石墨型)
(石墨型) (金刚石型)。石墨型与金刚石型两类化合物中B原子的杂化方式依次为
(金刚石型)。石墨型与金刚石型两类化合物中B原子的杂化方式依次为 的硬度大于金刚石,原因是
的硬度大于金刚石,原因是(4)近年来,人们发现
 可与多种小分子氢化物形成双氢键。双氢键是指带正电的H原子与带负电的H原子之间的一种弱电性相互作用,其结构可用如图表示。
可与多种小分子氢化物形成双氢键。双氢键是指带正电的H原子与带负电的H原子之间的一种弱电性相互作用,其结构可用如图表示。 (“—”表示共价键,“…”表示形成的双氢键) (“—”表示共价键,“…”表示形成的双氢键) |
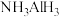 与
与 形成的双氢键可表示为
形成的双氢键可表示为(5)广义酸碱理论认为,中心原子可以接受电子对的分子为酸,可以提供电子对的分子为碱。按照该理论,
 属于
属于 发生配位反应,其中形成
发生配位反应,其中形成 键最强的是
键最强的是A.
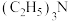 B.
B. C.
C.
(6)太阳能材料
 晶体为四方晶系,其晶胞参数及结构如图所示,晶胞棱边夹角均为90°。已知:A处In原子坐标为
晶体为四方晶系,其晶胞参数及结构如图所示,晶胞棱边夹角均为90°。已知:A处In原子坐标为 ,B处Cu原子坐标为
,B处Cu原子坐标为 。
。
设阿伏加德罗常数的值为
 ,则该晶体密度为
,则该晶体密度为 。
。
您最近一年使用:0次
名校
解题方法
10 . 2021年5月中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量橄榄石矿物 。回答下列问题:
。回答下列问题:
(1)基态 原子的价电子排布式为
原子的价电子排布式为___________ , 元素电负性由大到小顺序为
元素电负性由大到小顺序为___________ 。橄榄石中,铁的化合价为___________ 。
(2)已知 的熔点数据如下表:
的熔点数据如下表:
 与
与 均为第三周期元素,
均为第三周期元素, 熔点明显高于
熔点明显高于 ,原因是
,原因是___________ 。已知同族元素的氯化物 晶体类型相同,推测三者熔点由小到大的顺序是
晶体类型相同,推测三者熔点由小到大的顺序是___________ 。SiCl4的空间结构为___________ ,其中Si的轨道杂化形式为___________ 。
(3)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿 轴的投影图如图所示,该物质化学式为
轴的投影图如图所示,该物质化学式为___________ 。已知在投影图中, 位于三个
位于三个 形成的正三角形的中心,则
形成的正三角形的中心,则 最近距离为
最近距离为___________ 。
 。回答下列问题:
。回答下列问题:(1)基态
 原子的价电子排布式为
原子的价电子排布式为 元素电负性由大到小顺序为
元素电负性由大到小顺序为(2)已知
 的熔点数据如下表:
的熔点数据如下表:| 物质 |  |  |
熔点 | 800.7 |  |
 与
与 均为第三周期元素,
均为第三周期元素, 熔点明显高于
熔点明显高于 ,原因是
,原因是 晶体类型相同,推测三者熔点由小到大的顺序是
晶体类型相同,推测三者熔点由小到大的顺序是(3)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿
 轴的投影图如图所示,该物质化学式为
轴的投影图如图所示,该物质化学式为 位于三个
位于三个 形成的正三角形的中心,则
形成的正三角形的中心,则 最近距离为
最近距离为
您最近一年使用:0次
2024-02-19更新
|
223次组卷
|
4卷引用:河北正定中学本部2023-2024学年高二上学期期末考试化学试题



