1 . 锰及其化合物在化学实验室和化工生产应用非常广泛,回答下列问题:
(1)乙酰丙酮锰(III)是一种广泛用于苯酚类化合物氧化偶联的试剂,Me表示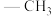 ,中心离子为
,中心离子为 离子,其结构如图所示。
离子,其结构如图所示。_______ ,该物质中不同杂化方式的碳原子数之比为_______ ,中心离子 填充在
填充在_______ 空隙中(填“四面体”或“八面体”)。
(2)从原子结构角度分析,基态原子中,Mn的第三电离能大于Fe的第三电离能的原因是_______ 。
(3) 能形成如图所示大π键,而羧基酸性随大π键电子云密度的增大而减弱,则
能形成如图所示大π键,而羧基酸性随大π键电子云密度的增大而减弱,则 、
、 、
、 酸性从强到弱顺序是
酸性从强到弱顺序是_______ 。 的顺式结构为
的顺式结构为_______ 分子(填“极性”、“非极性”)。 围成的八面体空隙中,形成无限螺旋链的络离子,同一条链内原子作用很强,其形成晶胞结构沿对角线的投影如图a所示,晶胞俯视图如图b所示,晶胞参数为
围成的八面体空隙中,形成无限螺旋链的络离子,同一条链内原子作用很强,其形成晶胞结构沿对角线的投影如图a所示,晶胞俯视图如图b所示,晶胞参数为 、
、 和
和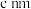 ,则该晶胞所带电荷为
,则该晶胞所带电荷为_______ 。阿伏加德罗常数的值为 ,该晶体的密度为
,该晶体的密度为_______  (用含
(用含 、a、c的式子表示)。
、a、c的式子表示)。
(1)乙酰丙酮锰(III)是一种广泛用于苯酚类化合物氧化偶联的试剂,Me表示
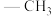 ,中心离子为
,中心离子为 离子,其结构如图所示。
离子,其结构如图所示。
 填充在
填充在(2)从原子结构角度分析,基态原子中,Mn的第三电离能大于Fe的第三电离能的原因是
(3)
 能形成如图所示大π键,而羧基酸性随大π键电子云密度的增大而减弱,则
能形成如图所示大π键,而羧基酸性随大π键电子云密度的增大而减弱,则 、
、 、
、 酸性从强到弱顺序是
酸性从强到弱顺序是 的顺式结构为
的顺式结构为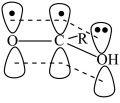
 围成的八面体空隙中,形成无限螺旋链的络离子,同一条链内原子作用很强,其形成晶胞结构沿对角线的投影如图a所示,晶胞俯视图如图b所示,晶胞参数为
围成的八面体空隙中,形成无限螺旋链的络离子,同一条链内原子作用很强,其形成晶胞结构沿对角线的投影如图a所示,晶胞俯视图如图b所示,晶胞参数为 、
、 和
和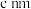 ,则该晶胞所带电荷为
,则该晶胞所带电荷为 ,该晶体的密度为
,该晶体的密度为 (用含
(用含 、a、c的式子表示)。
、a、c的式子表示)。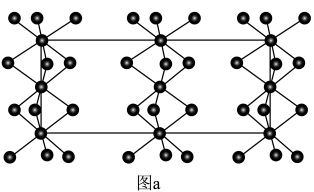

您最近一年使用:0次
解题方法
2 . 硼烷-四氢呋喃(BH3·THF,结构简式为)是一种硼氢化和还原性的试剂,易溶于四氢呋喃(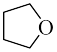 )、蚂水剧烈反应放出氢气 工业上常用于有机物中某些官能团的硼氢化和还原化。请回答下列问题:
)、蚂水剧烈反应放出氢气 工业上常用于有机物中某些官能团的硼氢化和还原化。请回答下列问题:
A.1s22s22p1 B.1s22s2 C.1s22s12p1 D.1s22p2
(2)先将NaBH4和BF3溶于二乙二醇二甲醚(CH3OCH2CH2OCH2CH2OCH3)中,充分溶解,再加入四氢呋喃,反应30 min、缘分离提纯即得较纯净的 BH3·THF,同时还有另一种产物 NaF。
①制备BH3·THF的化学方程式为
②制备过程中,BF3中B的杂化方式的变化是
③二乙二醇二甲醚在水中的溶解度大于在苯中的溶解度,其原因是
(3)硼氢化钠在室温下是α型的立方晶体(如图甲所示),6.3GPa下转变为四方晶体(如图乙所示)。

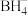 最近的
最近的 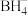 有
有 围成
围成②硼氢化钠的四方晶体中,晶胞中 A、B间距离d=
您最近一年使用:0次
名校
解题方法
3 . 一种比率光声探针M与 配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:
配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:_______ ,基态 的价电子中,两种自旋状态的电子数之比为
的价电子中,两种自旋状态的电子数之比为_______ 。
(2)均为平面结构的吡咯( )和吡啶(
)和吡啶( )是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较小的为
)是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较小的为_______ ,原因是_______ 。
(3) 是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为
是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为 。
。 中
中 键角
键角_______  中
中 键角(填“大于”“小于”或“等于”)。
键角(填“大于”“小于”或“等于”)。
(4) (
( )中
)中 比
比 中的更
中的更_______ (填“难”或“易”)断裂。其原因是_______ 。
元素周期表中,第四周期元素单质及其化合物在化工生产和研究中有重要的应用。
(5)在浓 的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6,组成为
的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6,组成为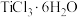 的晶体,该晶体中两种配体的物质的量之比为
的晶体,该晶体中两种配体的物质的量之比为 ,则由该配合离子组成的晶体化学式还可以写为
,则由该配合离子组成的晶体化学式还可以写为_______ 。
(6)硒氧化铋是一类全新二维半导体芯片材料,为四方晶系晶胞结构(如图所示),可以看成带正电的 层与带负电的
层与带负电的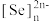 层交替堆叠。据此推断硒氧化铋的化学式为
层交替堆叠。据此推断硒氧化铋的化学式为_______ 。晶胞棱边夹角均为 ,则晶体密度的计算式为
,则晶体密度的计算式为_______  (
( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:
配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:
 的价电子中,两种自旋状态的电子数之比为
的价电子中,两种自旋状态的电子数之比为(2)均为平面结构的吡咯(
 )和吡啶(
)和吡啶( )是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较小的为
)是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较小的为(3)
 是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为
是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为 。
。 中
中 键角
键角 中
中 键角(填“大于”“小于”或“等于”)。
键角(填“大于”“小于”或“等于”)。(4)
 (
( )中
)中 比
比 中的更
中的更元素周期表中,第四周期元素单质及其化合物在化工生产和研究中有重要的应用。
(5)在浓
 的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6,组成为
的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6,组成为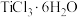 的晶体,该晶体中两种配体的物质的量之比为
的晶体,该晶体中两种配体的物质的量之比为 ,则由该配合离子组成的晶体化学式还可以写为
,则由该配合离子组成的晶体化学式还可以写为(6)硒氧化铋是一类全新二维半导体芯片材料,为四方晶系晶胞结构(如图所示),可以看成带正电的
 层与带负电的
层与带负电的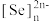 层交替堆叠。据此推断硒氧化铋的化学式为
层交替堆叠。据此推断硒氧化铋的化学式为 ,则晶体密度的计算式为
,则晶体密度的计算式为 (
( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
名校
解题方法
4 . 回答下列问题。
(1)青蒿素是我国科学家从传统中药中发现的能治疗疟疾的有机化合物,其分子结构如图所示,它可以用溶剂A从中药中提取出来,得到“提取液”后,再经“一系列操作”即可分离出青蒿素,结构如下图所示。下列有关说法正确的有___________
②青蒿素的分子式为C14H20O5
③青蒿素分子中具有的官能团有酮羰基和醚键
④用溶剂A从中药中提取出青蒿素的实验操作是萃取
⑤青蒿素分子中含有7个手性碳原子
(2)化合物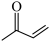 有多种同分异构体,写出满足以下条件的同分异构体结构简式
有多种同分异构体,写出满足以下条件的同分异构体结构简式 ___________ ;写出其与银氨溶液反应的方程式___________ 。
①能与银氨溶液发生反应;②核磁共振氢谱中共含有三组吸收峰。
(3)甘氨酸铜有顺式和反式两种同分异构,结构如图___________ (填序号)
a.sp b.sp2 c.sp3 d.dsp2
②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜不能溶于水,原因可能是___________ 。
(4)C、H、O、N是生命元素。下列说法正确的是___________。
(1)青蒿素是我国科学家从传统中药中发现的能治疗疟疾的有机化合物,其分子结构如图所示,它可以用溶剂A从中药中提取出来,得到“提取液”后,再经“一系列操作”即可分离出青蒿素,结构如下图所示。下列有关说法正确的有
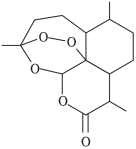
②青蒿素的分子式为C14H20O5
③青蒿素分子中具有的官能团有酮羰基和醚键
④用溶剂A从中药中提取出青蒿素的实验操作是萃取
⑤青蒿素分子中含有7个手性碳原子
(2)化合物
 有多种同分异构体,写出满足以下条件的同分异构体结构简式
有多种同分异构体,写出满足以下条件的同分异构体结构简式 ①能与银氨溶液发生反应;②核磁共振氢谱中共含有三组吸收峰。
(3)甘氨酸铜有顺式和反式两种同分异构,结构如图
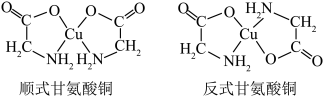
a.sp b.sp2 c.sp3 d.dsp2
②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜不能溶于水,原因可能是
(4)C、H、O、N是生命元素。下列说法正确的是___________。
| A.第一电离能:O>N>C>H |
| B.电负性:O>N>C>H |
C.酸性: |
D.键角: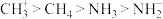 |
您最近一年使用:0次
解题方法
5 . 第二周期元素其单质及化合物具有一些特殊的化学性质。回答下列问题。
(1)Li、Be、B三种元素第二电离能由大到小的顺序为_______ 。
(2)由于硼的氢化物与烷烃相似,故又称之为硼烷。乙硼烷( )的分子结构如图,该分子中B原子的杂化方式为
)的分子结构如图,该分子中B原子的杂化方式为_______ 。甲中化学键①为“二中心二电子键”,记作“2c-2e”,则乙硼烷的桥键②记作_______ 。氢原子仅用1s轨道就可形成桥键的原因为_______ 。_______ 。乙中由12个B与12个C构成的多面体含_______ 个棱。 溶解度(S=22g)大于
溶解度(S=22g)大于 (S=9.6g),从结构角度解释原因
(S=9.6g),从结构角度解释原因_______ 。
(1)Li、Be、B三种元素第二电离能由大到小的顺序为
(2)由于硼的氢化物与烷烃相似,故又称之为硼烷。乙硼烷(
 )的分子结构如图,该分子中B原子的杂化方式为
)的分子结构如图,该分子中B原子的杂化方式为
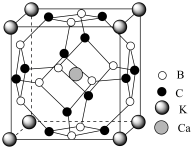
 溶解度(S=22g)大于
溶解度(S=22g)大于 (S=9.6g),从结构角度解释原因
(S=9.6g),从结构角度解释原因
您最近一年使用:0次
6 . 卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
(1)氟原子激发态的电子排布式有________ ,其中能量较高的是________ 。(填标号)
A. B.
B. C.
C.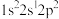 D.
D.
(2)基态Br原子的核外电子排布式为________ 。
(3) 中提供电子对形成配位键的原子是
中提供电子对形成配位键的原子是________ ,中心离子的配位数为________ 。
(4)Kr是第四周期的稀有气体元素,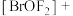 的中心原子Br的杂化轨道类型为
的中心原子Br的杂化轨道类型为________ 。
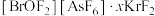 晶体中的微粒间作用力有
晶体中的微粒间作用力有________ (填标号)。
a.氢键 b.离子键 c.极性共价键 d.非极性共价键
(5)固态氟化氢中存在 形式,画出
形式,画出 的链状结构
的链状结构________ 。
(6)四氟乙烯 和聚四氟乙烯中C的杂化轨道类型分别为
和聚四氟乙烯中C的杂化轨道类型分别为________ 和________ ;聚四氟乙烯的化学稳定性高于聚乙烯,从化学键的角度解释原因________ 。
(1)氟原子激发态的电子排布式有
A.
 B.
B. C.
C.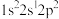 D.
D.
(2)基态Br原子的核外电子排布式为
(3)
 中提供电子对形成配位键的原子是
中提供电子对形成配位键的原子是(4)Kr是第四周期的稀有气体元素,
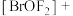 的中心原子Br的杂化轨道类型为
的中心原子Br的杂化轨道类型为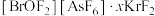 晶体中的微粒间作用力有
晶体中的微粒间作用力有a.氢键 b.离子键 c.极性共价键 d.非极性共价键
(5)固态氟化氢中存在
 形式,画出
形式,画出 的链状结构
的链状结构(6)四氟乙烯
 和聚四氟乙烯中C的杂化轨道类型分别为
和聚四氟乙烯中C的杂化轨道类型分别为
您最近一年使用:0次
解题方法
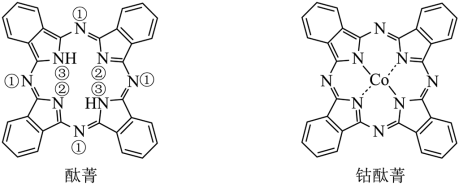
7 . 将酞菁—钴钛—三氯化铝复合嵌接在碳纳米管上,制得一种高效催化还原二氧化碳的催化剂。回答下列问题:
(1)下图中属于原子晶体的是___________ , 间的作用力是
间的作用力是___________ 。___________ (填图酞菁中N原子的标号)。钴酞菁分子中,钴离子的化合价为___________ ,氮原子提供孤对电子与钴离子形成___________ 键。
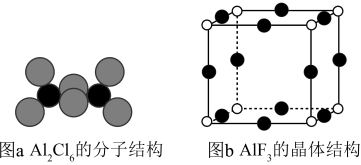
(3)气态 通常以二聚体
通常以二聚体 的形式存在,其空间结构如图a所示,二聚体中
的形式存在,其空间结构如图a所示,二聚体中 的轨道杂化类型为
的轨道杂化类型为___________ , 的熔点为
的熔点为 ,远高于
,远高于 的
的 ,由此可以判断铝氟之间的化学键为
,由此可以判断铝氟之间的化学键为___________ 键。 结构属立方晶系,晶胞如图b所示,
结构属立方晶系,晶胞如图b所示, 的配位数为
的配位数为___________ 。若晶胞参数为 ,晶体密度
,晶体密度
___________  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
(1)下图中属于原子晶体的是
 间的作用力是
间的作用力是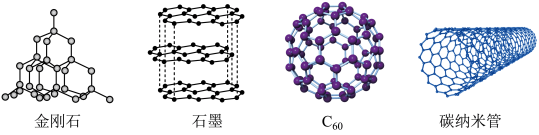
(3)气态
 通常以二聚体
通常以二聚体 的形式存在,其空间结构如图a所示,二聚体中
的形式存在,其空间结构如图a所示,二聚体中 的轨道杂化类型为
的轨道杂化类型为 的熔点为
的熔点为 ,远高于
,远高于 的
的 ,由此可以判断铝氟之间的化学键为
,由此可以判断铝氟之间的化学键为 结构属立方晶系,晶胞如图b所示,
结构属立方晶系,晶胞如图b所示, 的配位数为
的配位数为 ,晶体密度
,晶体密度
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
8 . 金属及其化合物广泛应用于生产、生活等多个领域。回答下列问题:
(1)基态 原子的价层电子的电子排布图为
原子的价层电子的电子排布图为_______ , 中三种元素的第一电离能由大到小的顺序是
中三种元素的第一电离能由大到小的顺序是_______ (填元素符号)。 是强还原剂,
是强还原剂, 中含有
中含有 键与
键与 键的数目之比为
键的数目之比为_______ 。
(2)独立的 分子中,
分子中, 键角为
键角为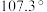 ,如图是
,如图是 离子的部分结构以及其中
离子的部分结构以及其中 键角。请解释
键角。请解释 离子中
离子中 键角变为
键角变为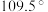 的原因是
的原因是_______ 。_______ (填序号)。
a.sp b.sp2 c.sp3 d.dsp2
②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜难溶于水,原因可能是_______ 。
(4) 晶体中,
晶体中, 的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O围成的正四面体空隙和如3、6、7、8、9、12的
的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O围成的正四面体空隙和如3、6、7、8、9、12的 围成的正八面体空隙。
围成的正八面体空隙。 中有一半的
中有一半的 填充在正四面体空隙中,另一半
填充在正四面体空隙中,另一半 和
和 填充在正八面体空隙中,则
填充在正八面体空隙中,则 晶体中有
晶体中有_______  的正八面体空隙填充阳离子。
的正八面体空隙填充阳离子。 晶胞的八分之一是图示结构单元,晶体密度为
晶胞的八分之一是图示结构单元,晶体密度为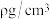 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶胞参数a=
,则该晶胞参数a=_______ pm。(写出表达式)
(1)基态
 原子的价层电子的电子排布图为
原子的价层电子的电子排布图为 中三种元素的第一电离能由大到小的顺序是
中三种元素的第一电离能由大到小的顺序是 是强还原剂,
是强还原剂, 中含有
中含有 键与
键与 键的数目之比为
键的数目之比为(2)独立的
 分子中,
分子中, 键角为
键角为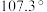 ,如图是
,如图是 离子的部分结构以及其中
离子的部分结构以及其中 键角。请解释
键角。请解释 离子中
离子中 键角变为
键角变为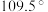 的原因是
的原因是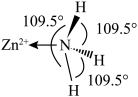

a.sp b.sp2 c.sp3 d.dsp2
②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜难溶于水,原因可能是
(4)
 晶体中,
晶体中, 的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O围成的正四面体空隙和如3、6、7、8、9、12的
的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O围成的正四面体空隙和如3、6、7、8、9、12的 围成的正八面体空隙。
围成的正八面体空隙。 中有一半的
中有一半的 填充在正四面体空隙中,另一半
填充在正四面体空隙中,另一半 和
和 填充在正八面体空隙中,则
填充在正八面体空隙中,则 晶体中有
晶体中有 的正八面体空隙填充阳离子。
的正八面体空隙填充阳离子。 晶胞的八分之一是图示结构单元,晶体密度为
晶胞的八分之一是图示结构单元,晶体密度为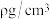 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶胞参数a=
,则该晶胞参数a=
您最近一年使用:0次
名校
9 . 氮、磷化合物在科研和生产中有许多重要用途。回答下列问题:
(1)氨硼烷(NH3BH3)是极具潜力的固体储氢材料,分子中与N原子相连的H呈正电性(H +),与B原子相连的H呈负电性(H
+),与B原子相连的H呈负电性(H -)。B原子的杂化方式为
-)。B原子的杂化方式为_________ ,H、B、N的电负性由大到小的顺序为____ 。与氨硼烷互为等电子体的分子是_______ (写名称),其熔点比NH3BH3低,原因是__________ 。
(2)南开大学某课题组成功合成[FeP6]2-。结构如图,环状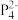 结构与苯相似,
结构与苯相似,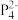 中的大π键可表示为
中的大π键可表示为___________ 。
___ 种,TiO2晶胞的密度为_________ g/cm3,TiO2-aNb 晶体中a:b=_________ 。
(1)氨硼烷(NH3BH3)是极具潜力的固体储氢材料,分子中与N原子相连的H呈正电性(H
 +),与B原子相连的H呈负电性(H
+),与B原子相连的H呈负电性(H -)。B原子的杂化方式为
-)。B原子的杂化方式为(2)南开大学某课题组成功合成[FeP6]2-。结构如图,环状
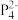 结构与苯相似,
结构与苯相似,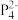 中的大π键可表示为
中的大π键可表示为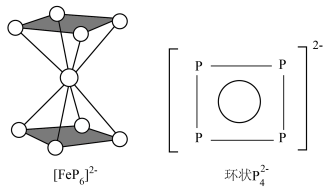
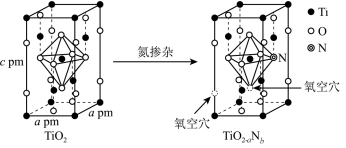
您最近一年使用:0次
解题方法
10 . 非金属氟化物在生产、生活和科研中应用广泛。回答下列问题:
(1)常温下 为无色气体,冷冻后成为淡黄色液体,
为无色气体,冷冻后成为淡黄色液体, 固体的晶体类型为
固体的晶体类型为___________ ;与 分子相比,
分子相比, 分子的键角更
分子的键角更___________ (填“大”或“小”),极性更___________ (填“强”或“弱”)。
(2)石墨与 在
在 反应,得到层状结构化合物
反应,得到层状结构化合物 ,其单层局部结构如图所示。与石墨相比,
,其单层局部结构如图所示。与石墨相比, 的导电性
的导电性___________ (填“增强”或“减弱”), 的
的 键的键长比石墨中
键的键长比石墨中 键的
键的___________ (填“长”或“短”)。 、
、 等离子,画出
等离子,画出 的结构式
的结构式___________ 。
(4) (第五周期稀有气体元素)与
(第五周期稀有气体元素)与 形成的
形成的 室温下易升华。
室温下易升华。 中心原子的价层电子对数为
中心原子的价层电子对数为___________ ,下列对 中心原子杂化方式推断合理的是
中心原子杂化方式推断合理的是___________ (填序号)。
A. B.
B. C.
C. D.
D.
(5) 晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为
晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为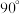 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如
。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如 点原子的分数坐标为
点原子的分数坐标为 ,已知
,已知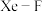 键的键长为
键的键长为 ,则
,则 点原子的分数坐标为
点原子的分数坐标为___________ ;晶胞中 、
、 间的距离
间的距离
___________  (用含
(用含 、
、 、
、 的计算式表示)。
的计算式表示)。
由晶胞结构可知B点分数坐标为: ;
;
(1)常温下
 为无色气体,冷冻后成为淡黄色液体,
为无色气体,冷冻后成为淡黄色液体, 固体的晶体类型为
固体的晶体类型为 分子相比,
分子相比, 分子的键角更
分子的键角更(2)石墨与
 在
在 反应,得到层状结构化合物
反应,得到层状结构化合物 ,其单层局部结构如图所示。与石墨相比,
,其单层局部结构如图所示。与石墨相比, 的导电性
的导电性 的
的 键的键长比石墨中
键的键长比石墨中 键的
键的
 、
、 等离子,画出
等离子,画出 的结构式
的结构式(4)
 (第五周期稀有气体元素)与
(第五周期稀有气体元素)与 形成的
形成的 室温下易升华。
室温下易升华。 中心原子的价层电子对数为
中心原子的价层电子对数为 中心原子杂化方式推断合理的是
中心原子杂化方式推断合理的是A.
 B.
B. C.
C. D.
D.
(5)
 晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为
晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为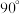 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如
。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如 点原子的分数坐标为
点原子的分数坐标为 ,已知
,已知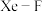 键的键长为
键的键长为 ,则
,则 点原子的分数坐标为
点原子的分数坐标为 、
、 间的距离
间的距离
 (用含
(用含 、
、 、
、 的计算式表示)。
的计算式表示)。由晶胞结构可知B点分数坐标为:
 ;
;
您最近一年使用:0次



