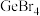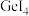名校
解题方法
1 . 卤素可形成许多结构和性质特殊的化合物。回答下列问题:
(1)下列说法正确的是___________。
(2)ClO2中心原子为Cl,Cl2O中心原子为O,二者均为V形结构,但ClO2中存在大π键(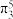 ),ClO2中Cl原子的轨道杂化方式
),ClO2中Cl原子的轨道杂化方式___________ ;O-Cl-O键角___________ Cl-O-Cl键角(填“>”“<”或“=”)。比较ClO2与Cl2O中Cl-O键的键长并说明原因___________ 。
(3)470K时,F2与Cl2反应生成ClF,常温常压下,ClF为无色气体,固态ClF的晶体类型为___________ 。
(4)一定条件下,CuCl2、K和F2反应生成KCl和化合物X。已知X属于四方晶系,晶胞结构如图所示(晶胞参数 ,
,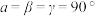 ),其中Cu化合价为+2。上述反应中K和F2的物质的量之比为
),其中Cu化合价为+2。上述反应中K和F2的物质的量之比为___________ 。与Cu原子距离最近的F原子的数目为___________ ,若该化合物的密度为 ,则阿伏加徳罗常数的值NA=
,则阿伏加徳罗常数的值NA=___________ (用含 、a、c的代数式表示。
、a、c的代数式表示。
(1)下列说法正确的是___________。
A.能量最低的激发态F原子的电子排布图为: |
| B.化学键中离子键成分的百分数:CaF2>LiF>NaF |
| C.HF的沸点比H2O低是因为HF氢键的键能小于H2O |
| D.已知N—F键的极性比N—H的极性强,因此NF3分子的极性比NH3的极性弱 |
(2)ClO2中心原子为Cl,Cl2O中心原子为O,二者均为V形结构,但ClO2中存在大π键(
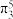 ),ClO2中Cl原子的轨道杂化方式
),ClO2中Cl原子的轨道杂化方式(3)470K时,F2与Cl2反应生成ClF,常温常压下,ClF为无色气体,固态ClF的晶体类型为
(4)一定条件下,CuCl2、K和F2反应生成KCl和化合物X。已知X属于四方晶系,晶胞结构如图所示(晶胞参数
 ,
,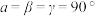 ),其中Cu化合价为+2。上述反应中K和F2的物质的量之比为
),其中Cu化合价为+2。上述反应中K和F2的物质的量之比为 ,则阿伏加徳罗常数的值NA=
,则阿伏加徳罗常数的值NA= 、a、c的代数式表示。
、a、c的代数式表示。
您最近一年使用:0次
解题方法
2 . 第二周期非金属元素的单质及其化合物是生命活动的重要物质基础。请回答:
(1)下列说法正确的是_______。
(2)有机物转化及相应产率: ,所有有机物中碳原子的杂化方式为
,所有有机物中碳原子的杂化方式为_______ ,后者产物的产率低的原因是_______ 。
(3)当负电荷位于电负性大的原子时,结构较稳定。 结合
结合 ,通过电子转移可得到下列粒子,稳定性最弱的粒子是_______。
,通过电子转移可得到下列粒子,稳定性最弱的粒子是_______。
(4)某新型电池的正极材料由F、K、Ni三种元素组成,其晶胞如图所示:

①基态Ni的核外电子排布式为_______ 。
②K与F间的化学键的离子键百分率_______ Ni与F间的化学键(选填“大于”或“小于”)。
③该材料中,Ni元素的化合价为_______ 。
(1)下列说法正确的是_______。
A. 三种分子的键角逐渐减小 三种分子的键角逐渐减小 |
| B.第二周期非金属元素的最高正价逐渐升高 |
C. 最外层电子排布为 最外层电子排布为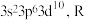 与硼元素同主族 与硼元素同主族 |
D.结合质子趋势: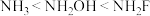 |
(2)有机物转化及相应产率:
 ,所有有机物中碳原子的杂化方式为
,所有有机物中碳原子的杂化方式为(3)当负电荷位于电负性大的原子时,结构较稳定。
 结合
结合 ,通过电子转移可得到下列粒子,稳定性最弱的粒子是_______。
,通过电子转移可得到下列粒子,稳定性最弱的粒子是_______。A. | B. | C. | D. |
(4)某新型电池的正极材料由F、K、Ni三种元素组成,其晶胞如图所示:

①基态Ni的核外电子排布式为
②K与F间的化学键的离子键百分率
③该材料中,Ni元素的化合价为
您最近一年使用:0次
解题方法
3 . ⅤA族元素有的是金属元素,有的是非金属元素,应用非常广泛。回答下列问题:
(1)基态P原子的价层电子排布式为_______ 。
(2)氮原子与碳原子形成六元环状结构,再通过相互连接形成层状“类石墨”晶体结构,有良好的光催化性能。如图是这种石墨相共价化合物的单层结构。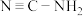 )为原料在不断加热条件下制得,其中双氰胺和三聚氰胺分别是加热至203℃和234℃时得到的中间产物,三聚氰胺的分子式为
)为原料在不断加热条件下制得,其中双氰胺和三聚氰胺分别是加热至203℃和234℃时得到的中间产物,三聚氰胺的分子式为_______ 。
②这种化合物中的氮原子与碳原子杂化方式是______ ,结构图空框中是晶体的末尾含氢 官能团,该官能团的结构简式为_______ 。
③下列有关这种化合物说法不正确 的是______ 。
A.两种结构相似的完美共价晶体熔点:氮化碳<氮化硅
B.激发态 原子可能的电子排布式为:
原子可能的电子排布式为:
C.这种化合物每个六元环含有2个碳原子和2个氮原子
D.已知苯胺的碱性比氨弱,所以氨基氰的碱性也比氨弱
(3)立方氮化硼(CBN)晶体的极端条件性能稳定,是理想的第三代半导体材料,其结构如图所示。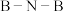 的键角为
的键角为______ 。
② 原子分数坐标为
原子分数坐标为 ,则原子
,则原子 的坐标为
的坐标为______ 。
(1)基态P原子的价层电子排布式为
(2)氮原子与碳原子形成六元环状结构,再通过相互连接形成层状“类石墨”晶体结构,有良好的光催化性能。如图是这种石墨相共价化合物的单层结构。

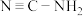 )为原料在不断加热条件下制得,其中双氰胺和三聚氰胺分别是加热至203℃和234℃时得到的中间产物,三聚氰胺的分子式为
)为原料在不断加热条件下制得,其中双氰胺和三聚氰胺分别是加热至203℃和234℃时得到的中间产物,三聚氰胺的分子式为②这种化合物中的氮原子与碳原子杂化方式是
③下列有关这种化合物说法
A.两种结构相似的完美共价晶体熔点:氮化碳<氮化硅
B.激发态
 原子可能的电子排布式为:
原子可能的电子排布式为: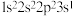
C.这种化合物每个六元环含有2个碳原子和2个氮原子
D.已知苯胺的碱性比氨弱,所以氨基氰的碱性也比氨弱
(3)立方氮化硼(CBN)晶体的极端条件性能稳定,是理想的第三代半导体材料,其结构如图所示。

 的键角为
的键角为②
 原子分数坐标为
原子分数坐标为 ,则原子
,则原子 的坐标为
的坐标为
您最近一年使用:0次
4 . 卤族元素可以与很多元素形成多种具有不同组成、结构、性质的物质。请回答下列问题:
(1)基态氟原子价电子的轨道表示式为_______ 。
(2)亚硝酰氯(NOCl)是有机合成中的重要试剂,其中中心原子的杂化形式为_______ 。等电子体是指价电子数和原子数相同的分子、离子或原子团,写出与(NOCl)互为等电子体的一种分子_______ (填化学式)。
(3)东南大学某课题组合成了一种新型具有平面分子结构的醌类聚合物PPPA,PPPA可作为有机锌离子电池的正极材料。_______ 。
②NaCl溶液中存在水合钠离子,其示意图如图1所示。从电负性角度来解释这一现象_______ 。
(4)磷和硫均能形成多种卤化物。下列说法正确的是_______ (填标号)。
A.SCl2、PCl5均属于非极性分子
B.PCl3、S2Cl2的空间构型分别为三角锥形、直线形
C.NF3、S2Br2分子中各原子最外层均满足8电子稳定结构
(5)γ-AgI晶胞为立方结构,晶胞中I-采取面心立方堆积方式(如图3);γ-AgI晶胞沿x、y、z轴方向的投影均如图4所示。_______ (填“正四面体”或“正八面体”)空隙,其填充率为_______ 。
②γ-AgI晶胞的密度为ρg•cm-3,则晶胞中两个最近的Ag+之间的距离为_______ nm(NA表示阿伏加德罗常数的值)。
(1)基态氟原子价电子的轨道表示式为
(2)亚硝酰氯(NOCl)是有机合成中的重要试剂,其中中心原子的杂化形式为
(3)东南大学某课题组合成了一种新型具有平面分子结构的醌类聚合物PPPA,PPPA可作为有机锌离子电池的正极材料。

②NaCl溶液中存在水合钠离子,其示意图如图1所示。从电负性角度来解释这一现象
(4)磷和硫均能形成多种卤化物。下列说法正确的是
A.SCl2、PCl5均属于非极性分子
B.PCl3、S2Cl2的空间构型分别为三角锥形、直线形
C.NF3、S2Br2分子中各原子最外层均满足8电子稳定结构
(5)γ-AgI晶胞为立方结构,晶胞中I-采取面心立方堆积方式(如图3);γ-AgI晶胞沿x、y、z轴方向的投影均如图4所示。

②γ-AgI晶胞的密度为ρg•cm-3,则晶胞中两个最近的Ag+之间的距离为
您最近一年使用:0次
解题方法
5 . 硫及其化合物在生活、生产中有着广泛的应用。
(1)基态硫原子的价层电子轨道表示式是______ 。
(2)S单质的常见形式为S8,其环状结构如图1所示,其中S原子的杂化方式是______ 。______ 。
(4)大π键可用符号π表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则SO3中的大π键可表示为______ 。
(5)黄铜矿为含硫矿石,这种矿石浑身都是宝。黄铜矿的晶胞如图2所示,原子1的坐标为( ,
, ,2)与Cu(0,0,0)最近的Fe原子的坐标为
,2)与Cu(0,0,0)最近的Fe原子的坐标为______ ;若阿伏加德罗常数的值为NA,则黄铜矿晶体的密度是______ g•cm-3。
(1)基态硫原子的价层电子轨道表示式是
(2)S单质的常见形式为S8,其环状结构如图1所示,其中S原子的杂化方式是
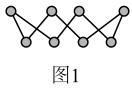
| A.H2S分子的空间构形是直线型 |
| B.六氟化硫(SF6)中心原子的杂化方式为sp3d2 |
| C.第一电离能大小顺序F>O>S |
| D.工业生产硫酸时用水吸收SO3 |
(4)大π键可用符号π表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则SO3中的大π键可表示为
(5)黄铜矿为含硫矿石,这种矿石浑身都是宝。黄铜矿的晶胞如图2所示,原子1的坐标为(
 ,
, ,2)与Cu(0,0,0)最近的Fe原子的坐标为
,2)与Cu(0,0,0)最近的Fe原子的坐标为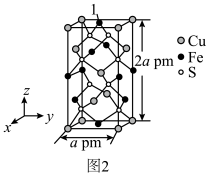
您最近一年使用:0次
6 . 回答下列问题:
(1)基态 原子的核外电子排布式为
原子的核外电子排布式为___________ 。
(2)三氟化硼 是一种无色气体,用于制造火箭的高能燃料。
是一种无色气体,用于制造火箭的高能燃料。 水解生成一种“一元”含氧酸甲和另一种一元无氧酸乙,乙中B的杂化方式是
水解生成一种“一元”含氧酸甲和另一种一元无氧酸乙,乙中B的杂化方式是 ,则乙的化学式是
,则乙的化学式是___________ 。
(3)在吡啶( )、噻吩(
)、噻吩( )、呋喃(
)、呋喃( )三种杂环化合物均为共平面结构,N、S、O均有给电子共轭效应,其中O和S的给电子共轭效应均弱于N,请解释原因
)三种杂环化合物均为共平面结构,N、S、O均有给电子共轭效应,其中O和S的给电子共轭效应均弱于N,请解释原因___________ 。
(4)下列说法正确的是___________。
(5)氧化铈 常用作玻璃工业添加剂,在其立方晶胞中掺杂
常用作玻璃工业添加剂,在其立方晶胞中掺杂 占据原来
占据原来 的位置,可以得到更稳定的结构,这种稳定的结构使得氧化铈具有许多独特的性质和应用。假设
的位置,可以得到更稳定的结构,这种稳定的结构使得氧化铈具有许多独特的性质和应用。假设 晶胞边长为
晶胞边长为 。晶胞结构如下图:
。晶胞结构如下图: 晶胞中与
晶胞中与 相邻且最近的
相邻且最近的 有
有___________ 个。若掺杂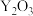 后得到
后得到 的晶体,则此晶体中
的晶体,则此晶体中 的空缺率为
的空缺率为___________ 。
(1)基态
 原子的核外电子排布式为
原子的核外电子排布式为(2)三氟化硼
 是一种无色气体,用于制造火箭的高能燃料。
是一种无色气体,用于制造火箭的高能燃料。 水解生成一种“一元”含氧酸甲和另一种一元无氧酸乙,乙中B的杂化方式是
水解生成一种“一元”含氧酸甲和另一种一元无氧酸乙,乙中B的杂化方式是 ,则乙的化学式是
,则乙的化学式是(3)在吡啶(
 )、噻吩(
)、噻吩( )、呋喃(
)、呋喃( )三种杂环化合物均为共平面结构,N、S、O均有给电子共轭效应,其中O和S的给电子共轭效应均弱于N,请解释原因
)三种杂环化合物均为共平面结构,N、S、O均有给电子共轭效应,其中O和S的给电子共轭效应均弱于N,请解释原因(4)下列说法正确的是___________。
| A.第二周期,第一电离能介于B和F之间的元素有3种 |
B.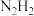 存在顺反异构 存在顺反异构 |
C.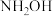 中N原子可通过配位键与 中N原子可通过配位键与 结合而使分子本身具有碱性,且 结合而使分子本身具有碱性,且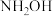 的碱性弱于 的碱性弱于 |
D. 的键角小于 的键角小于 |
(5)氧化铈
 常用作玻璃工业添加剂,在其立方晶胞中掺杂
常用作玻璃工业添加剂,在其立方晶胞中掺杂 占据原来
占据原来 的位置,可以得到更稳定的结构,这种稳定的结构使得氧化铈具有许多独特的性质和应用。假设
的位置,可以得到更稳定的结构,这种稳定的结构使得氧化铈具有许多独特的性质和应用。假设 晶胞边长为
晶胞边长为 。晶胞结构如下图:
。晶胞结构如下图:
 晶胞中与
晶胞中与 相邻且最近的
相邻且最近的 有
有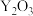 后得到
后得到 的晶体,则此晶体中
的晶体,则此晶体中 的空缺率为
的空缺率为
您最近一年使用:0次
解题方法
7 . 由汞( )、锗(
)、锗( )、锑(
)、锑( )形成的一种新物质M为潜在的拓扑绝缘体材料。M晶体可视为
)形成的一种新物质M为潜在的拓扑绝缘体材料。M晶体可视为 晶体(立方晶胞如图a所示)中部分
晶体(立方晶胞如图a所示)中部分 原子被
原子被 和
和 取代后形成(晶胞如图c所示),M的摩尔质量为
取代后形成(晶胞如图c所示),M的摩尔质量为 。
。
(1)已知汞的价层电子排布式为 ,它位于周期表的
,它位于周期表的___________ 区,M晶胞中与 距离最近的
距离最近的 共有
共有___________ 个。
(2)下列说法正确的是___________。
(3)①锗晶体类型为___________ , 与C同族,但
与C同族,但 不能像C原子那样原子之间可以形成双键或叁键,从原子结构角度解释原因
不能像C原子那样原子之间可以形成双键或叁键,从原子结构角度解释原因___________ 。
②图b不是晶胞单元的理由是___________ 。
 )、锗(
)、锗( )、锑(
)、锑( )形成的一种新物质M为潜在的拓扑绝缘体材料。M晶体可视为
)形成的一种新物质M为潜在的拓扑绝缘体材料。M晶体可视为 晶体(立方晶胞如图a所示)中部分
晶体(立方晶胞如图a所示)中部分 原子被
原子被 和
和 取代后形成(晶胞如图c所示),M的摩尔质量为
取代后形成(晶胞如图c所示),M的摩尔质量为 。
。
(1)已知汞的价层电子排布式为
 ,它位于周期表的
,它位于周期表的 距离最近的
距离最近的 共有
共有(2)下列说法正确的是___________。
A.1个 晶胞中含有4个 晶胞中含有4个 原子 原子 |
B. 晶胞中 晶胞中 原子的杂化方式为 原子的杂化方式为 杂化 杂化 |
C.M的化学式为 |
D.M晶体的密度为: |
(3)①锗晶体类型为
 与C同族,但
与C同族,但 不能像C原子那样原子之间可以形成双键或叁键,从原子结构角度解释原因
不能像C原子那样原子之间可以形成双键或叁键,从原子结构角度解释原因②图b不是晶胞单元的理由是
您最近一年使用:0次
名校
解题方法
8 . 卤素单质及其化合物在科研和工农业生产中有着广泛的应用。请回答:
(1)基态F原子核外电子的空间运动状态有_______ 种。下列属于氯原子激发态且能量较低的是_______ 。(填标号)
a.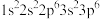 b.
b.
c. d.
d.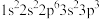
(2)下列说法不正确的是_______
(3)固态氟化氢中存在 形式,画出
形式,画出 的链状结构
的链状结构_______ 。
(4)已知键能: ,请说明理由:
,请说明理由:_______ 。
(5)已知某晶体的结构,其晶胞中阴离子(阳离子未画出)的位置如图1所示,其晶胞中的阳离子(隐去阴离子)在xz、yz和xy平面投影均如图2所示。
①其化学式为_______ ;
②每个 的配位数(紧邻的F原子数)为
的配位数(紧邻的F原子数)为_______ 。
(1)基态F原子核外电子的空间运动状态有
a.
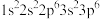 b.
b.
c.
 d.
d.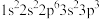
(2)下列说法不正确的是_______
A.熔点 | B.化学键中离子键成分的百分数 |
C.第三电离能: | D.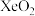 与 与 中心原子的杂化方式相同 中心原子的杂化方式相同 |
(3)固态氟化氢中存在
 形式,画出
形式,画出 的链状结构
的链状结构(4)已知键能:
 ,请说明理由:
,请说明理由:(5)已知某晶体的结构,其晶胞中阴离子(阳离子未画出)的位置如图1所示,其晶胞中的阳离子(隐去阴离子)在xz、yz和xy平面投影均如图2所示。

①其化学式为
②每个
 的配位数(紧邻的F原子数)为
的配位数(紧邻的F原子数)为
您最近一年使用:0次
名校
9 . 硫及其化合物有许多用途,古代用高温煅烧绿矾和胆矾的方法来制备硫酸。请回答:
(1)① 的价层电子排布式为
的价层电子排布式为______ 。
②基态硫原子有______ 种空间运动状态。
(2)煅烧胆矾可得三氧化硫,液态三氧化硫有单分子: 和三聚体
和三聚体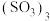 两种形式,固态三氧化硫易升华,易溶于水,主要以三聚体和无限长链
两种形式,固态三氧化硫易升华,易溶于水,主要以三聚体和无限长链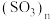 两种形式存在。下列说法不正确的是______。
两种形式存在。下列说法不正确的是______。
(3) 结构为
结构为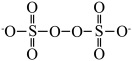 ,
, 比
比 的氧化性更强,其原因是
的氧化性更强,其原因是______ 。
(4)S与A、B两种金属形成的晶胞如图所示,B的配位数为______ ,该化合物的化学式为______ ,其摩尔质量为Mg/mol,阿伏加德罗常数为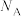 ,晶胞参数为:x=0.052,y=0.103,该晶体的密度ρ=
,晶胞参数为:x=0.052,y=0.103,该晶体的密度ρ=______  (列出计算式即可)。
(列出计算式即可)。
(1)①
 的价层电子排布式为
的价层电子排布式为②基态硫原子有
(2)煅烧胆矾可得三氧化硫,液态三氧化硫有单分子:
 和三聚体
和三聚体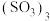 两种形式,固态三氧化硫易升华,易溶于水,主要以三聚体和无限长链
两种形式,固态三氧化硫易升华,易溶于水,主要以三聚体和无限长链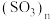 两种形式存在。下列说法不正确的是______。
两种形式存在。下列说法不正确的是______。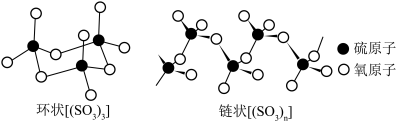
A. 中心原子为 中心原子为 杂化,空间结构为平面三角形 杂化,空间结构为平面三角形 |
B.环状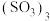 中硫原子的杂化轨道类型为 中硫原子的杂化轨道类型为 |
C.单分子 和链状 和链状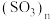 均是分子晶体 均是分子晶体 |
D.链状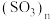 中 中 杂化的氧为3n个 杂化的氧为3n个 |
(3)
 结构为
结构为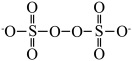 ,
, 比
比 的氧化性更强,其原因是
的氧化性更强,其原因是(4)S与A、B两种金属形成的晶胞如图所示,B的配位数为
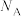 ,晶胞参数为:x=0.052,y=0.103,该晶体的密度ρ=
,晶胞参数为:x=0.052,y=0.103,该晶体的密度ρ= (列出计算式即可)。
(列出计算式即可)。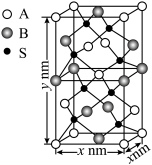
您最近一年使用:0次
名校
10 . 电池在人类生产生活中具有十分重要的作用,单晶硅和铜、锗、镓等的化合物常作为制备太阳能电池的原料。回答下列问题:
(1)基态镓原子的价层电子排布图是______ 。
(2)四氯化硅属于______ 晶体,硅原子的杂化方式是______ 。
(3)下列锗卤化物的熔点和沸点,产生该变化规律的原因是______ 。
(4)比较键角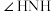 :
: 中的
中的
______  中的
中的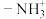 (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由______ 。
(1)基态镓原子的价层电子排布图是
(2)四氯化硅属于
(3)下列锗卤化物的熔点和沸点,产生该变化规律的原因是
|
|
| |
熔点 | -49.5 | 26 | 146 |
沸点 | 83.1 | 186 | 约400 |
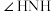 :
: 中的
中的
 中的
中的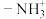 (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由
您最近一年使用:0次