23-24高三下·陕西西安·阶段练习
解题方法
1 . CdS、ZnS等硫化物与TiO2、SnO2、ZnO等进行复合,可以得到性能很好的复合半导体光催化剂。回答下列问题:
(1)Sn与C同主族,基态Sn原子的价层电子排布式为_______ ,基态Ti原子核外电子有_______ 种空间运动状态, 核外未成对电子数为
核外未成对电子数为_______ ,ZnS、ZnO中各元素的电负性由大到小的顺序为_______ 。
(2)许多具有—C═N—结构的分子及其硼配合物是较好的荧光材料,在光学探针、有机发光二极管等领域受到广泛关注,某两种含这种结构的分子如图1、图2所示。_______ ;图2中N原子会和B原子形成配位键,成键时_______ (填元素符号)原子提供空轨道。
(3)N、O、F三种元素的第一电离能由大到小的顺序为_______ (填元素符号),解释其原因:_______ 。
(4)钾冰晶石型晶体是一类新型的无机闪烁体,在核安全以及国土安全检查方面有重要的应用。如图是一种钾冰晶石型闪烁体的晶胞结构,属于立方晶系,其中A位是 、B位是
、B位是 、R位是正三价的Y(钇),X位是
、R位是正三价的Y(钇),X位是 。
。_______ 。
②若晶胞参数为anm,该晶体的密度为_______ g (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
(1)Sn与C同主族,基态Sn原子的价层电子排布式为
 核外未成对电子数为
核外未成对电子数为(2)许多具有—C═N—结构的分子及其硼配合物是较好的荧光材料,在光学探针、有机发光二极管等领域受到广泛关注,某两种含这种结构的分子如图1、图2所示。

(3)N、O、F三种元素的第一电离能由大到小的顺序为
(4)钾冰晶石型晶体是一类新型的无机闪烁体,在核安全以及国土安全检查方面有重要的应用。如图是一种钾冰晶石型闪烁体的晶胞结构,属于立方晶系,其中A位是
 、B位是
、B位是 、R位是正三价的Y(钇),X位是
、R位是正三价的Y(钇),X位是 。
。
②若晶胞参数为anm,该晶体的密度为
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
解题方法
2 . 亚铁氰化钾( )双称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为:
)双称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为: (腾氏蓝)
(腾氏蓝) ,回答问题:
,回答问题:
(1)写出铁原子的价电子排布图___________ ,基态 的核外电子排布式
的核外电子排布式___________ 。
(2) 中的作用力除共价键外,还有
中的作用力除共价键外,还有___________ 和___________ ,提供空轨道是___________ ,配位数___________ 。
(3)黄血盐中N原子的杂化方式为___________ 。
 )双称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为:
)双称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为: (腾氏蓝)
(腾氏蓝) ,回答问题:
,回答问题:(1)写出铁原子的价电子排布图
 的核外电子排布式
的核外电子排布式(2)
 中的作用力除共价键外,还有
中的作用力除共价键外,还有(3)黄血盐中N原子的杂化方式为
您最近一年使用:0次
名校
解题方法
3 . 物质的组成与结构决定了物质的性质与变化。回答下列问题:
(1)基态铁原子简化的电子排布式为[Ar]___________ 。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是___________ 。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为___________ ,提供孤电子对的成键原子是___________ 。
③氨的沸点高于膦(PH3)的原因是___________ ;PH3分子中P原子的杂化轨道类型为___________ 。
(3)铜与(SCN)2反应生成Cu(SCN)2,1mol(SCN)2中含有π键的数目为___________ 。
(4)碘与锰形成的某种化合物晶胞结构及参数如图所示,该化合物的化学式是___________ ,其晶体密度的计算表达式为___________ g·cm-3(阿伏加德罗常数的值用NA表示)。

(1)基态铁原子简化的电子排布式为[Ar]
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为
③氨的沸点高于膦(PH3)的原因是
(3)铜与(SCN)2反应生成Cu(SCN)2,1mol(SCN)2中含有π键的数目为
(4)碘与锰形成的某种化合物晶胞结构及参数如图所示,该化合物的化学式是

您最近一年使用:0次
名校
解题方法
4 . 2019年,我国第二艘国产航母即将下水。建造航母需要大量的新型材料。航母的龙骨要耐冲击,甲板要耐高温,外壳要耐腐蚀。
(1)镍铬钢抗腐蚀性能强,其中主要金属为铬、镍、铁等。基态铬的价电子排布图为:_______ ;基态铁的未成对电子数是:_______ ;我们常用SCN-检验Fe3+,请写出SCN-的电子式:_______ 。
(2)海水中含有大量盐,对金属有很强的腐蚀性,其中大多数盐是卤盐。根据下列卤化钠的信息回答问题
NaF的熔点比NaI的熔点高的原因是:_______ 。
(3)钛的“热传导系数低”,耐高温耐腐蚀,所以配备垂直起降战斗机的甲板是需要钛合金铆钉的。
①在钛合金中添加硅可以提高其耐热性能。硅在自然界中主要以二氧化硅和硅酸盐的形式存在,在硅酸盐中 的空间构型为
的空间构型为_______ ,在二氧化硅中硅原子的杂化方式为_______ 。
②在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1∶5,则该配离子的化学式为:_______ 。
(1)镍铬钢抗腐蚀性能强,其中主要金属为铬、镍、铁等。基态铬的价电子排布图为:
(2)海水中含有大量盐,对金属有很强的腐蚀性,其中大多数盐是卤盐。根据下列卤化钠的信息回答问题
| 化学式 | NaF | NaCl | NaBr | NaI |
| 熔点/℃ | 995 | 801 | 775 | 651 |
NaF的熔点比NaI的熔点高的原因是:
(3)钛的“热传导系数低”,耐高温耐腐蚀,所以配备垂直起降战斗机的甲板是需要钛合金铆钉的。
①在钛合金中添加硅可以提高其耐热性能。硅在自然界中主要以二氧化硅和硅酸盐的形式存在,在硅酸盐中
 的空间构型为
的空间构型为②在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1∶5,则该配离子的化学式为:
您最近一年使用:0次
解题方法
5 . 硫铁矿(主要成分FeS2)是接触法制硫酸的主要原料,接触法制硫酸的生产原理分三步。
I.4FeS2 +11O2 2Fe2O3+8SO2;
2Fe2O3+8SO2;
II.2SO2 +O2 2SO3;
2SO3;
III.SO3+H2O=H2SO4。
回答下列问题:
(1)①基态O原子的核外电子排布式为_______ ;基态Fe原子共有_______ 种运动状态不同的电子。
②Fe2+形成的配合物亚铁氰化钾(K4[Fe(CN)6])又称黄血盐,可用于检验Fe3+。写出两种与CN-互为等电子体的分子的化学式:_______ ;含有12 mol σ键的K4[Fe(CN)6]的物质的量为_______ mol。
③已知Fe2+半径为61 pm,Co2+半径为65 pm, 则在隔绝空气条件下分别加热FeCO3和CoCO3,FeCO3受热分解温度_______ (填“ 低于”或“高于”)CoCO3。
(2)①H2SO4的酸性强于H2SO3的酸性的原因是_______ 。
②SO2中S原子的杂化方式为_______ ;SO3的立体构型为_______ 。第一电离能:S_______ O(填“>”或“<”)。
(3)FeS2晶体的晶胞结构如图所示。

①FeS2晶体中距离Fe2+最近的Fe2+的数目为_______ 。
②FeS2晶体的晶胞参数为a nm,密度为ρg·cm-3,阿伏加德罗常数的值为NA,则FeS2的摩尔质量M=_______ g·mol-1(用含a、ρ、NA的代数式表示)。
I.4FeS2 +11O2
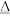 2Fe2O3+8SO2;
2Fe2O3+8SO2;II.2SO2 +O2
 2SO3;
2SO3;III.SO3+H2O=H2SO4。
回答下列问题:
(1)①基态O原子的核外电子排布式为
②Fe2+形成的配合物亚铁氰化钾(K4[Fe(CN)6])又称黄血盐,可用于检验Fe3+。写出两种与CN-互为等电子体的分子的化学式:
③已知Fe2+半径为61 pm,Co2+半径为65 pm, 则在隔绝空气条件下分别加热FeCO3和CoCO3,FeCO3受热分解温度
(2)①H2SO4的酸性强于H2SO3的酸性的原因是
②SO2中S原子的杂化方式为
(3)FeS2晶体的晶胞结构如图所示。

①FeS2晶体中距离Fe2+最近的Fe2+的数目为
②FeS2晶体的晶胞参数为a nm,密度为ρg·cm-3,阿伏加德罗常数的值为NA,则FeS2的摩尔质量M=
您最近一年使用:0次
解题方法
6 . 已知反应2K2Cr2O7+3CH3CH2OH+8H2SO4+13H2O=2[Cr(H2O)6]2(SO4)3+3CH3COOH+2K2SO4是交警检查驾驶员是否酒驾时所用检测仪的工作原理。回答下列问题:
(1)基态铬原子价层电子排布图为___________ ,点燃含钾元素的物质时,钾原子的价电子由___________ (填“激发态”或“基态”)跃迁到另一状态时会产生紫色的火焰。
(2)在[Cr(H2O)6]3+中,提供孤电子对以形成配位键的元素是___________ ,K、S、O三种元素的第一电离能由大到小的顺序为___________ ,与CH3CH2OH相比,CH3COOH中碳原子所含有的不同类型的杂化方式是___________ 。
(3)CH3CH2OH的沸点为78.5℃、CH3COOH的沸点为117.9℃,导致这种差异的主要原因是___________ 。
(4)已知CrO2Cl2与CCl4、CS2等互溶,据此可判断CrO2Cl2分子的空间构型是___________ (填“四面体”或“四边形”);硫的一种氧化物的部分结构片段如图所示,则该氧化物的化学式为___________ 。

(5)已知单质铬的原子的一种堆积方式如图所示,则该堆积方式的名称是___________ ,若铬原子半径为rpm,阿伏加德罗常数的值为NA,则单质铬的密度为___________ g·cm-3(列出计算式即可)。

(1)基态铬原子价层电子排布图为
(2)在[Cr(H2O)6]3+中,提供孤电子对以形成配位键的元素是
(3)CH3CH2OH的沸点为78.5℃、CH3COOH的沸点为117.9℃,导致这种差异的主要原因是
(4)已知CrO2Cl2与CCl4、CS2等互溶,据此可判断CrO2Cl2分子的空间构型是

(5)已知单质铬的原子的一种堆积方式如图所示,则该堆积方式的名称是

您最近一年使用:0次
解题方法
7 . 钢化玻璃因其优良的性能广泛应用于日常生活,但由于制作玻璃时里面含有极少量硫化镍,使得钢化玻璃在极限条件下的使用受到限制。
(1)基态硫原子价层电子的轨道表达式(电子排布图)为___ ,基态镍原子中核外电子占据最高能层的符号为__ 。
(2)Ni(CO)4常用于制备纯镍,溶于乙醇、CCl4、苯等有机溶剂,为___ 晶体,Ni(CO)4空间构型与甲烷相同,中心原子的杂化轨道类型为___ ,写出与配体互为等电子体的分子___ 。
(3)与硫同族的硒元素有两种常见的二元含氧酸分别为___ 、___ (填化学式)。
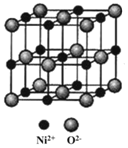
(4)NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的正八面体空隙中,已知晶胞参数为apm,阿伏加德罗常数为NA,NiO晶体的密度为____ g/cm3(列出计算式 。
。
(1)基态硫原子价层电子的轨道表达式(电子排布图)为
(2)Ni(CO)4常用于制备纯镍,溶于乙醇、CCl4、苯等有机溶剂,为
(3)与硫同族的硒元素有两种常见的二元含氧酸分别为
(4)NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的正八面体空隙中,已知晶胞参数为apm,阿伏加德罗常数为NA,NiO晶体的密度为
 。
。
您最近一年使用:0次
名校
解题方法
8 . 第三代太阳能电池是铜铟镓硒CIGS等化合物薄太阳能电池以及薄膜Si系太阳能电池。请回答下列问题:
(1)晶体Si中硅原子的杂化方式是_______ ,基态Ga原子的价电子排布式是_______ 。
(2)H2O沸点_______ (填“高于”或“低于”)H2Se的沸点,其原因是_______ 。
(3)向硫酸铜溶液中逐滴滴加浓氨水,先出现蓝色絮状沉淀,后沉淀逐渐溶解得到[Cu(NH3)4]SO4的深蓝色透明溶液。
①在[Cu(NH3)4]2+中,Cu2+与NH3之间形成的化学键称为_______ ,提供孤电子对的成键原子是_______ 。
②锌与铜位于同一周期。硫化锌的结构如图甲所示,硫离子周围等距离且最近的锌离子个数是_______ ;某含铜化合物的晶胞如图乙所示,晶胞上下底面为正方形,侧面与底面垂直,则该化合物的化学式是_______ ,设NA为阿伏加德罗常数的值,则该晶胞的密度是_______ g/cm3(用含a、b、NA的代数式表示)。

(1)晶体Si中硅原子的杂化方式是
(2)H2O沸点
(3)向硫酸铜溶液中逐滴滴加浓氨水,先出现蓝色絮状沉淀,后沉淀逐渐溶解得到[Cu(NH3)4]SO4的深蓝色透明溶液。
①在[Cu(NH3)4]2+中,Cu2+与NH3之间形成的化学键称为
②锌与铜位于同一周期。硫化锌的结构如图甲所示,硫离子周围等距离且最近的锌离子个数是

您最近一年使用:0次
2021-01-19更新
|
123次组卷
|
2卷引用:西藏拉萨中学2021届高三上学期第五次月考化学试题
名校
解题方法
9 . 硼砂是含结晶水的四硼酸钠。以硼砂为原料,可以得到BF3、BN和硼酸等重要化合物,请根据图中信息回答有关问题:


(1)硼砂中阴离子Xm-(含B、O、H三种元素)的球棍模型如图1所示,则在Xm-中,2号硼原子的杂化类型为_______ ;m=_______ (填数字)。
(2)BF3和过量NaF作用可生成NaBF4,BF 的价层电子对数为
的价层电子对数为_______ ;BF 的立体构型为
的立体构型为_______ 。
(3)硼酸[B(OH)3]结构如图2所示,分子中一个B原子与3个羟基相连,硼酸为一元弱酸,与过量NaOH反应生成[B(OH)4]-,请用化学键有关知识分析[B(OH)4]-的形成原因:_______ 。
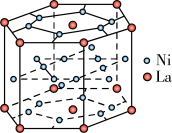
(4)镧系合金是稀土系储氢合金的典型代表,由荷兰菲利浦实验室首先研制出来。它的最大优点是容易活化。其晶胞结构如图所示,则它的化学式为_______ ,镍的价电子排布式_______ 。
(5)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为( ,0,
,0, );C为(
);C为( ,
, ,0)。
,0)。

②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为_______ g·cm-3(列出计算式即可)。


(1)硼砂中阴离子Xm-(含B、O、H三种元素)的球棍模型如图1所示,则在Xm-中,2号硼原子的杂化类型为
(2)BF3和过量NaF作用可生成NaBF4,BF
 的价层电子对数为
的价层电子对数为 的立体构型为
的立体构型为(3)硼酸[B(OH)3]结构如图2所示,分子中一个B原子与3个羟基相连,硼酸为一元弱酸,与过量NaOH反应生成[B(OH)4]-,请用化学键有关知识分析[B(OH)4]-的形成原因:
(4)镧系合金是稀土系储氢合金的典型代表,由荷兰菲利浦实验室首先研制出来。它的最大优点是容易活化。其晶胞结构如图所示,则它的化学式为

(5)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(
 ,0,
,0, );C为(
);C为( ,
, ,0)。
,0)。
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为
您最近一年使用:0次
10 . 我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,近年来,人们对这些颜料的成分进行了研究,发现其成分主要为BaCuSi4O10、BaCuSi2O6。
(1)“中国蓝”、“中国紫”中均有Cu2+,基态时该阳离子的价电子排布式为_______ 。
(2)已知Cu的第二电离能大于Zn的第二电离能,请说明原因_______ 。
(3)铜常用作有机反应的催化剂。例如,2CH3CH2OH+O2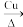 2CH3CHO+2H2O。
2CH3CHO+2H2O。
①乙醇的沸点高于乙醛,其主要原因是_______ ;乙醛分子中π键与σ键的个数比为_______ 。
②乙醛分子中碳原子的杂化轨道类型分别是_______ 、_______ 。
③乙醛分子中各元素电负性由大到小的顺序是_______ 。
(4)铜的晶胞如图所示。铜银合金是优质的金属材料,其晶胞与铜晶胞类似,银位于顶点,铜位于面心。
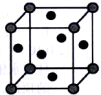
①该铜银合金的化学式是_______ 。
②该铜银晶胞参数为a cm,晶体密度为ρ g·cm-3。则阿伏加德罗常数(NA)为_______ mol-1(列出计算式即可)。
(1)“中国蓝”、“中国紫”中均有Cu2+,基态时该阳离子的价电子排布式为
(2)已知Cu的第二电离能大于Zn的第二电离能,请说明原因
(3)铜常用作有机反应的催化剂。例如,2CH3CH2OH+O2
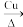 2CH3CHO+2H2O。
2CH3CHO+2H2O。①乙醇的沸点高于乙醛,其主要原因是
②乙醛分子中碳原子的杂化轨道类型分别是
③乙醛分子中各元素电负性由大到小的顺序是
(4)铜的晶胞如图所示。铜银合金是优质的金属材料,其晶胞与铜晶胞类似,银位于顶点,铜位于面心。

①该铜银合金的化学式是
②该铜银晶胞参数为a cm,晶体密度为ρ g·cm-3。则阿伏加德罗常数(NA)为
您最近一年使用:0次



