名校
1 . 钙及其化合物在生产生活中有着重要的作用。
(1)Ca与Fe属于同一周期元素,且核外最外层电子构型相闰,但Ca的熔、沸点都比Fe低,原因是:________ 。
(2) 与水反应生成的
与水反应生成的 分子中,碳原子杂化轨道类型是
分子中,碳原子杂化轨道类型是________ ,且 中
中 与
与 互为等电子体,
互为等电子体, 中含有的
中含有的 键数目为
键数目为________ 。
(3) 的结构如图甲所示,其中B离子表示
的结构如图甲所示,其中B离子表示________ ,晶体中与 最近且等距离的
最近且等距离的 数目为
数目为________ 。 中燃烧时,得到一种氧化物晶体,其结构如图乙所示,由此可判断该氧化物中阴、阳离子数目之比为
中燃烧时,得到一种氧化物晶体,其结构如图乙所示,由此可判断该氧化物中阴、阳离子数目之比为________ ,已知该氧化物的密度是 ,则晶胞内最近的两个
,则晶胞内最近的两个 间的距离为
间的距离为________ cm(写出计算式即可)。
(1)Ca与Fe属于同一周期元素,且核外最外层电子构型相闰,但Ca的熔、沸点都比Fe低,原因是:
(2)
 与水反应生成的
与水反应生成的 分子中,碳原子杂化轨道类型是
分子中,碳原子杂化轨道类型是 中
中 与
与 互为等电子体,
互为等电子体, 中含有的
中含有的 键数目为
键数目为(3)
 的结构如图甲所示,其中B离子表示
的结构如图甲所示,其中B离子表示 最近且等距离的
最近且等距离的 数目为
数目为
 中燃烧时,得到一种氧化物晶体,其结构如图乙所示,由此可判断该氧化物中阴、阳离子数目之比为
中燃烧时,得到一种氧化物晶体,其结构如图乙所示,由此可判断该氧化物中阴、阳离子数目之比为 ,则晶胞内最近的两个
,则晶胞内最近的两个 间的距离为
间的距离为
您最近一年使用:0次
2 . 硅元素广泛应用于半导体、光伏、塑料工业。回答下列问题:
(1)同周期元素中,成对电子数比硅多的元素有___________ 种。
(2)晶体硅和碳化硅的熔点相比,较高的是___________ (填化学式),原因是___________ 。
(3)由于硅的价层有 轨道可以利用,而碳没有,因此化合物的结构具有较大差异:化合物
轨道可以利用,而碳没有,因此化合物的结构具有较大差异:化合物 (平面形)和
(平面形)和 (三角锥形)中,更易形成配合物的是
(三角锥形)中,更易形成配合物的是___________ (填化学式)。 中元素的电负性由大到小的顺序是
中元素的电负性由大到小的顺序是___________ 。下列划线原子与 中
中 原子杂化类型相同的是
原子杂化类型相同的是___________ (填字母)。
A.COCl2 B.NH3·BH3 C.CH3NH2
(4)一种钛硅碳新型材料可用作高铁车体与供电网的连接材料。该材料的晶胞属于六方晶系(x、y方向的夹角为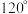 ,z方向垂直于x、y方向,底面棱长均为anm,侧面棱长为cnm),其晶胞结构如图甲所示,晶胞中碳原子的投影位置如图乙所示。
,z方向垂直于x、y方向,底面棱长均为anm,侧面棱长为cnm),其晶胞结构如图甲所示,晶胞中碳原子的投影位置如图乙所示。___________ ,已知该新型材料的摩尔质量为Mg/mol,阿伏加德罗常数的值用NA表示,则其密度为___________ g·cm-3(用含a、c、M、NA的代数式表示)。
(1)同周期元素中,成对电子数比硅多的元素有
(2)晶体硅和碳化硅的熔点相比,较高的是
(3)由于硅的价层有
 轨道可以利用,而碳没有,因此化合物的结构具有较大差异:化合物
轨道可以利用,而碳没有,因此化合物的结构具有较大差异:化合物 (平面形)和
(平面形)和 (三角锥形)中,更易形成配合物的是
(三角锥形)中,更易形成配合物的是 中元素的电负性由大到小的顺序是
中元素的电负性由大到小的顺序是 中
中 原子杂化类型相同的是
原子杂化类型相同的是A.COCl2 B.NH3·BH3 C.CH3NH2
(4)一种钛硅碳新型材料可用作高铁车体与供电网的连接材料。该材料的晶胞属于六方晶系(x、y方向的夹角为
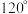 ,z方向垂直于x、y方向,底面棱长均为anm,侧面棱长为cnm),其晶胞结构如图甲所示,晶胞中碳原子的投影位置如图乙所示。
,z方向垂直于x、y方向,底面棱长均为anm,侧面棱长为cnm),其晶胞结构如图甲所示,晶胞中碳原子的投影位置如图乙所示。
您最近一年使用:0次
3 . 铜基催化剂(包括铜、氧化物、铜合金、单原子和复合材料)因其效率高、成本低和对生态友好而受到重视。
(1)基态铜原子的核外电子有______ 种不同的空间运动状态;第二周期元素中,第一电离能比 大的有
大的有______ 种。
(2)研究发现,以掺有镁的铜纳米合金电还原催化 制
制 有较高的选择性,与氮气相比,
有较高的选择性,与氮气相比, 的键能较低
的键能较低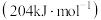 使其成为
使其成为 合成的理想来源。
合成的理想来源。
① 的中心原子的杂化类型为
的中心原子的杂化类型为______ 。
②将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。
______ (填“属于”或“不属于”)顺磁性物质, 中
中 键角
键角______ (填“>”或“<”) 中
中 键角。
键角。
(3)铜基单原子催化剂能将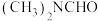 转化为
转化为 。
。
①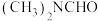 分子中含有
分子中含有______ 个 键。
键。
②沸点: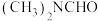
______  (填“>”或“<”)。
(填“>”或“<”)。
(4)一种镁铜合金的晶胞结构如图所示,晶胞参数为 ,该晶胞可看成由8个小立方体构成,其中4个小立方体的体心填入
,该晶胞可看成由8个小立方体构成,其中4个小立方体的体心填入 ,另外4个小立方体的体心填入以四面体方式排列的
,另外4个小立方体的体心填入以四面体方式排列的 ,其余
,其余 占据晶胞的顶点和面心。
占据晶胞的顶点和面心。 与
与 的最短距离为
的最短距离为______  (用含
(用含 的代数式表示);若阿伏加德罗常数的值为
的代数式表示);若阿伏加德罗常数的值为 ,该合金晶体的密度为
,该合金晶体的密度为______  (列出含
(列出含 ,
, 的计算式)。
的计算式)。
(1)基态铜原子的核外电子有
 大的有
大的有(2)研究发现,以掺有镁的铜纳米合金电还原催化
 制
制 有较高的选择性,与氮气相比,
有较高的选择性,与氮气相比, 的键能较低
的键能较低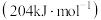 使其成为
使其成为 合成的理想来源。
合成的理想来源。①
 的中心原子的杂化类型为
的中心原子的杂化类型为②将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。

 中
中 键角
键角 中
中 键角。
键角。(3)铜基单原子催化剂能将
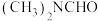 转化为
转化为 。
。①
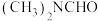 分子中含有
分子中含有 键。
键。②沸点:
 (填“>”或“<”)。
(填“>”或“<”)。(4)一种镁铜合金的晶胞结构如图所示,晶胞参数为
 ,该晶胞可看成由8个小立方体构成,其中4个小立方体的体心填入
,该晶胞可看成由8个小立方体构成,其中4个小立方体的体心填入 ,另外4个小立方体的体心填入以四面体方式排列的
,另外4个小立方体的体心填入以四面体方式排列的 ,其余
,其余 占据晶胞的顶点和面心。
占据晶胞的顶点和面心。
 与
与 的最短距离为
的最短距离为 (用含
(用含 的代数式表示);若阿伏加德罗常数的值为
的代数式表示);若阿伏加德罗常数的值为 ,该合金晶体的密度为
,该合金晶体的密度为 (列出含
(列出含 ,
, 的计算式)。
的计算式)。
您最近一年使用:0次
4 . 卤族元素可以与很多元素形成多种具有不同组成、结构、性质的物质。请回答下列问题:
(1)基态氟原子价电子的轨道表示式为_______ 。
(2)亚硝酰氯(NOCl)是有机合成中的重要试剂,其中中心原子的杂化形式为_______ 。等电子体是指价电子数和原子数相同的分子、离子或原子团,写出与(NOCl)互为等电子体的一种分子_______ (填化学式)。
(3)东南大学某课题组合成了一种新型具有平面分子结构的醌类聚合物PPPA,PPPA可作为有机锌离子电池的正极材料。_______ 。
②NaCl溶液中存在水合钠离子,其示意图如图1所示。从电负性角度来解释这一现象_______ 。
(4)磷和硫均能形成多种卤化物。下列说法正确的是_______ (填标号)。
A.SCl2、PCl5均属于非极性分子
B.PCl3、S2Cl2的空间构型分别为三角锥形、直线形
C.NF3、S2Br2分子中各原子最外层均满足8电子稳定结构
(5)γ-AgI晶胞为立方结构,晶胞中I-采取面心立方堆积方式(如图3);γ-AgI晶胞沿x、y、z轴方向的投影均如图4所示。_______ (填“正四面体”或“正八面体”)空隙,其填充率为_______ 。
②γ-AgI晶胞的密度为ρg•cm-3,则晶胞中两个最近的Ag+之间的距离为_______ nm(NA表示阿伏加德罗常数的值)。
(1)基态氟原子价电子的轨道表示式为
(2)亚硝酰氯(NOCl)是有机合成中的重要试剂,其中中心原子的杂化形式为
(3)东南大学某课题组合成了一种新型具有平面分子结构的醌类聚合物PPPA,PPPA可作为有机锌离子电池的正极材料。

②NaCl溶液中存在水合钠离子,其示意图如图1所示。从电负性角度来解释这一现象
(4)磷和硫均能形成多种卤化物。下列说法正确的是
A.SCl2、PCl5均属于非极性分子
B.PCl3、S2Cl2的空间构型分别为三角锥形、直线形
C.NF3、S2Br2分子中各原子最外层均满足8电子稳定结构
(5)γ-AgI晶胞为立方结构,晶胞中I-采取面心立方堆积方式(如图3);γ-AgI晶胞沿x、y、z轴方向的投影均如图4所示。

②γ-AgI晶胞的密度为ρg•cm-3,则晶胞中两个最近的Ag+之间的距离为
您最近一年使用:0次
解题方法
5 . 硫及其化合物在生活、生产中有着广泛的应用。
(1)基态硫原子的价层电子轨道表示式是______ 。
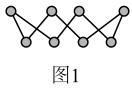
(2)S单质的常见形式为S8,其环状结构如图1所示,其中S原子的杂化方式是______ 。______ 。
(4)大π键可用符号π表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则SO3中的大π键可表示为______ 。
(5)黄铜矿为含硫矿石,这种矿石浑身都是宝。黄铜矿的晶胞如图2所示,原子1的坐标为( ,
, ,2)与Cu(0,0,0)最近的Fe原子的坐标为
,2)与Cu(0,0,0)最近的Fe原子的坐标为______ ;若阿伏加德罗常数的值为NA,则黄铜矿晶体的密度是______ g•cm-3。
(1)基态硫原子的价层电子轨道表示式是
(2)S单质的常见形式为S8,其环状结构如图1所示,其中S原子的杂化方式是
| A.H2S分子的空间构形是直线型 |
| B.六氟化硫(SF6)中心原子的杂化方式为sp3d2 |
| C.第一电离能大小顺序F>O>S |
| D.工业生产硫酸时用水吸收SO3 |
(4)大π键可用符号π表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则SO3中的大π键可表示为
(5)黄铜矿为含硫矿石,这种矿石浑身都是宝。黄铜矿的晶胞如图2所示,原子1的坐标为(
 ,
, ,2)与Cu(0,0,0)最近的Fe原子的坐标为
,2)与Cu(0,0,0)最近的Fe原子的坐标为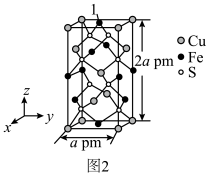
您最近一年使用:0次
解题方法
6 . 硼烷-四氢呋喃(BH3·THF,结构简式为)是一种硼氢化和还原性的试剂,易溶于四氢呋喃(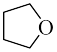 )、蚂水剧烈反应放出氢气 工业上常用于有机物中某些官能团的硼氢化和还原化。请回答下列问题:
)、蚂水剧烈反应放出氢气 工业上常用于有机物中某些官能团的硼氢化和还原化。请回答下列问题:
A.1s22s22p1 B.1s22s2 C.1s22s12p1 D.1s22p2
(2)先将NaBH4和BF3溶于二乙二醇二甲醚(CH3OCH2CH2OCH2CH2OCH3)中,充分溶解,再加入四氢呋喃,反应30 min、缘分离提纯即得较纯净的 BH3·THF,同时还有另一种产物 NaF。
①制备BH3·THF的化学方程式为
②制备过程中,BF3中B的杂化方式的变化是
③二乙二醇二甲醚在水中的溶解度大于在苯中的溶解度,其原因是
(3)硼氢化钠在室温下是α型的立方晶体(如图甲所示),6.3GPa下转变为四方晶体(如图乙所示)。

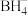 最近的
最近的 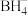 有
有 围成
围成②硼氢化钠的四方晶体中,晶胞中 A、B间距离d=
您最近一年使用:0次
名校
解题方法
7 . 一种比率光声探针M与 配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:
配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:_______ ,基态 的价电子中,两种自旋状态的电子数之比为
的价电子中,两种自旋状态的电子数之比为_______ 。
(2)均为平面结构的吡咯( )和吡啶(
)和吡啶( )是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较小的为
)是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较小的为_______ ,原因是_______ 。
(3) 是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为
是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为 。
。 中
中 键角
键角_______  中
中 键角(填“大于”“小于”或“等于”)。
键角(填“大于”“小于”或“等于”)。
(4) (
( )中
)中 比
比 中的更
中的更_______ (填“难”或“易”)断裂。其原因是_______ 。
元素周期表中,第四周期元素单质及其化合物在化工生产和研究中有重要的应用。
(5)在浓 的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6,组成为
的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6,组成为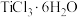 的晶体,该晶体中两种配体的物质的量之比为
的晶体,该晶体中两种配体的物质的量之比为 ,则由该配合离子组成的晶体化学式还可以写为
,则由该配合离子组成的晶体化学式还可以写为_______ 。
(6)硒氧化铋是一类全新二维半导体芯片材料,为四方晶系晶胞结构(如图所示),可以看成带正电的 层与带负电的
层与带负电的 层交替堆叠。据此推断硒氧化铋的化学式为
层交替堆叠。据此推断硒氧化铋的化学式为_______ 。晶胞棱边夹角均为 ,则晶体密度的计算式为
,则晶体密度的计算式为_______  (
( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:
配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:
 的价电子中,两种自旋状态的电子数之比为
的价电子中,两种自旋状态的电子数之比为(2)均为平面结构的吡咯(
 )和吡啶(
)和吡啶( )是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较小的为
)是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较小的为(3)
 是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为
是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为 。
。 中
中 键角
键角 中
中 键角(填“大于”“小于”或“等于”)。
键角(填“大于”“小于”或“等于”)。(4)
 (
( )中
)中 比
比 中的更
中的更元素周期表中,第四周期元素单质及其化合物在化工生产和研究中有重要的应用。
(5)在浓
 的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6,组成为
的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6,组成为 的晶体,该晶体中两种配体的物质的量之比为
的晶体,该晶体中两种配体的物质的量之比为 ,则由该配合离子组成的晶体化学式还可以写为
,则由该配合离子组成的晶体化学式还可以写为(6)硒氧化铋是一类全新二维半导体芯片材料,为四方晶系晶胞结构(如图所示),可以看成带正电的
 层与带负电的
层与带负电的 层交替堆叠。据此推断硒氧化铋的化学式为
层交替堆叠。据此推断硒氧化铋的化学式为 ,则晶体密度的计算式为
,则晶体密度的计算式为 (
( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
名校
解题方法
8 . Si、S、Se在自然界中形成多种多样的物质结构。回答下列问题:
(1)Se与O同族,电负性较大的是______ ;基态Se原子的价电子运动状态有____ 种。
(2)已知液态的二氧化硫可以发生类似水的自电离: 。
。 中各原子满足8电子结构,则其
中各原子满足8电子结构,则其 键和
键和 键数目之比为
键数目之比为_______ , 的空间结构为
的空间结构为_______ 。
(3)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物 和
和 的结构如图所示,
的结构如图所示, 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为________ ,二者中更易与 形成配位键的是
形成配位键的是________ 。 熔点(>1700℃)明显高于
熔点(>1700℃)明显高于 (315℃),原因是
(315℃),原因是______ 。
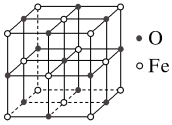
(5)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρ g·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与O2-紧邻且等距离的Fe2+数目为______ ,Fe2+与O2-最短核间距为_____ pm。
(1)Se与O同族,电负性较大的是
(2)已知液态的二氧化硫可以发生类似水的自电离:
 。
。 中各原子满足8电子结构,则其
中各原子满足8电子结构,则其 键和
键和 键数目之比为
键数目之比为 的空间结构为
的空间结构为(3)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物
 和
和 的结构如图所示,
的结构如图所示, 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为 形成配位键的是
形成配位键的是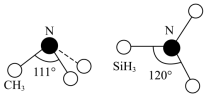
 熔点(>1700℃)明显高于
熔点(>1700℃)明显高于 (315℃),原因是
(315℃),原因是(5)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρ g·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与O2-紧邻且等距离的Fe2+数目为
您最近一年使用:0次
9 . 回答下列问题:
(1)基态 原子的核外电子排布式为
原子的核外电子排布式为___________ 。
(2)三氟化硼 是一种无色气体,用于制造火箭的高能燃料。
是一种无色气体,用于制造火箭的高能燃料。 水解生成一种“一元”含氧酸甲和另一种一元无氧酸乙,乙中B的杂化方式是
水解生成一种“一元”含氧酸甲和另一种一元无氧酸乙,乙中B的杂化方式是 ,则乙的化学式是
,则乙的化学式是___________ 。
(3)在吡啶( )、噻吩(
)、噻吩( )、呋喃(
)、呋喃( )三种杂环化合物均为共平面结构,N、S、O均有给电子共轭效应,其中O和S的给电子共轭效应均弱于N,请解释原因
)三种杂环化合物均为共平面结构,N、S、O均有给电子共轭效应,其中O和S的给电子共轭效应均弱于N,请解释原因___________ 。
(4)下列说法正确的是___________。
(5)氧化铈 常用作玻璃工业添加剂,在其立方晶胞中掺杂
常用作玻璃工业添加剂,在其立方晶胞中掺杂 占据原来
占据原来 的位置,可以得到更稳定的结构,这种稳定的结构使得氧化铈具有许多独特的性质和应用。假设
的位置,可以得到更稳定的结构,这种稳定的结构使得氧化铈具有许多独特的性质和应用。假设 晶胞边长为
晶胞边长为 。晶胞结构如下图:
。晶胞结构如下图: 晶胞中与
晶胞中与 相邻且最近的
相邻且最近的 有
有___________ 个。若掺杂 后得到
后得到 的晶体,则此晶体中
的晶体,则此晶体中 的空缺率为
的空缺率为___________ 。
(1)基态
 原子的核外电子排布式为
原子的核外电子排布式为(2)三氟化硼
 是一种无色气体,用于制造火箭的高能燃料。
是一种无色气体,用于制造火箭的高能燃料。 水解生成一种“一元”含氧酸甲和另一种一元无氧酸乙,乙中B的杂化方式是
水解生成一种“一元”含氧酸甲和另一种一元无氧酸乙,乙中B的杂化方式是 ,则乙的化学式是
,则乙的化学式是(3)在吡啶(
 )、噻吩(
)、噻吩( )、呋喃(
)、呋喃( )三种杂环化合物均为共平面结构,N、S、O均有给电子共轭效应,其中O和S的给电子共轭效应均弱于N,请解释原因
)三种杂环化合物均为共平面结构,N、S、O均有给电子共轭效应,其中O和S的给电子共轭效应均弱于N,请解释原因(4)下列说法正确的是___________。
| A.第二周期,第一电离能介于B和F之间的元素有3种 |
B. 存在顺反异构 存在顺反异构 |
C. 中N原子可通过配位键与 中N原子可通过配位键与 结合而使分子本身具有碱性,且 结合而使分子本身具有碱性,且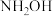 的碱性弱于 的碱性弱于 |
D. 的键角小于 的键角小于 |
(5)氧化铈
 常用作玻璃工业添加剂,在其立方晶胞中掺杂
常用作玻璃工业添加剂,在其立方晶胞中掺杂 占据原来
占据原来 的位置,可以得到更稳定的结构,这种稳定的结构使得氧化铈具有许多独特的性质和应用。假设
的位置,可以得到更稳定的结构,这种稳定的结构使得氧化铈具有许多独特的性质和应用。假设 晶胞边长为
晶胞边长为 。晶胞结构如下图:
。晶胞结构如下图:
 晶胞中与
晶胞中与 相邻且最近的
相邻且最近的 有
有 后得到
后得到 的晶体,则此晶体中
的晶体,则此晶体中 的空缺率为
的空缺率为
您最近一年使用:0次
名校
解题方法
10 . 回答下列问题。
(1)青蒿素是我国科学家从传统中药中发现的能治疗疟疾的有机化合物,其分子结构如图所示,它可以用溶剂A从中药中提取出来,得到“提取液”后,再经“一系列操作”即可分离出青蒿素,结构如下图所示。下列有关说法正确的有___________
②青蒿素的分子式为C14H20O5
③青蒿素分子中具有的官能团有酮羰基和醚键
④用溶剂A从中药中提取出青蒿素的实验操作是萃取
⑤青蒿素分子中含有7个手性碳原子
(2)化合物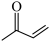 有多种同分异构体,写出满足以下条件的同分异构体结构简式
有多种同分异构体,写出满足以下条件的同分异构体结构简式 ___________ ;写出其与银氨溶液反应的方程式___________ 。
①能与银氨溶液发生反应;②核磁共振氢谱中共含有三组吸收峰。
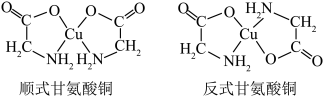
(3)甘氨酸铜有顺式和反式两种同分异构,结构如图___________ (填序号)
a.sp b.sp2 c.sp3 d.dsp2
②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜不能溶于水,原因可能是___________ 。
(4)C、H、O、N是生命元素。下列说法正确的是___________。
(1)青蒿素是我国科学家从传统中药中发现的能治疗疟疾的有机化合物,其分子结构如图所示,它可以用溶剂A从中药中提取出来,得到“提取液”后,再经“一系列操作”即可分离出青蒿素,结构如下图所示。下列有关说法正确的有
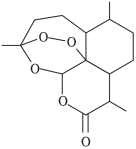
②青蒿素的分子式为C14H20O5
③青蒿素分子中具有的官能团有酮羰基和醚键
④用溶剂A从中药中提取出青蒿素的实验操作是萃取
⑤青蒿素分子中含有7个手性碳原子
(2)化合物
 有多种同分异构体,写出满足以下条件的同分异构体结构简式
有多种同分异构体,写出满足以下条件的同分异构体结构简式 ①能与银氨溶液发生反应;②核磁共振氢谱中共含有三组吸收峰。
(3)甘氨酸铜有顺式和反式两种同分异构,结构如图
a.sp b.sp2 c.sp3 d.dsp2
②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜不能溶于水,原因可能是
(4)C、H、O、N是生命元素。下列说法正确的是___________。
| A.第一电离能:O>N>C>H |
| B.电负性:O>N>C>H |
C.酸性: |
D.键角: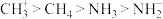 |
您最近一年使用:0次



