解题方法
1 . 第二周期非金属元素的单质及其化合物是生命活动的重要物质基础。请回答:
(1)下列说法正确的是_______。
(2)有机物转化及相应产率: ,所有有机物中碳原子的杂化方式为
,所有有机物中碳原子的杂化方式为_______ ,后者产物的产率低的原因是_______ 。
(3)当负电荷位于电负性大的原子时,结构较稳定。 结合
结合 ,通过电子转移可得到下列粒子,稳定性最弱的粒子是_______。
,通过电子转移可得到下列粒子,稳定性最弱的粒子是_______。
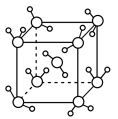
(4)某新型电池的正极材料由F、K、Ni三种元素组成,其晶胞如图所示:

①基态Ni的核外电子排布式为_______ 。
②K与F间的化学键的离子键百分率_______ Ni与F间的化学键(选填“大于”或“小于”)。
③该材料中,Ni元素的化合价为_______ 。
(1)下列说法正确的是_______。
A. 三种分子的键角逐渐减小 三种分子的键角逐渐减小 |
| B.第二周期非金属元素的最高正价逐渐升高 |
C. 最外层电子排布为 最外层电子排布为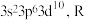 与硼元素同主族 与硼元素同主族 |
D.结合质子趋势: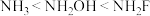 |
(2)有机物转化及相应产率:
 ,所有有机物中碳原子的杂化方式为
,所有有机物中碳原子的杂化方式为(3)当负电荷位于电负性大的原子时,结构较稳定。
 结合
结合 ,通过电子转移可得到下列粒子,稳定性最弱的粒子是_______。
,通过电子转移可得到下列粒子,稳定性最弱的粒子是_______。A. | B. | C. | D. |
(4)某新型电池的正极材料由F、K、Ni三种元素组成,其晶胞如图所示:

①基态Ni的核外电子排布式为
②K与F间的化学键的离子键百分率
③该材料中,Ni元素的化合价为
您最近一年使用:0次
解题方法
2 . 硫及其化合物在生活、生产中有着广泛的应用。
(1)基态硫原子的价层电子轨道表示式是______ 。
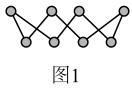
(2)S单质的常见形式为S8,其环状结构如图1所示,其中S原子的杂化方式是______ 。______ 。
(4)大π键可用符号π表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则SO3中的大π键可表示为______ 。
(5)黄铜矿为含硫矿石,这种矿石浑身都是宝。黄铜矿的晶胞如图2所示,原子1的坐标为( ,
, ,2)与Cu(0,0,0)最近的Fe原子的坐标为
,2)与Cu(0,0,0)最近的Fe原子的坐标为______ ;若阿伏加德罗常数的值为NA,则黄铜矿晶体的密度是______ g•cm-3。
(1)基态硫原子的价层电子轨道表示式是
(2)S单质的常见形式为S8,其环状结构如图1所示,其中S原子的杂化方式是
| A.H2S分子的空间构形是直线型 |
| B.六氟化硫(SF6)中心原子的杂化方式为sp3d2 |
| C.第一电离能大小顺序F>O>S |
| D.工业生产硫酸时用水吸收SO3 |
(4)大π键可用符号π表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则SO3中的大π键可表示为
(5)黄铜矿为含硫矿石,这种矿石浑身都是宝。黄铜矿的晶胞如图2所示,原子1的坐标为(
 ,
, ,2)与Cu(0,0,0)最近的Fe原子的坐标为
,2)与Cu(0,0,0)最近的Fe原子的坐标为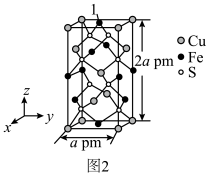
您最近一年使用:0次
解题方法
3 . 硼烷-四氢呋喃(BH3·THF,结构简式为)是一种硼氢化和还原性的试剂,易溶于四氢呋喃(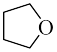 )、蚂水剧烈反应放出氢气 工业上常用于有机物中某些官能团的硼氢化和还原化。请回答下列问题:
)、蚂水剧烈反应放出氢气 工业上常用于有机物中某些官能团的硼氢化和还原化。请回答下列问题:
A.1s22s22p1 B.1s22s2 C.1s22s12p1 D.1s22p2
(2)先将NaBH4和BF3溶于二乙二醇二甲醚(CH3OCH2CH2OCH2CH2OCH3)中,充分溶解,再加入四氢呋喃,反应30 min、缘分离提纯即得较纯净的 BH3·THF,同时还有另一种产物 NaF。
①制备BH3·THF的化学方程式为
②制备过程中,BF3中B的杂化方式的变化是
③二乙二醇二甲醚在水中的溶解度大于在苯中的溶解度,其原因是
(3)硼氢化钠在室温下是α型的立方晶体(如图甲所示),6.3GPa下转变为四方晶体(如图乙所示)。

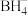 最近的
最近的 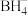 有
有 围成
围成②硼氢化钠的四方晶体中,晶胞中 A、B间距离d=
您最近一年使用:0次
名校
解题方法
4 . 配合物在化学实验中有重要的作用,可以作为催化剂、反应中间体、反应物等参与反应,从而改变反应速率和反应路径
(1)基态Ti原子的价层电子轨道表示式为_____ 。
(2)区分晶态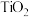 和非晶态
和非晶态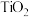 最可靠的科学方法是
最可靠的科学方法是_____ ,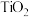 与光气
与光气 反应可用于制取四氯化钛,
反应可用于制取四氯化钛, 的空间构型为
的空间构型为_____ 。
(3)一种由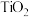 形成的一种配合物丁二酮缩邻氨基酚钛,是高性能的聚烯烃催化剂,其结构如图。
形成的一种配合物丁二酮缩邻氨基酚钛,是高性能的聚烯烃催化剂,其结构如图。_____ ,其中碳原子的杂化方式为_____ 。
②该配合物中心离子是_____ ,配位数为_____ 。
(4)已知配合物的稳定性: ,其原因是
,其原因是_____ 。
(5)一种由Mg和Fe组成的储氢材料的结构属立方晶系,晶胞参数为 ,晶胞如图所示(氢未标出)。
,晶胞如图所示(氢未标出)。 ,B点原子的分数坐标为
,B点原子的分数坐标为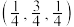 ,则C点原子的分数坐标为
,则C点原子的分数坐标为_____ 。
②该结构中,H原子以正八面体的配位模式有序分布在Fe的周围,H原子与Fe原子之间的最短距离等于晶胞参数的 ,晶胞密度为
,晶胞密度为_____  (列出计算式,设阿伏加德罗常数的值为
(列出计算式,设阿伏加德罗常数的值为 )。
)。
(1)基态Ti原子的价层电子轨道表示式为
(2)区分晶态
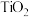 和非晶态
和非晶态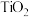 最可靠的科学方法是
最可靠的科学方法是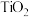 与光气
与光气 反应可用于制取四氯化钛,
反应可用于制取四氯化钛, 的空间构型为
的空间构型为(3)一种由
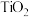 形成的一种配合物丁二酮缩邻氨基酚钛,是高性能的聚烯烃催化剂,其结构如图。
形成的一种配合物丁二酮缩邻氨基酚钛,是高性能的聚烯烃催化剂,其结构如图。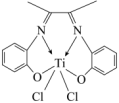
②该配合物中心离子是
(4)已知配合物的稳定性:
 ,其原因是
,其原因是(5)一种由Mg和Fe组成的储氢材料的结构属立方晶系,晶胞参数为
 ,晶胞如图所示(氢未标出)。
,晶胞如图所示(氢未标出)。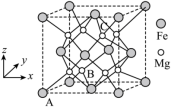
 ,B点原子的分数坐标为
,B点原子的分数坐标为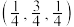 ,则C点原子的分数坐标为
,则C点原子的分数坐标为②该结构中,H原子以正八面体的配位模式有序分布在Fe的周围,H原子与Fe原子之间的最短距离等于晶胞参数的
 ,晶胞密度为
,晶胞密度为 (列出计算式,设阿伏加德罗常数的值为
(列出计算式,设阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
解题方法
5 . 第二周期元素其单质及化合物具有一些特殊的化学性质。回答下列问题。
(1)Li、Be、B三种元素第二电离能由大到小的顺序为_______ 。
(2)由于硼的氢化物与烷烃相似,故又称之为硼烷。乙硼烷( )的分子结构如图,该分子中B原子的杂化方式为
)的分子结构如图,该分子中B原子的杂化方式为_______ 。甲中化学键①为“二中心二电子键”,记作“2c-2e”,则乙硼烷的桥键②记作_______ 。氢原子仅用1s轨道就可形成桥键的原因为_______ 。_______ 。乙中由12个B与12个C构成的多面体含_______ 个棱。 溶解度(S=22g)大于
溶解度(S=22g)大于 (S=9.6g),从结构角度解释原因
(S=9.6g),从结构角度解释原因_______ 。
(1)Li、Be、B三种元素第二电离能由大到小的顺序为
(2)由于硼的氢化物与烷烃相似,故又称之为硼烷。乙硼烷(
 )的分子结构如图,该分子中B原子的杂化方式为
)的分子结构如图,该分子中B原子的杂化方式为
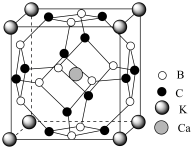
 溶解度(S=22g)大于
溶解度(S=22g)大于 (S=9.6g),从结构角度解释原因
(S=9.6g),从结构角度解释原因
您最近一年使用:0次
名校
解题方法
6 . 氮及其化合物应用广泛。回答下列问题:
(1)基态N原子处于最高能级的电子云轮廓图为________ ,能量最低的激发态N3-的核外电子排布式为_________ 。
(2)胍(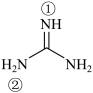 )为平面形分子,N原子的杂化轨道方式为
)为平面形分子,N原子的杂化轨道方式为___________ ,分子中的大π键可用符号Π 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π ),则胍分子中存在的大π键可表示为
),则胍分子中存在的大π键可表示为___________ 。胍属于___________ 分子(填“极性”或“非极性”),①号N原子 键角
键角___________ ②号N原子 键角(填“>”“<”或“=”),胍易吸收空气中H2O,其原因是
键角(填“>”“<”或“=”),胍易吸收空气中H2O,其原因是___________ 。
(3)最新研究发现,水能凝结成13种类型的结晶体。除普通冰外,还有-30℃才凝固的低温冰,180℃依然不变的热冰,比水密度大的重冰等。重冰的结构如图所示。则该晶体中H2O的配位数为___________ 。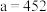 pm,
pm,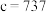 pm,
pm,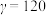 标注为1、2、3的氧原子在Z轴的分数坐标分别为:
标注为1、2、3的氧原子在Z轴的分数坐标分别为: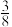 、
、 、
、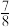 。
。___________ pm。(保留一位小数)
②普通冰晶体的密度为___________ g·cm-3(列出数学表达式,不必计算出结果)。
(1)基态N原子处于最高能级的电子云轮廓图为
(2)胍(
 )为平面形分子,N原子的杂化轨道方式为
)为平面形分子,N原子的杂化轨道方式为 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π ),则胍分子中存在的大π键可表示为
),则胍分子中存在的大π键可表示为 键角
键角 键角(填“>”“<”或“=”),胍易吸收空气中H2O,其原因是
键角(填“>”“<”或“=”),胍易吸收空气中H2O,其原因是(3)最新研究发现,水能凝结成13种类型的结晶体。除普通冰外,还有-30℃才凝固的低温冰,180℃依然不变的热冰,比水密度大的重冰等。重冰的结构如图所示。则该晶体中H2O的配位数为
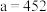 pm,
pm,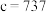 pm,
pm,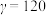 标注为1、2、3的氧原子在Z轴的分数坐标分别为:
标注为1、2、3的氧原子在Z轴的分数坐标分别为: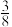 、
、 、
、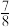 。
。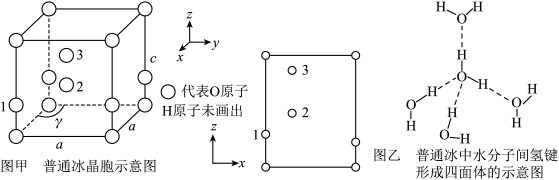
②普通冰晶体的密度为
您最近一年使用:0次
名校
解题方法
7 . 关于第ⅣA族的元素——碳(C)、硅(Si)、锗(Ge)、锡(Sn)和铅(Pb),它们可形成许多结构各异的物质。回答下列问题:
(1)基态Si原子的价电子轨道表示式为___________ ,有___________ 种不同运动状态的电子。
(2)CH3COOH中C原子的杂化类型是___________ 。
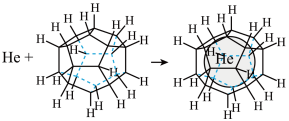
(3)1999年,科学家成功地将一个He原子“装入”了一个C20H20的空腔内,得到了“世界上最小的氦气球”(如图所示,产物记为He@ C20H20)。则He@ C20H20中,He与C20H20之间的作用力为___________ 。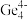 、
、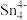 和
和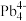 等阴离子,根据等电子体原理判断,
等阴离子,根据等电子体原理判断,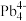 中的键角为
中的键角为___________ 。
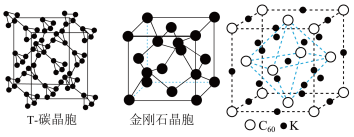
(5)科研团队通过皮秒激光照射悬浮在甲醇溶液中的多臂碳纳米管合成T-碳,T-碳的晶体结构可以看成金刚石晶体中每个碳原子被一个由四个碳原子组成的正四面体结构单元取代,T-碳的密度约为金刚石的一半,T-碳晶体的晶胞、金刚石的晶胞如图所示。则T-碳晶胞的棱长是金刚石晶胞棱长的___________ 倍。
①该材料的化学式是___________ 。
②已知晶胞边长为a=1424pm,则该超导材料的理论密度为ρ=___________ g·cm-3(写出表达式)。
(1)基态Si原子的价电子轨道表示式为
(2)CH3COOH中C原子的杂化类型是
(3)1999年,科学家成功地将一个He原子“装入”了一个C20H20的空腔内,得到了“世界上最小的氦气球”(如图所示,产物记为He@ C20H20)。则He@ C20H20中,He与C20H20之间的作用力为
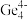 、
、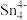 和
和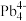 等阴离子,根据等电子体原理判断,
等阴离子,根据等电子体原理判断,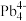 中的键角为
中的键角为(5)科研团队通过皮秒激光照射悬浮在甲醇溶液中的多臂碳纳米管合成T-碳,T-碳的晶体结构可以看成金刚石晶体中每个碳原子被一个由四个碳原子组成的正四面体结构单元取代,T-碳的密度约为金刚石的一半,T-碳晶体的晶胞、金刚石的晶胞如图所示。则T-碳晶胞的棱长是金刚石晶胞棱长的
①该材料的化学式是
②已知晶胞边长为a=1424pm,则该超导材料的理论密度为ρ=
您最近一年使用:0次
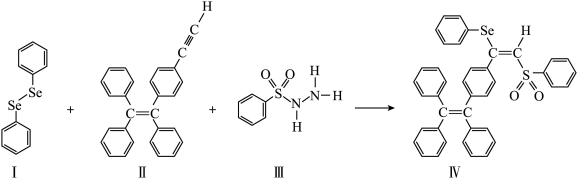
8 . 硒(Se)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(AE)效应以来,AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子Ⅳ的合成路线如下:___________ 。
(2) 的沸点低于
的沸点低于 ,其原因是
,其原因是___________ 。
(3)关于Ⅰ~Ⅲ三种反应物,下列说法正确的有___________ 。
A.Ⅰ中有σ键和π键
B.Ⅰ中的 键为极性共价键
键为极性共价键
C.Ⅱ难溶于水
D.Ⅱ中原子的杂化轨道类型只有sp与
E.Ⅲ含有的元素中,N电负性最大
(4)Ⅳ中具有孤对电子的原子有___________ 。
(5)硒的两种含氧酸的酸性强弱为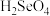
___________  (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(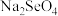 )可减轻重金属铊引起的中毒;
)可减轻重金属铊引起的中毒; 的立体构型为
的立体构型为___________ 。
(6)CdSe的一种晶体为闪锌矿型结构,晶胞结构如图所示,其中原子坐标参数A为(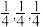 ),则C的原子坐标参数为
),则C的原子坐标参数为___________ 。
(2)
 的沸点低于
的沸点低于 ,其原因是
,其原因是(3)关于Ⅰ~Ⅲ三种反应物,下列说法正确的有
A.Ⅰ中有σ键和π键
B.Ⅰ中的
 键为极性共价键
键为极性共价键C.Ⅱ难溶于水
D.Ⅱ中原子的杂化轨道类型只有sp与

E.Ⅲ含有的元素中,N电负性最大
(4)Ⅳ中具有孤对电子的原子有
(5)硒的两种含氧酸的酸性强弱为
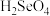
 (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(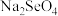 )可减轻重金属铊引起的中毒;
)可减轻重金属铊引起的中毒; 的立体构型为
的立体构型为(6)CdSe的一种晶体为闪锌矿型结构,晶胞结构如图所示,其中原子坐标参数A为(
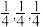 ),则C的原子坐标参数为
),则C的原子坐标参数为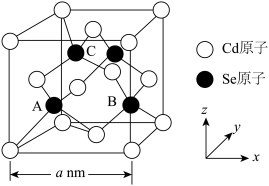
您最近一年使用:0次
名校
解题方法
9 . 铁元素在人体健康和新材料研发中有重要的应用。
I.在血液中,以 为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送
为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送 ,下图为载氧后的血红蛋白分子示意图:
,下图为载氧后的血红蛋白分子示意图:_________ 。
(2)载氧时,血红蛋白分子中 脱去配位的
脱去配位的 并与
并与 配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与
配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与 配位能力最强的是
配位能力最强的是_________ (填字母)。
a. b.
b. c.CO
c.CO
(3)一种最简单的卟啉环结构如图:_________ 。
②比较C和N的电负性大小,并从原子结构角度说明理由:_________ 。
③该卟啉分子在酸性环境中配位能力会减弱,原因是_________ 。
Ⅱ. 可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。
可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。
。
(4)该晶体的密度是_________  。
。
(5)距离F最近的Cs的个数为_________ 。
I.在血液中,以
 为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送
为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送 ,下图为载氧后的血红蛋白分子示意图:
,下图为载氧后的血红蛋白分子示意图: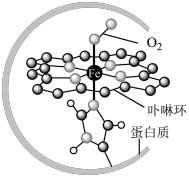
(2)载氧时,血红蛋白分子中
 脱去配位的
脱去配位的 并与
并与 配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与
配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与 配位能力最强的是
配位能力最强的是a.
 b.
b. c.CO
c.CO (3)一种最简单的卟啉环结构如图:
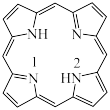
②比较C和N的电负性大小,并从原子结构角度说明理由:
③该卟啉分子在酸性环境中配位能力会减弱,原因是
Ⅱ.
 可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。
可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。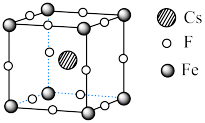
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。
。(4)该晶体的密度是
 。
。(5)距离F最近的Cs的个数为
您最近一年使用:0次
2024-05-27更新
|
279次组卷
|
2卷引用:北京市海淀区2023-2024学年高三下学期期末练习(二模)化学试题
名校
解题方法
10 . 回答下列问题。
(1)图1所示的几种碳单质, 属于
属于________ 晶体,石墨中存在的作用力有________ 。金刚石和石墨中碳碳键键长较大的是________ ,理由:________ 。
钴酞菁分子中,钴离子的化合价为________ ,氮原子提供孤对电子与钴离子形成________ 键。 是共价分子,可以单体、二聚体和多聚体形式存在。其中单体和多聚体的结构简式分别如下:Cl—Be—Cl、
是共价分子,可以单体、二聚体和多聚体形式存在。其中单体和多聚体的结构简式分别如下:Cl—Be—Cl、
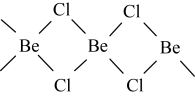
写出二聚体的结构简式________ ,并判断其中Be的杂化轨道类型________ 。
(4)一定条件下, 、K和
、K和 反应生成KCl和化合物X。已知X属于四方晶系,晶胞结构如图3所示(晶胞参数
反应生成KCl和化合物X。已知X属于四方晶系,晶胞结构如图3所示(晶胞参数 ,
, ),其中Cu化合价为+2。若阿伏加德罗常数的值为
),其中Cu化合价为+2。若阿伏加德罗常数的值为 ,化合物X的密度ρ=
,化合物X的密度ρ=________  。(用含
。(用含 的代数式表示,相对原子质量:F19 K39 Cu64)
的代数式表示,相对原子质量:F19 K39 Cu64)
(1)图1所示的几种碳单质,
 属于
属于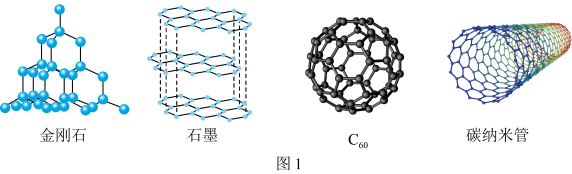
钴酞菁分子中,钴离子的化合价为

 是共价分子,可以单体、二聚体和多聚体形式存在。其中单体和多聚体的结构简式分别如下:Cl—Be—Cl、
是共价分子,可以单体、二聚体和多聚体形式存在。其中单体和多聚体的结构简式分别如下:Cl—Be—Cl、
写出二聚体的结构简式
(4)一定条件下,
 、K和
、K和 反应生成KCl和化合物X。已知X属于四方晶系,晶胞结构如图3所示(晶胞参数
反应生成KCl和化合物X。已知X属于四方晶系,晶胞结构如图3所示(晶胞参数 ,
, ),其中Cu化合价为+2。若阿伏加德罗常数的值为
),其中Cu化合价为+2。若阿伏加德罗常数的值为 ,化合物X的密度ρ=
,化合物X的密度ρ= 。(用含
。(用含 的代数式表示,相对原子质量:F19 K39 Cu64)
的代数式表示,相对原子质量:F19 K39 Cu64)
您最近一年使用:0次



