解题方法
1 . 第二周期非金属元素的单质及其化合物是生命活动的重要物质基础。请回答:
(1)下列说法正确的是_______。
(2)有机物转化及相应产率: ,所有有机物中碳原子的杂化方式为
,所有有机物中碳原子的杂化方式为_______ ,后者产物的产率低的原因是_______ 。
(3)当负电荷位于电负性大的原子时,结构较稳定。 结合
结合 ,通过电子转移可得到下列粒子,稳定性最弱的粒子是_______。
,通过电子转移可得到下列粒子,稳定性最弱的粒子是_______。
(4)某新型电池的正极材料由F、K、Ni三种元素组成,其晶胞如图所示:

①基态Ni的核外电子排布式为_______ 。
②K与F间的化学键的离子键百分率_______ Ni与F间的化学键(选填“大于”或“小于”)。
③该材料中,Ni元素的化合价为_______ 。
(1)下列说法正确的是_______。
A. 三种分子的键角逐渐减小 三种分子的键角逐渐减小 |
| B.第二周期非金属元素的最高正价逐渐升高 |
C. 最外层电子排布为 最外层电子排布为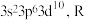 与硼元素同主族 与硼元素同主族 |
D.结合质子趋势: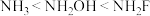 |
(2)有机物转化及相应产率:
 ,所有有机物中碳原子的杂化方式为
,所有有机物中碳原子的杂化方式为(3)当负电荷位于电负性大的原子时,结构较稳定。
 结合
结合 ,通过电子转移可得到下列粒子,稳定性最弱的粒子是_______。
,通过电子转移可得到下列粒子,稳定性最弱的粒子是_______。A. | B. | C. | D. |
(4)某新型电池的正极材料由F、K、Ni三种元素组成,其晶胞如图所示:

①基态Ni的核外电子排布式为
②K与F间的化学键的离子键百分率
③该材料中,Ni元素的化合价为
您最近一年使用:0次
解题方法
2 . ⅤA族元素有的是金属元素,有的是非金属元素,应用非常广泛。回答下列问题:
(1)基态P原子的价层电子排布式为_______ 。
(2)氮原子与碳原子形成六元环状结构,再通过相互连接形成层状“类石墨”晶体结构,有良好的光催化性能。如图是这种石墨相共价化合物的单层结构。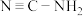 )为原料在不断加热条件下制得,其中双氰胺和三聚氰胺分别是加热至203℃和234℃时得到的中间产物,三聚氰胺的分子式为
)为原料在不断加热条件下制得,其中双氰胺和三聚氰胺分别是加热至203℃和234℃时得到的中间产物,三聚氰胺的分子式为_______ 。
②这种化合物中的氮原子与碳原子杂化方式是______ ,结构图空框中是晶体的末尾含氢 官能团,该官能团的结构简式为_______ 。
③下列有关这种化合物说法不正确 的是______ 。
A.两种结构相似的完美共价晶体熔点:氮化碳<氮化硅
B.激发态 原子可能的电子排布式为:
原子可能的电子排布式为: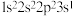
C.这种化合物每个六元环含有2个碳原子和2个氮原子
D.已知苯胺的碱性比氨弱,所以氨基氰的碱性也比氨弱
(3)立方氮化硼(CBN)晶体的极端条件性能稳定,是理想的第三代半导体材料,其结构如图所示。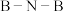 的键角为
的键角为______ 。
② 原子分数坐标为
原子分数坐标为 ,则原子
,则原子 的坐标为
的坐标为______ 。
(1)基态P原子的价层电子排布式为
(2)氮原子与碳原子形成六元环状结构,再通过相互连接形成层状“类石墨”晶体结构,有良好的光催化性能。如图是这种石墨相共价化合物的单层结构。

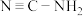 )为原料在不断加热条件下制得,其中双氰胺和三聚氰胺分别是加热至203℃和234℃时得到的中间产物,三聚氰胺的分子式为
)为原料在不断加热条件下制得,其中双氰胺和三聚氰胺分别是加热至203℃和234℃时得到的中间产物,三聚氰胺的分子式为②这种化合物中的氮原子与碳原子杂化方式是
③下列有关这种化合物说法
A.两种结构相似的完美共价晶体熔点:氮化碳<氮化硅
B.激发态
 原子可能的电子排布式为:
原子可能的电子排布式为: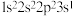
C.这种化合物每个六元环含有2个碳原子和2个氮原子
D.已知苯胺的碱性比氨弱,所以氨基氰的碱性也比氨弱
(3)立方氮化硼(CBN)晶体的极端条件性能稳定,是理想的第三代半导体材料,其结构如图所示。

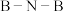 的键角为
的键角为②
 原子分数坐标为
原子分数坐标为 ,则原子
,则原子 的坐标为
的坐标为
您最近一年使用:0次
3 .  是一种钠离子电池正极材料,充、放电过程中正极材料立方晶胞示意图的组成变化如图所示,晶胞内未标出因放电产生的0价
是一种钠离子电池正极材料,充、放电过程中正极材料立方晶胞示意图的组成变化如图所示,晶胞内未标出因放电产生的0价 。
。 呈黄色,
呈黄色, 呈绿色,
呈绿色, 呈蓝色等;预测
呈蓝色等;预测 呈
呈_______ 色,原因是_______ 。
(2) 可以形成多种配合物,其中的甘氨酸铜对于预防和治疗贫血、骨质疏松等疾病具有一定的作用,它有顺式和反式两种同分异构体,结构如图。
可以形成多种配合物,其中的甘氨酸铜对于预防和治疗贫血、骨质疏松等疾病具有一定的作用,它有顺式和反式两种同分异构体,结构如图。_______ (填“ ”或“
”或“ ”)。
”)。
(3)充电时,每个 晶胞完全转化为
晶胞完全转化为 晶胞。每个
晶胞。每个 晶胞中
晶胞中 个数为
个数为_______ (用含 的代数式作答)。当
的代数式作答)。当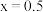 时,
时,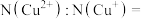
_______ 。 晶胞中互不相邻的
晶胞中互不相邻的 围成的空间结构是
围成的空间结构是_______ 。
(4) 可以与稀硫酸反应生成
可以与稀硫酸反应生成 ,比较
,比较 和
和 键角的大小:
键角的大小: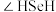
_______ (填“>”或“<”)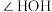 ,说明原因:
,说明原因:_______ 。
(5)立方 晶胞的晶胞参数为
晶胞的晶胞参数为 ,该晶胞的密度为
,该晶胞的密度为_______  (用
(用 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
 是一种钠离子电池正极材料,充、放电过程中正极材料立方晶胞示意图的组成变化如图所示,晶胞内未标出因放电产生的0价
是一种钠离子电池正极材料,充、放电过程中正极材料立方晶胞示意图的组成变化如图所示,晶胞内未标出因放电产生的0价 。
。
 呈黄色,
呈黄色, 呈绿色,
呈绿色, 呈蓝色等;预测
呈蓝色等;预测 呈
呈(2)
 可以形成多种配合物,其中的甘氨酸铜对于预防和治疗贫血、骨质疏松等疾病具有一定的作用,它有顺式和反式两种同分异构体,结构如图。
可以形成多种配合物,其中的甘氨酸铜对于预防和治疗贫血、骨质疏松等疾病具有一定的作用,它有顺式和反式两种同分异构体,结构如图。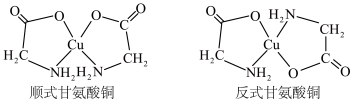
 ”或“
”或“ ”)。
”)。(3)充电时,每个
 晶胞完全转化为
晶胞完全转化为 晶胞。每个
晶胞。每个 晶胞中
晶胞中 个数为
个数为 的代数式作答)。当
的代数式作答)。当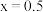 时,
时,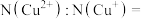
 晶胞中互不相邻的
晶胞中互不相邻的 围成的空间结构是
围成的空间结构是(4)
 可以与稀硫酸反应生成
可以与稀硫酸反应生成 ,比较
,比较 和
和 键角的大小:
键角的大小: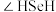
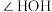 ,说明原因:
,说明原因:(5)立方
 晶胞的晶胞参数为
晶胞的晶胞参数为 ,该晶胞的密度为
,该晶胞的密度为 (用
(用 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
您最近一年使用:0次
4 . 中国幅员辽阔,有丰富的金、银、铜、铅等矿产资源。根据所学知识回答下列问题:
(1)已知金的价电子排布式为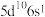 ,则其位于元素周期表
,则其位于元素周期表___________ 区。
(2)某种配合物结构如图(H原子未给出)。___________ (填元素符号)。
②该配合物中N、O、S三种元素的第一电离能由大到小的顺序为___________ 。
③该配合物中键角∠O—S—O___________ (填“>”“<”或“=”)∠C—N—C。
(3)铜及其化合物常用作催化剂,如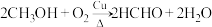 。
。
① 分子中O原子的杂化轨道类型为
分子中O原子的杂化轨道类型为___________ 。
② 易溶于水,原因是
易溶于水,原因是___________ 、___________ 。
③ 的立体构型为
的立体构型为___________ ,其分子中含有的 键与
键与 键数目之比为
键数目之比为___________ 。
(4)Pb、S形成的某种晶体结构示意图如图,设晶胞参数为a pm, 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。___________ 。
②该晶体的密度为___________  。
。
(1)已知金的价电子排布式为
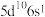 ,则其位于元素周期表
,则其位于元素周期表(2)某种配合物结构如图(H原子未给出)。
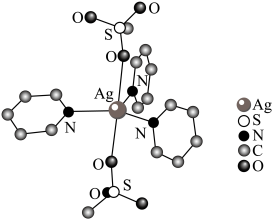
②该配合物中N、O、S三种元素的第一电离能由大到小的顺序为
③该配合物中键角∠O—S—O
(3)铜及其化合物常用作催化剂,如
 。
。①
 分子中O原子的杂化轨道类型为
分子中O原子的杂化轨道类型为②
 易溶于水,原因是
易溶于水,原因是③
 的立体构型为
的立体构型为 键与
键与 键数目之比为
键数目之比为(4)Pb、S形成的某种晶体结构示意图如图,设晶胞参数为a pm,
 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。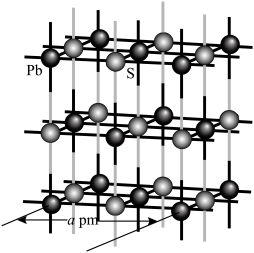
②该晶体的密度为
 。
。
您最近一年使用:0次
解题方法
5 . H、C、N、F、Cl、Ba等是几种重要的元素,Ba的一种氢化物是一种重要的储氢晶体。回答下列问题:
(1)处于基态的F和N原子,下列参数前者小于后者的是________ (填字母)。
A.最外层电子数 B.未成对电子数 C.第一电离能 D.原子半径 E.电负性
(2)咪唑(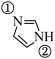 )具有类似苯环的芳香性,①号N比②号N更易与某些金属离子(如
)具有类似苯环的芳香性,①号N比②号N更易与某些金属离子(如 )形成配位键的原因:
)形成配位键的原因:________ 。
(3) 、
、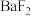 两种物质中熔点较高的是
两种物质中熔点较高的是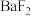 ,其原因是
,其原因是________ 。
(4)三氯乙腈 和过量
和过量 反应可得到一种高能物质M,其结构如图,则
反应可得到一种高能物质M,其结构如图,则 分子中
分子中 键与
键与 键的数目比为
键的数目比为________ , 的空间构型为
的空间构型为________ ,M中N原子杂化方式为________ 。 与
与 形成的氢化物储氢(用H表示)后的晶胞如图:
形成的氢化物储氢(用H表示)后的晶胞如图:________ (填“H”或“ ”)。
”)。
②原子分数坐标为 ,
, ,
, ,d原子的坐标为
,d原子的坐标为________ 。
③根据上图所示,储氢后该晶体的密度为________  。
。
(1)处于基态的F和N原子,下列参数前者小于后者的是
A.最外层电子数 B.未成对电子数 C.第一电离能 D.原子半径 E.电负性
(2)咪唑(
 )具有类似苯环的芳香性,①号N比②号N更易与某些金属离子(如
)具有类似苯环的芳香性,①号N比②号N更易与某些金属离子(如 )形成配位键的原因:
)形成配位键的原因:(3)
 、
、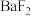 两种物质中熔点较高的是
两种物质中熔点较高的是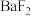 ,其原因是
,其原因是(4)三氯乙腈
 和过量
和过量 反应可得到一种高能物质M,其结构如图,则
反应可得到一种高能物质M,其结构如图,则 分子中
分子中 键与
键与 键的数目比为
键的数目比为 的空间构型为
的空间构型为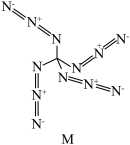
 与
与 形成的氢化物储氢(用H表示)后的晶胞如图:
形成的氢化物储氢(用H表示)后的晶胞如图:
 ”)。
”)。②原子分数坐标为
 ,
, ,
, ,d原子的坐标为
,d原子的坐标为③根据上图所示,储氢后该晶体的密度为
 。
。
您最近一年使用:0次
名校
6 . 钙及其化合物在生产生活中有着重要的作用。
(1)Ca与Fe属于同一周期元素,且核外最外层电子构型相闰,但Ca的熔、沸点都比Fe低,原因是:________ 。
(2) 与水反应生成的
与水反应生成的 分子中,碳原子杂化轨道类型是
分子中,碳原子杂化轨道类型是________ ,且 中
中 与
与 互为等电子体,
互为等电子体, 中含有的
中含有的 键数目为
键数目为________ 。
(3) 的结构如图甲所示,其中B离子表示
的结构如图甲所示,其中B离子表示________ ,晶体中与 最近且等距离的
最近且等距离的 数目为
数目为________ 。 中燃烧时,得到一种氧化物晶体,其结构如图乙所示,由此可判断该氧化物中阴、阳离子数目之比为
中燃烧时,得到一种氧化物晶体,其结构如图乙所示,由此可判断该氧化物中阴、阳离子数目之比为________ ,已知该氧化物的密度是 ,则晶胞内最近的两个
,则晶胞内最近的两个 间的距离为
间的距离为________ cm(写出计算式即可)。
(1)Ca与Fe属于同一周期元素,且核外最外层电子构型相闰,但Ca的熔、沸点都比Fe低,原因是:
(2)
 与水反应生成的
与水反应生成的 分子中,碳原子杂化轨道类型是
分子中,碳原子杂化轨道类型是 中
中 与
与 互为等电子体,
互为等电子体, 中含有的
中含有的 键数目为
键数目为(3)
 的结构如图甲所示,其中B离子表示
的结构如图甲所示,其中B离子表示 最近且等距离的
最近且等距离的 数目为
数目为
 中燃烧时,得到一种氧化物晶体,其结构如图乙所示,由此可判断该氧化物中阴、阳离子数目之比为
中燃烧时,得到一种氧化物晶体,其结构如图乙所示,由此可判断该氧化物中阴、阳离子数目之比为 ,则晶胞内最近的两个
,则晶胞内最近的两个 间的距离为
间的距离为
您最近一年使用:0次
7 . 铜基催化剂(包括铜、氧化物、铜合金、单原子和复合材料)因其效率高、成本低和对生态友好而受到重视。
(1)基态铜原子的核外电子有______ 种不同的空间运动状态;第二周期元素中,第一电离能比 大的有
大的有______ 种。
(2)研究发现,以掺有镁的铜纳米合金电还原催化 制
制 有较高的选择性,与氮气相比,
有较高的选择性,与氮气相比, 的键能较低
的键能较低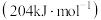 使其成为
使其成为 合成的理想来源。
合成的理想来源。
① 的中心原子的杂化类型为
的中心原子的杂化类型为______ 。
②将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。
______ (填“属于”或“不属于”)顺磁性物质, 中
中 键角
键角______ (填“>”或“<”) 中
中 键角。
键角。
(3)铜基单原子催化剂能将 转化为
转化为 。
。
①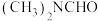 分子中含有
分子中含有______ 个 键。
键。
②沸点: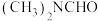
______  (填“>”或“<”)。
(填“>”或“<”)。
(4)一种镁铜合金的晶胞结构如图所示,晶胞参数为 ,该晶胞可看成由8个小立方体构成,其中4个小立方体的体心填入
,该晶胞可看成由8个小立方体构成,其中4个小立方体的体心填入 ,另外4个小立方体的体心填入以四面体方式排列的
,另外4个小立方体的体心填入以四面体方式排列的 ,其余
,其余 占据晶胞的顶点和面心。
占据晶胞的顶点和面心。 与
与 的最短距离为
的最短距离为______  (用含
(用含 的代数式表示);若阿伏加德罗常数的值为
的代数式表示);若阿伏加德罗常数的值为 ,该合金晶体的密度为
,该合金晶体的密度为______  (列出含
(列出含 ,
, 的计算式)。
的计算式)。
(1)基态铜原子的核外电子有
 大的有
大的有(2)研究发现,以掺有镁的铜纳米合金电还原催化
 制
制 有较高的选择性,与氮气相比,
有较高的选择性,与氮气相比, 的键能较低
的键能较低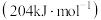 使其成为
使其成为 合成的理想来源。
合成的理想来源。①
 的中心原子的杂化类型为
的中心原子的杂化类型为②将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。

 中
中 键角
键角 中
中 键角。
键角。(3)铜基单原子催化剂能将
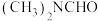 转化为
转化为 。
。①
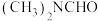 分子中含有
分子中含有 键。
键。②沸点:
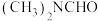
 (填“>”或“<”)。
(填“>”或“<”)。(4)一种镁铜合金的晶胞结构如图所示,晶胞参数为
 ,该晶胞可看成由8个小立方体构成,其中4个小立方体的体心填入
,该晶胞可看成由8个小立方体构成,其中4个小立方体的体心填入 ,另外4个小立方体的体心填入以四面体方式排列的
,另外4个小立方体的体心填入以四面体方式排列的 ,其余
,其余 占据晶胞的顶点和面心。
占据晶胞的顶点和面心。
 与
与 的最短距离为
的最短距离为 (用含
(用含 的代数式表示);若阿伏加德罗常数的值为
的代数式表示);若阿伏加德罗常数的值为 ,该合金晶体的密度为
,该合金晶体的密度为 (列出含
(列出含 ,
, 的计算式)。
的计算式)。
您最近一年使用:0次
解题方法
8 . 硫及其化合物在生活、生产中有着广泛的应用。
(1)基态硫原子的价层电子轨道表示式是______ 。
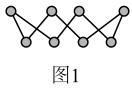
(2)S单质的常见形式为S8,其环状结构如图1所示,其中S原子的杂化方式是______ 。______ 。
(4)大π键可用符号π表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则SO3中的大π键可表示为______ 。
(5)黄铜矿为含硫矿石,这种矿石浑身都是宝。黄铜矿的晶胞如图2所示,原子1的坐标为( ,
, ,2)与Cu(0,0,0)最近的Fe原子的坐标为
,2)与Cu(0,0,0)最近的Fe原子的坐标为______ ;若阿伏加德罗常数的值为NA,则黄铜矿晶体的密度是______ g•cm-3。
(1)基态硫原子的价层电子轨道表示式是
(2)S单质的常见形式为S8,其环状结构如图1所示,其中S原子的杂化方式是
| A.H2S分子的空间构形是直线型 |
| B.六氟化硫(SF6)中心原子的杂化方式为sp3d2 |
| C.第一电离能大小顺序F>O>S |
| D.工业生产硫酸时用水吸收SO3 |
(4)大π键可用符号π表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则SO3中的大π键可表示为
(5)黄铜矿为含硫矿石,这种矿石浑身都是宝。黄铜矿的晶胞如图2所示,原子1的坐标为(
 ,
, ,2)与Cu(0,0,0)最近的Fe原子的坐标为
,2)与Cu(0,0,0)最近的Fe原子的坐标为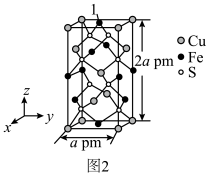
您最近一年使用:0次
9 . 回答下列问题:
(1)基态 原子的核外电子排布式为
原子的核外电子排布式为___________ 。
(2)三氟化硼 是一种无色气体,用于制造火箭的高能燃料。
是一种无色气体,用于制造火箭的高能燃料。 水解生成一种“一元”含氧酸甲和另一种一元无氧酸乙,乙中B的杂化方式是
水解生成一种“一元”含氧酸甲和另一种一元无氧酸乙,乙中B的杂化方式是 ,则乙的化学式是
,则乙的化学式是___________ 。
(3)在吡啶( )、噻吩(
)、噻吩( )、呋喃(
)、呋喃( )三种杂环化合物均为共平面结构,N、S、O均有给电子共轭效应,其中O和S的给电子共轭效应均弱于N,请解释原因
)三种杂环化合物均为共平面结构,N、S、O均有给电子共轭效应,其中O和S的给电子共轭效应均弱于N,请解释原因___________ 。
(4)下列说法正确的是___________。
(5)氧化铈 常用作玻璃工业添加剂,在其立方晶胞中掺杂
常用作玻璃工业添加剂,在其立方晶胞中掺杂 占据原来
占据原来 的位置,可以得到更稳定的结构,这种稳定的结构使得氧化铈具有许多独特的性质和应用。假设
的位置,可以得到更稳定的结构,这种稳定的结构使得氧化铈具有许多独特的性质和应用。假设 晶胞边长为
晶胞边长为 。晶胞结构如下图:
。晶胞结构如下图: 晶胞中与
晶胞中与 相邻且最近的
相邻且最近的 有
有___________ 个。若掺杂 后得到
后得到 的晶体,则此晶体中
的晶体,则此晶体中 的空缺率为
的空缺率为___________ 。
(1)基态
 原子的核外电子排布式为
原子的核外电子排布式为(2)三氟化硼
 是一种无色气体,用于制造火箭的高能燃料。
是一种无色气体,用于制造火箭的高能燃料。 水解生成一种“一元”含氧酸甲和另一种一元无氧酸乙,乙中B的杂化方式是
水解生成一种“一元”含氧酸甲和另一种一元无氧酸乙,乙中B的杂化方式是 ,则乙的化学式是
,则乙的化学式是(3)在吡啶(
 )、噻吩(
)、噻吩( )、呋喃(
)、呋喃( )三种杂环化合物均为共平面结构,N、S、O均有给电子共轭效应,其中O和S的给电子共轭效应均弱于N,请解释原因
)三种杂环化合物均为共平面结构,N、S、O均有给电子共轭效应,其中O和S的给电子共轭效应均弱于N,请解释原因(4)下列说法正确的是___________。
| A.第二周期,第一电离能介于B和F之间的元素有3种 |
B.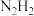 存在顺反异构 存在顺反异构 |
C.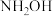 中N原子可通过配位键与 中N原子可通过配位键与 结合而使分子本身具有碱性,且 结合而使分子本身具有碱性,且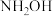 的碱性弱于 的碱性弱于 |
D. 的键角小于 的键角小于 |
(5)氧化铈
 常用作玻璃工业添加剂,在其立方晶胞中掺杂
常用作玻璃工业添加剂,在其立方晶胞中掺杂 占据原来
占据原来 的位置,可以得到更稳定的结构,这种稳定的结构使得氧化铈具有许多独特的性质和应用。假设
的位置,可以得到更稳定的结构,这种稳定的结构使得氧化铈具有许多独特的性质和应用。假设 晶胞边长为
晶胞边长为 。晶胞结构如下图:
。晶胞结构如下图:
 晶胞中与
晶胞中与 相邻且最近的
相邻且最近的 有
有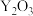 后得到
后得到 的晶体,则此晶体中
的晶体,则此晶体中 的空缺率为
的空缺率为
您最近一年使用:0次
解题方法
10 . 烯烃的加氢甲酰化反应是醛合成中重要的均相催化工业反应之一。我国科学家利用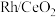 催化剂实现烯烃甲酰化。回答下列问题:
催化剂实现烯烃甲酰化。回答下列问题: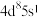 ,位于周期表第五周期第
,位于周期表第五周期第_____ 族,位于_____ 区。
(2)基态O原子核外电子有_____ 种不同的空间运动状态。
(3)乙中C原子的杂化类型是_____ 。
(4)丙分子中所含元素电负性由大到小顺序为_____ 。丙分子有_____ 个手性碳原子。
(5)已知: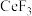 、
、 的熔点分别为1640℃、650℃,其熔点差异很大的主要原因是
的熔点分别为1640℃、650℃,其熔点差异很大的主要原因是_____ 。
(6) 的立方晶胞结构如图所示。已知
的立方晶胞结构如图所示。已知 为阿伏加德罗常数的值,晶胞参数为
为阿伏加德罗常数的值,晶胞参数为 。
。_____ 。该晶体密度为_____  。
。
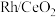 催化剂实现烯烃甲酰化。回答下列问题:
催化剂实现烯烃甲酰化。回答下列问题: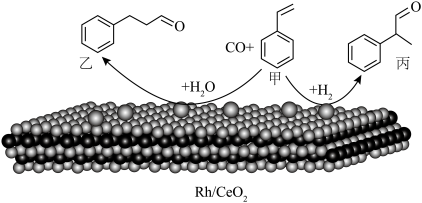
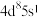 ,位于周期表第五周期第
,位于周期表第五周期第(2)基态O原子核外电子有
(3)乙中C原子的杂化类型是
(4)丙分子中所含元素电负性由大到小顺序为
(5)已知:
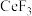 、
、 的熔点分别为1640℃、650℃,其熔点差异很大的主要原因是
的熔点分别为1640℃、650℃,其熔点差异很大的主要原因是(6)
 的立方晶胞结构如图所示。已知
的立方晶胞结构如图所示。已知 为阿伏加德罗常数的值,晶胞参数为
为阿伏加德罗常数的值,晶胞参数为 。
。
 。
。
您最近一年使用:0次



