解题方法
1 . 2023年化学诺贝尔奖授予了三位研究量子点的科学家。量子点又称“人造原子”、“超原子”,是一种纳米级的半导体材料,在医疗,科技等多个领域有广泛的应用。
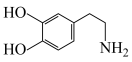
(1)聚多巴胺量子点具有广泛的光学吸收和荧光特性,可直接用于体内成像。多巴胺结构如下图所示。___________ ,其最高能层上有___________ 种运动状态不同的电子。
②多巴胺分子中碳原子的杂化方式为___________ ,1mol多巴胺中含有 键的数目为
键的数目为___________ 。
③多巴胺易溶于水,原因是___________ 。
(2)聚多巴胺量子点还可以通过吸附金属离子如 ,
, ,
, 等用于核磁共振成像(MRI)。
等用于核磁共振成像(MRI)。
① 中含有
中含有 ,其阴离子空间构型为
,其阴离子空间构型为___________ 。
②Mn的第三电离能大于Fe的第三电离能,原因是___________ 。
(3)CdS量子点是一种常见的量子点。某种CdS晶体的立方晶胞如下图所示。 的配位数为
的配位数为___________ 。
②若CdS晶体的密度为 ,则晶胞中
,则晶胞中 和
和 间的最短距离为
间的最短距离为___________ pm(列出计算式即可)。
(1)聚多巴胺量子点具有广泛的光学吸收和荧光特性,可直接用于体内成像。多巴胺结构如下图所示。
②多巴胺分子中碳原子的杂化方式为
 键的数目为
键的数目为③多巴胺易溶于水,原因是
(2)聚多巴胺量子点还可以通过吸附金属离子如
 ,
, ,
, 等用于核磁共振成像(MRI)。
等用于核磁共振成像(MRI)。①
 中含有
中含有 ,其阴离子空间构型为
,其阴离子空间构型为②Mn的第三电离能大于Fe的第三电离能,原因是
(3)CdS量子点是一种常见的量子点。某种CdS晶体的立方晶胞如下图所示。

 的配位数为
的配位数为②若CdS晶体的密度为
 ,则晶胞中
,则晶胞中 和
和 间的最短距离为
间的最短距离为
您最近一年使用:0次
名校
2 . 硫及其化合物有许多用途,古代用高温煅烧绿矾和胆矾的方法来制备硫酸。请回答:
(1)① 的价层电子排布式为
的价层电子排布式为______ 。
②基态硫原子有______ 种空间运动状态。
(2)煅烧胆矾可得三氧化硫,液态三氧化硫有单分子: 和三聚体
和三聚体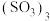 两种形式,固态三氧化硫易升华,易溶于水,主要以三聚体和无限长链
两种形式,固态三氧化硫易升华,易溶于水,主要以三聚体和无限长链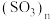 两种形式存在。下列说法不正确的是______。
两种形式存在。下列说法不正确的是______。
(3) 结构为
结构为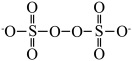 ,
, 比
比 的氧化性更强,其原因是
的氧化性更强,其原因是______ 。
(4)S与A、B两种金属形成的晶胞如图所示,B的配位数为______ ,该化合物的化学式为______ ,其摩尔质量为Mg/mol,阿伏加德罗常数为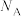 ,晶胞参数为:x=0.052,y=0.103,该晶体的密度ρ=
,晶胞参数为:x=0.052,y=0.103,该晶体的密度ρ=______  (列出计算式即可)。
(列出计算式即可)。
(1)①
 的价层电子排布式为
的价层电子排布式为②基态硫原子有
(2)煅烧胆矾可得三氧化硫,液态三氧化硫有单分子:
 和三聚体
和三聚体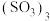 两种形式,固态三氧化硫易升华,易溶于水,主要以三聚体和无限长链
两种形式,固态三氧化硫易升华,易溶于水,主要以三聚体和无限长链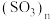 两种形式存在。下列说法不正确的是______。
两种形式存在。下列说法不正确的是______。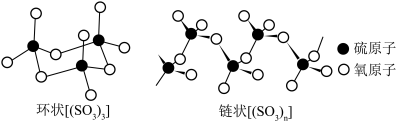
A. 中心原子为 中心原子为 杂化,空间结构为平面三角形 杂化,空间结构为平面三角形 |
B.环状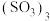 中硫原子的杂化轨道类型为 中硫原子的杂化轨道类型为 |
C.单分子 和链状 和链状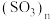 均是分子晶体 均是分子晶体 |
D.链状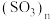 中 中 杂化的氧为3n个 杂化的氧为3n个 |
(3)
 结构为
结构为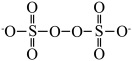 ,
, 比
比 的氧化性更强,其原因是
的氧化性更强,其原因是(4)S与A、B两种金属形成的晶胞如图所示,B的配位数为
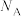 ,晶胞参数为:x=0.052,y=0.103,该晶体的密度ρ=
,晶胞参数为:x=0.052,y=0.103,该晶体的密度ρ= (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
3 . 环戊二烯 分子可与金属Na反应形成盐
分子可与金属Na反应形成盐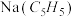 ,该盐与
,该盐与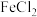 反应生成最著名的夹心化合物——二茂铁
反应生成最著名的夹心化合物——二茂铁 。回答下列问题:
。回答下列问题:
(2)第一电离能
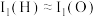 ,从原子结构角度解释
,从原子结构角度解释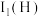
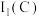 (填“>”或“<”)。
(填“>”或“<”)。(3)已知阴离子
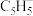 中所有原子共平面,则其中C原子的杂化轨道类型是
中所有原子共平面,则其中C原子的杂化轨道类型是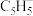 离子配体与1个
离子配体与1个 离子形成的配合物,已知中心离子价电子数与配体提供电子总数之和为18,则每个配体提供
离子形成的配合物,已知中心离子价电子数与配体提供电子总数之和为18,则每个配体提供(4)相比于吡咯(
 ),环戊二烯在水中溶解度远小于吡咯,可能原因是
),环戊二烯在水中溶解度远小于吡咯,可能原因是(5)二茂铁熔点173℃,100℃以上升华,沸点249℃,由此判断二茂铁的晶体类型为
(6)二茂铁隔绝空气受热分解为一种化学式为
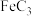 的铁碳合金,其立方晶胞结构如图所示。分析C原子旁最近的Fe原子有
的铁碳合金,其立方晶胞结构如图所示。分析C原子旁最近的Fe原子有
 (列出计算式,设阿伏加德罗常数的值为
(列出计算式,设阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
4 . 铁及其化合物在生产生活中应用广泛。回答下列问题:
(1)基态Fe原子的价电子排布式是___________ 。
(2) 溶液与KSCN溶液混合,溶液呈红色,常用于检验
溶液与KSCN溶液混合,溶液呈红色,常用于检验 。
。
①基态K、S、N原子第一电离能大小顺序是___________ , 的空间构型是
的空间构型是___________ 。
②从结构角度分析 易被氧化成
易被氧化成 的原因:
的原因:___________ 。
(3)邻二氮菲( )与
)与 形成图1所示的红色配合物离子,常用于测定
形成图1所示的红色配合物离子,常用于测定 的浓度。
的浓度。___________ 。
②与邻二氮菲相比,配合物离子中∠CNC较___________ (填“大”“小”或“相同”),原因是___________ 。
③测定 浓度时,加入盐酸使溶液pH不断减小,红色逐渐变浅。从化学键角度分析原因:
浓度时,加入盐酸使溶液pH不断减小,红色逐渐变浅。从化学键角度分析原因:___________ 。
(4)铁和碳能形成图2所示的晶胞。该晶胞可以看成是在铁晶胞中插入若干碳原子,但晶胞体积不变。铁碳晶体的化学式是___________ ,铁晶体转化为铁碳晶体时晶体密度净增___________ %(结果保留2位有效数字)。
(1)基态Fe原子的价电子排布式是
(2)
 溶液与KSCN溶液混合,溶液呈红色,常用于检验
溶液与KSCN溶液混合,溶液呈红色,常用于检验 。
。①基态K、S、N原子第一电离能大小顺序是
 的空间构型是
的空间构型是②从结构角度分析
 易被氧化成
易被氧化成 的原因:
的原因:(3)邻二氮菲(
 )与
)与 形成图1所示的红色配合物离子,常用于测定
形成图1所示的红色配合物离子,常用于测定 的浓度。
的浓度。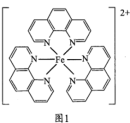
②与邻二氮菲相比,配合物离子中∠CNC较
③测定
 浓度时,加入盐酸使溶液pH不断减小,红色逐渐变浅。从化学键角度分析原因:
浓度时,加入盐酸使溶液pH不断减小,红色逐渐变浅。从化学键角度分析原因:(4)铁和碳能形成图2所示的晶胞。该晶胞可以看成是在铁晶胞中插入若干碳原子,但晶胞体积不变。铁碳晶体的化学式是

您最近一年使用:0次
解题方法
5 . 氟及其化合物用途非常广泛,自然界中氟多以化合态形式存在,形成的化合物有:N2F2、HBF4、 等。回答下列问题:
等。回答下列问题:
(1)氟元素基态原子最高能级电子的电子云形状为___________ ,下列为氟原子激发态的电子排布式的是___________ (填序号)。
A.1s22s22p43s1 B.1s22s22p6 C.1s22s22p5 D.1s22s12p6
(2)F与N可形成化合物N2F2,分子中各原子均满足8电子稳定结构。
①分子中氮原子的杂化方式为___________ 。
②N2F2结构式为___________ ,其分子中 键与
键与 键的数目之比为
键的数目之比为___________ 。
(3)氟硼酸(HBF4,属于强酸)可由HF和BF3化合生成,常用于替代浓硫酸作铅蓄电池的电解质溶液,从化学键形成角度分析HF与BF3能化合的原因___________ 。
(4)石墨与F2在450℃反应,石墨层间插入F得到层状结构化合物 ,该物质仍具有润滑性,其单层局部结构如图所示。与石墨相比,
,该物质仍具有润滑性,其单层局部结构如图所示。与石墨相比, 的导电性
的导电性___________ (填“增强”或“减弱”), 中C-C键的键长比石墨中C-C键的
中C-C键的键长比石墨中C-C键的___________ (填“长”或“短”)。___________ ,设NA为阿伏加德罗常数的值则该晶体的密度为___________  (列出计算式)。
(列出计算式)。
 等。回答下列问题:
等。回答下列问题:(1)氟元素基态原子最高能级电子的电子云形状为
A.1s22s22p43s1 B.1s22s22p6 C.1s22s22p5 D.1s22s12p6
(2)F与N可形成化合物N2F2,分子中各原子均满足8电子稳定结构。
①分子中氮原子的杂化方式为
②N2F2结构式为
 键与
键与 键的数目之比为
键的数目之比为(3)氟硼酸(HBF4,属于强酸)可由HF和BF3化合生成,常用于替代浓硫酸作铅蓄电池的电解质溶液,从化学键形成角度分析HF与BF3能化合的原因
(4)石墨与F2在450℃反应,石墨层间插入F得到层状结构化合物
 ,该物质仍具有润滑性,其单层局部结构如图所示。与石墨相比,
,该物质仍具有润滑性,其单层局部结构如图所示。与石墨相比, 的导电性
的导电性 中C-C键的键长比石墨中C-C键的
中C-C键的键长比石墨中C-C键的
 (列出计算式)。
(列出计算式)。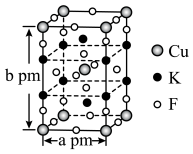
您最近一年使用:0次
解题方法
6 . 钙钛矿是指通式为 的一类化合物,钙钛矿型化合物可用于生产太阳能电池、传感器、固体电阻器等功能材料。
的一类化合物,钙钛矿型化合物可用于生产太阳能电池、传感器、固体电阻器等功能材料。
Ⅰ.最早发现的钙钛矿石中含 的立方晶胞如图1所示。
的立方晶胞如图1所示。
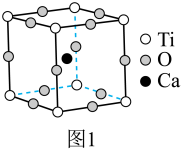
(1)基态 原子的价层电子排布式为
原子的价层电子排布式为___________ , 中组成元素的电负性大小顺序是
中组成元素的电负性大小顺序是___________ 。
(2)金属离子与氧离子之间的化学键为___________ 。
(3)晶胞中与 距离最近且相等的
距离最近且相等的 数目为
数目为___________ 。
Ⅱ.一种立方钙钛矿结构的金属卤化物光电材料的组成为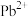 、
、 和有机碱离子
和有机碱离子 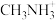 ,其晶胞如图2所示。
,其晶胞如图2所示。
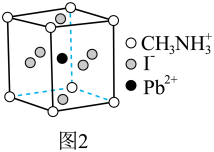
(4)图1中与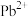 具有相同的空间位置的微粒是
具有相同的空间位置的微粒是
(5)有机碱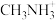 中,
中, 原子的杂化轨道类型是
原子的杂化轨道类型是___________ 。
(6)若晶胞参数 ,则晶体密度为
,则晶体密度为___________  (用
(用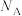 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。
用上述金属卤化物光电材料制作的太阳能电池在使用过程中会产生单质铅和碘,降低了器件效率和使用寿命。我国科学家巧妙地在此材料中引入稀土铕 盐,提升了太阳能电池的效率和使用寿命,其作用原理如图所示。
盐,提升了太阳能电池的效率和使用寿命,其作用原理如图所示。
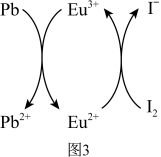
(7)用离子方程式表示该原理___________ 、___________ 。
 的一类化合物,钙钛矿型化合物可用于生产太阳能电池、传感器、固体电阻器等功能材料。
的一类化合物,钙钛矿型化合物可用于生产太阳能电池、传感器、固体电阻器等功能材料。Ⅰ.最早发现的钙钛矿石中含
 的立方晶胞如图1所示。
的立方晶胞如图1所示。
(1)基态
 原子的价层电子排布式为
原子的价层电子排布式为 中组成元素的电负性大小顺序是
中组成元素的电负性大小顺序是(2)金属离子与氧离子之间的化学键为
(3)晶胞中与
 距离最近且相等的
距离最近且相等的 数目为
数目为Ⅱ.一种立方钙钛矿结构的金属卤化物光电材料的组成为
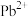 、
、 和有机碱离子
和有机碱离子 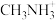 ,其晶胞如图2所示。
,其晶胞如图2所示。
(4)图1中与
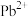 具有相同的空间位置的微粒是
具有相同的空间位置的微粒是A. | B.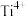 | C. | D.无 |
(5)有机碱
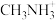 中,
中, 原子的杂化轨道类型是
原子的杂化轨道类型是(6)若晶胞参数
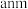 ,则晶体密度为
,则晶体密度为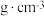 (用
(用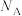 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。用上述金属卤化物光电材料制作的太阳能电池在使用过程中会产生单质铅和碘,降低了器件效率和使用寿命。我国科学家巧妙地在此材料中引入稀土铕
 盐,提升了太阳能电池的效率和使用寿命,其作用原理如图所示。
盐,提升了太阳能电池的效率和使用寿命,其作用原理如图所示。
(7)用离子方程式表示该原理
您最近一年使用:0次
7 . 硅(Si)、硒(Se)、镓(Ga)、锗(Ge)的单质及某些化合物都是航空航天测控、光纤通信等领域常用的半导体材料。回答下列问题:
(1)制造手机芯片需要高纯度硅,晶体硅属于___________ 晶体,可溶于氢氟酸生成氢气。写出晶体硅与氢氟酸反应的化学方程式:___________ 。
(2)基态硒原子的价电子排布图为___________ ;硒、硅均能与氢元素形成气态氢化物,硅的氢化物的分子中共用电子对偏向氢原子,而氢气与硒反应时单质硒是氧化剂,则电负性大小为Se___________ (填“>”或“<”)Si, 的立体构型为
的立体构型为___________ 。
(3)镓和砷都是第四周期的元素,则第一电离能:Ga___________ (填“大于”或“小于”)As。GaN、GaAs的晶体类型与晶体硅相同,试解释,熔点GaN>GaAs的原因:___________ 。
(4)氮化镓是一种重要的半导体材料,其立方晶胞结构如图所示。每个Ga原子周围距离最近的Ga原子数为___________ 。已知晶胞边长为apm,若该晶体的密度为 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值
___________ (只列出计算式即可)。
(1)制造手机芯片需要高纯度硅,晶体硅属于
(2)基态硒原子的价电子排布图为
 的立体构型为
的立体构型为(3)镓和砷都是第四周期的元素,则第一电离能:Ga
(4)氮化镓是一种重要的半导体材料,其立方晶胞结构如图所示。每个Ga原子周围距离最近的Ga原子数为
 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值

您最近一年使用:0次
名校
解题方法
8 . 某些过渡元素的相关化合物在化工、医药、材料等领域有着极为广泛的应用。回答下列问题:
(1)现有铜锌元素的3种微粒:①锌:[Ar]3d104s1;②铜:[Ar]3d104s1;③铜:[Ar]3d10,失去一个电子需要的最低能量由大到小的顺序是_______(填字母)。
(2)国际权威学术期刊《自然》最近报道,我国科学家选择碲化锆(ZrTes)和砷化镉(Cd3As2)为材料验证了三维量子霍尔效应。
①Zr是Ti的同族相邻元素,位于周期表的______ 区。
②Cd2+与NH3可形成配离子[Cd(NH3)4]2+。
i.该离子中不含的化学键类型有______ (填字母)。
A.离子键 B.配位键 C.σ键 D.共价键 E.π键 F.氢键
ii.已知该离子中2个NH3被2个Cl-替代只得到一种结构,则该离子的立体构型为______ 。
(3)二烃基锌(R-Zn-R)分子中烃基R与锌以σ键结合,C2H5-Zn-C2H5分子中原子的杂化方式有______ ,如表是2种二烃基锌的沸点数据,则烃基R1是______ ,推断的依据,是______ 。
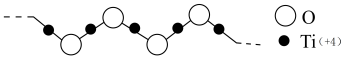
(4)硫酸氧钛(Ti)是一种优良的催化剂,其阳离子为如图所示链状聚合形式的离子,聚合度为n。则该阳离子的化学式为______ 。______ g•cm-3。用Al掺杂TiN后,其晶胞结构如图所示,距离Ti最近的Al有______ 个。(NA为阿伏加德罗常数的值)。
(1)现有铜锌元素的3种微粒:①锌:[Ar]3d104s1;②铜:[Ar]3d104s1;③铜:[Ar]3d10,失去一个电子需要的最低能量由大到小的顺序是_______(填字母)。
| A.①②③ | B.③①② | C.③②① | D.①③② |
(2)国际权威学术期刊《自然》最近报道,我国科学家选择碲化锆(ZrTes)和砷化镉(Cd3As2)为材料验证了三维量子霍尔效应。
①Zr是Ti的同族相邻元素,位于周期表的
②Cd2+与NH3可形成配离子[Cd(NH3)4]2+。
i.该离子中不含的化学键类型有
A.离子键 B.配位键 C.σ键 D.共价键 E.π键 F.氢键
ii.已知该离子中2个NH3被2个Cl-替代只得到一种结构,则该离子的立体构型为
(3)二烃基锌(R-Zn-R)分子中烃基R与锌以σ键结合,C2H5-Zn-C2H5分子中原子的杂化方式有
| 物质 | R1-Zn-R1 | C2H5-Zn-C2H5 |
| 沸点(℃) | 46 | 118 |
(4)硫酸氧钛(Ti)是一种优良的催化剂,其阳离子为如图所示链状聚合形式的离子,聚合度为n。则该阳离子的化学式为

您最近一年使用:0次
9 . Si、S、Se在自然界中形成多种多样的物质结构。回答下列问题:
(1)Se与O同族,电负性较大的是_____ ;基态Se原子的价电子运动状态有_____ 种。
(2)已知液态的二氧化硫可以发生类似水的自电离: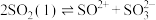 。
。 中各原子满足8电子结构,则其
中各原子满足8电子结构,则其 键和
键和 键数目之比为
键数目之比为__ , 的空间结构为
的空间结构为_______ 。
(3)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物 和
和 的结构如图所示,
的结构如图所示, 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为_______ ,二者中更易与 形成配位键的是
形成配位键的是_______ 。 熔点(>1700℃)明显高于
熔点(>1700℃)明显高于 (315℃),原因是
(315℃),原因是_______ 。
(5) -硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。
-硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。 -硒六方晶胞参数为
-硒六方晶胞参数为 、
、 、
、 (其中
(其中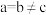 ),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为
),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为 。
。_______ 。晶胞中含有Se原子的数目为_______ ;则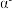 -硒晶胞的摩尔体积为
-硒晶胞的摩尔体积为______  (列出算式)。
(列出算式)。
(1)Se与O同族,电负性较大的是
(2)已知液态的二氧化硫可以发生类似水的自电离:
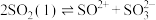 。
。 中各原子满足8电子结构,则其
中各原子满足8电子结构,则其 键和
键和 键数目之比为
键数目之比为 的空间结构为
的空间结构为(3)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物
 和
和 的结构如图所示,
的结构如图所示, 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为 形成配位键的是
形成配位键的是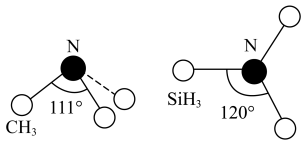
 熔点(>1700℃)明显高于
熔点(>1700℃)明显高于 (315℃),原因是
(315℃),原因是(5)
 -硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。
-硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。 -硒六方晶胞参数为
-硒六方晶胞参数为 、
、 、
、 (其中
(其中 ),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为
),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为 。
。
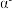 -硒晶胞的摩尔体积为
-硒晶胞的摩尔体积为 (列出算式)。
(列出算式)。
您最近一年使用:0次
10 . 吡啶为含N有机物。这类物质是合成医药农药的重要原料。下列吡啶类化合物A与Zn(CH3CH2)2(即ZnEt2)反应生成有机化合物B,B具有优异的催化性能。________ ,含Zn有机物B的分子结构中含________ (填序号)。
A.离子键 B.配位键 C.π键 D.σ键 E.氢键
(2)HN3分子的空间结构如图2所示(图中键长单位为10-10 m)。N-N、N=N和N≡N的共价键键长分别为1.40×10-10 m、1.20×10-10 m和1.09×10-10 m。试依据信息画出HN3分子的结构式________ ,分子中N原子的杂化方式为________ .________ (填元素符号)。在该化合物中,M离子的价电子排布式为________ .

A.离子键 B.配位键 C.π键 D.σ键 E.氢键
(2)HN3分子的空间结构如图2所示(图中键长单位为10-10 m)。N-N、N=N和N≡N的共价键键长分别为1.40×10-10 m、1.20×10-10 m和1.09×10-10 m。试依据信息画出HN3分子的结构式


您最近一年使用:0次



