1 . 锰及其化合物在化学实验室和化工生产应用非常广泛,回答下列问题:
(1)乙酰丙酮锰(III)是一种广泛用于苯酚类化合物氧化偶联的试剂,Me表示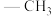 ,中心离子为
,中心离子为 离子,其结构如图所示。
离子,其结构如图所示。_______ ,该物质中不同杂化方式的碳原子数之比为_______ ,中心离子 填充在
填充在_______ 空隙中(填“四面体”或“八面体”)。
(2)从原子结构角度分析,基态原子中,Mn的第三电离能大于Fe的第三电离能的原因是_______ 。
(3) 能形成如图所示大π键,而羧基酸性随大π键电子云密度的增大而减弱,则
能形成如图所示大π键,而羧基酸性随大π键电子云密度的增大而减弱,则 、
、 、
、 酸性从强到弱顺序是
酸性从强到弱顺序是_______ 。 的顺式结构为
的顺式结构为_______ 分子(填“极性”、“非极性”)。 围成的八面体空隙中,形成无限螺旋链的络离子,同一条链内原子作用很强,其形成晶胞结构沿对角线的投影如图a所示,晶胞俯视图如图b所示,晶胞参数为
围成的八面体空隙中,形成无限螺旋链的络离子,同一条链内原子作用很强,其形成晶胞结构沿对角线的投影如图a所示,晶胞俯视图如图b所示,晶胞参数为 、
、 和
和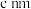 ,则该晶胞所带电荷为
,则该晶胞所带电荷为_______ 。阿伏加德罗常数的值为 ,该晶体的密度为
,该晶体的密度为_______  (用含
(用含 、a、c的式子表示)。
、a、c的式子表示)。
(1)乙酰丙酮锰(III)是一种广泛用于苯酚类化合物氧化偶联的试剂,Me表示
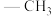 ,中心离子为
,中心离子为 离子,其结构如图所示。
离子,其结构如图所示。
 填充在
填充在(2)从原子结构角度分析,基态原子中,Mn的第三电离能大于Fe的第三电离能的原因是
(3)
 能形成如图所示大π键,而羧基酸性随大π键电子云密度的增大而减弱,则
能形成如图所示大π键,而羧基酸性随大π键电子云密度的增大而减弱,则 、
、 、
、 酸性从强到弱顺序是
酸性从强到弱顺序是 的顺式结构为
的顺式结构为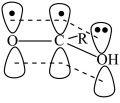
 围成的八面体空隙中,形成无限螺旋链的络离子,同一条链内原子作用很强,其形成晶胞结构沿对角线的投影如图a所示,晶胞俯视图如图b所示,晶胞参数为
围成的八面体空隙中,形成无限螺旋链的络离子,同一条链内原子作用很强,其形成晶胞结构沿对角线的投影如图a所示,晶胞俯视图如图b所示,晶胞参数为 、
、 和
和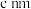 ,则该晶胞所带电荷为
,则该晶胞所带电荷为 ,该晶体的密度为
,该晶体的密度为 (用含
(用含 、a、c的式子表示)。
、a、c的式子表示)。

您最近一年使用:0次
名校
2 . 钙及其化合物在生产生活中有着重要的作用。
(1)Ca与Fe属于同一周期元素,且核外最外层电子构型相闰,但Ca的熔、沸点都比Fe低,原因是:________ 。
(2) 与水反应生成的
与水反应生成的 分子中,碳原子杂化轨道类型是
分子中,碳原子杂化轨道类型是________ ,且 中
中 与
与 互为等电子体,
互为等电子体, 中含有的
中含有的 键数目为
键数目为________ 。
(3) 的结构如图甲所示,其中B离子表示
的结构如图甲所示,其中B离子表示________ ,晶体中与 最近且等距离的
最近且等距离的 数目为
数目为________ 。 中燃烧时,得到一种氧化物晶体,其结构如图乙所示,由此可判断该氧化物中阴、阳离子数目之比为
中燃烧时,得到一种氧化物晶体,其结构如图乙所示,由此可判断该氧化物中阴、阳离子数目之比为________ ,已知该氧化物的密度是 ,则晶胞内最近的两个
,则晶胞内最近的两个 间的距离为
间的距离为________ cm(写出计算式即可)。
(1)Ca与Fe属于同一周期元素,且核外最外层电子构型相闰,但Ca的熔、沸点都比Fe低,原因是:
(2)
 与水反应生成的
与水反应生成的 分子中,碳原子杂化轨道类型是
分子中,碳原子杂化轨道类型是 中
中 与
与 互为等电子体,
互为等电子体, 中含有的
中含有的 键数目为
键数目为(3)
 的结构如图甲所示,其中B离子表示
的结构如图甲所示,其中B离子表示 最近且等距离的
最近且等距离的 数目为
数目为
 中燃烧时,得到一种氧化物晶体,其结构如图乙所示,由此可判断该氧化物中阴、阳离子数目之比为
中燃烧时,得到一种氧化物晶体,其结构如图乙所示,由此可判断该氧化物中阴、阳离子数目之比为 ,则晶胞内最近的两个
,则晶胞内最近的两个 间的距离为
间的距离为
您最近一年使用:0次
名校
解题方法
3 . 回答下列问题。
(1)青蒿素是我国科学家从传统中药中发现的能治疗疟疾的有机化合物,其分子结构如图所示,它可以用溶剂A从中药中提取出来,得到“提取液”后,再经“一系列操作”即可分离出青蒿素,结构如下图所示。下列有关说法正确的有___________
②青蒿素的分子式为C14H20O5
③青蒿素分子中具有的官能团有酮羰基和醚键
④用溶剂A从中药中提取出青蒿素的实验操作是萃取
⑤青蒿素分子中含有7个手性碳原子
(2)化合物 有多种同分异构体,写出满足以下条件的同分异构体结构简式
有多种同分异构体,写出满足以下条件的同分异构体结构简式 ___________ ;写出其与银氨溶液反应的方程式___________ 。
①能与银氨溶液发生反应;②核磁共振氢谱中共含有三组吸收峰。
(3)甘氨酸铜有顺式和反式两种同分异构,结构如图___________ (填序号)
a.sp b.sp2 c.sp3 d.dsp2
②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜不能溶于水,原因可能是___________ 。
(4)C、H、O、N是生命元素。下列说法正确的是___________。
(1)青蒿素是我国科学家从传统中药中发现的能治疗疟疾的有机化合物,其分子结构如图所示,它可以用溶剂A从中药中提取出来,得到“提取液”后,再经“一系列操作”即可分离出青蒿素,结构如下图所示。下列有关说法正确的有
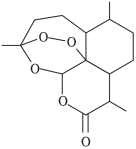
②青蒿素的分子式为C14H20O5
③青蒿素分子中具有的官能团有酮羰基和醚键
④用溶剂A从中药中提取出青蒿素的实验操作是萃取
⑤青蒿素分子中含有7个手性碳原子
(2)化合物
 有多种同分异构体,写出满足以下条件的同分异构体结构简式
有多种同分异构体,写出满足以下条件的同分异构体结构简式 ①能与银氨溶液发生反应;②核磁共振氢谱中共含有三组吸收峰。
(3)甘氨酸铜有顺式和反式两种同分异构,结构如图
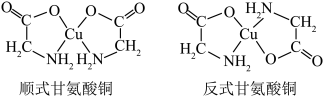
a.sp b.sp2 c.sp3 d.dsp2
②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜不能溶于水,原因可能是
(4)C、H、O、N是生命元素。下列说法正确的是___________。
| A.第一电离能:O>N>C>H |
| B.电负性:O>N>C>H |
C.酸性: |
D.键角: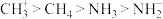 |
您最近一年使用:0次
4 . 硝基胍是固体火箭推进剂的重要组分,其结构简式如图所示。
(1)硝基胍分子中含有的共价键类型为___________ (从成键方式角度考虑)。
(2)硝基胍分子中C、H、O、N四种元素,这四种元素___________ (填“能”或“不能”)形成离子化合物。
(3)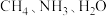 三种分子的中心原子杂化类型相同,但键角大小为
三种分子的中心原子杂化类型相同,但键角大小为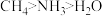 ,原因是
,原因是___________ 。
(4)硝基胍中N原子的杂化方式为___________ 。从结构上分析硝基胍___________ (填“易”或“不”)溶于水,原因是___________ 。
(5)下图中表示的碳原子能量最高的是___________(填字母)。

(1)硝基胍分子中含有的共价键类型为
(2)硝基胍分子中C、H、O、N四种元素,这四种元素
(3)
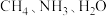 三种分子的中心原子杂化类型相同,但键角大小为
三种分子的中心原子杂化类型相同,但键角大小为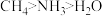 ,原因是
,原因是(4)硝基胍中N原子的杂化方式为
(5)下图中表示的碳原子能量最高的是___________(填字母)。
A.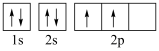 | B.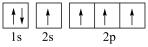 |
C.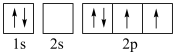 | D.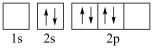 |
您最近一年使用:0次
解题方法
5 . 《自然》报道了我国科学家利用催化剂通过化学链合成氨。回答下列问题:
(1)NH3可用于制备NaN3、NH₄NO₃,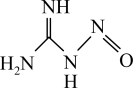 (亚硝基胍)等含氮化合物,基态N的核外电子排布为
(亚硝基胍)等含氮化合物,基态N的核外电子排布为___________ ; NH₄NO₃中 NH 中中心原子的杂化轨道类型为
中中心原子的杂化轨道类型为___________ NO 的空间结构为
的空间结构为___________ ; 亚硝基胍分子中σ键与π键的数目比为___________ 。
(2)N、P位于同一主族,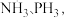 分子结构如图所示:
分子结构如图所示:___________ ,
②NH₃比PH₃的沸点高, 其主要原因是___________ 。
③磷化镓的晶胞结构如下图所示,A点坐标为(0,0,0),B点坐标为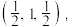 则C点坐标为
则C点坐标为___________ ;
(1)NH3可用于制备NaN3、NH₄NO₃,
 (亚硝基胍)等含氮化合物,基态N的核外电子排布为
(亚硝基胍)等含氮化合物,基态N的核外电子排布为 中中心原子的杂化轨道类型为
中中心原子的杂化轨道类型为 的空间结构为
的空间结构为(2)N、P位于同一主族,
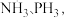 分子结构如图所示:
分子结构如图所示:
②NH₃比PH₃的沸点高, 其主要原因是
③磷化镓的晶胞结构如下图所示,A点坐标为(0,0,0),B点坐标为
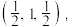 则C点坐标为
则C点坐标为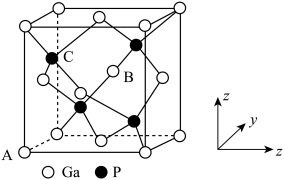
您最近一年使用:0次
名校
6 . 合成氨是人类科学技术上的一项重大突破,在很大程度上解决了地球上因粮食不足而导致的饥饿问题,是化学和技术对社会发展与进步的巨大贡献.
(1)自然界中的氮元素主要以分子的形式存在于空气中,是固氮的主要来源.
①基态氮原子的价电子轨道表示式为___________ .
②自然固氮过程中生成的 的
的 模型名称为
模型名称为____________ ,N原子的杂化方式为___________ .
(2)铁触媒是普遍使用的人工合成氨的催化剂,以铁为主体通常还含有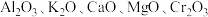 等氧化物.
等氧化物.
①上述氧化物所涉及的元素中,处于元素周期表中p区的元素是__________ .
②基态铬原子的电子排布式为___________ .
③下列比较正确的是___________ .
A.第一电离能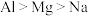 B.熔点:
B.熔点: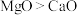
C.离子半径: D.键角:
D.键角: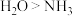
④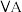 族元素的气态氢化物中
族元素的气态氢化物中 沸点最高的原因是
沸点最高的原因是____________ .
⑤ 和
和 分子的空间结构和相应的键角如图所示,则甲、乙对应的分子分别是
分子的空间结构和相应的键角如图所示,则甲、乙对应的分子分别是_________ 、__________ .
(1)自然界中的氮元素主要以分子的形式存在于空气中,是固氮的主要来源.
①基态氮原子的价电子轨道表示式为
②自然固氮过程中生成的
 的
的 模型名称为
模型名称为(2)铁触媒是普遍使用的人工合成氨的催化剂,以铁为主体通常还含有
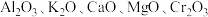 等氧化物.
等氧化物.①上述氧化物所涉及的元素中,处于元素周期表中p区的元素是
②基态铬原子的电子排布式为
③下列比较正确的是
A.第一电离能
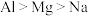 B.熔点:
B.熔点: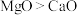
C.离子半径:
 D.键角:
D.键角: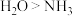
④
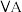 族元素的气态氢化物中
族元素的气态氢化物中 沸点最高的原因是
沸点最高的原因是⑤
 和
和 分子的空间结构和相应的键角如图所示,则甲、乙对应的分子分别是
分子的空间结构和相应的键角如图所示,则甲、乙对应的分子分别是
您最近一年使用:0次
名校
解题方法
7 . 2023年杭州亚运会开幕式首次用“零碳甲醇”作为主火炬塔燃料,实现废碳再生、循环内零碳排放。已知某些共价键的键能:
(1) 的电子式为
的电子式为______ 。
(2) 分子结构如图。
分子结构如图。 分子中O的杂化轨道类型
分子中O的杂化轨道类型______ 。
②键长a、b、c从长到短的顺序为:______ 。
③乙醇的沸点(78℃)高于甲醇(65℃)。解释原因:______ 。
(3)在350℃、 催化下用
催化下用 制备
制备 的反应原理如图。
的反应原理如图。______ 。
②下列说法正确的是______ (填序号)。
A.电负性由大到小的顺序:O>C>H
B.步骤a涉及s-s σ键的断裂和 σ键的生成
σ键的生成
C.步骤d、e的反应热( )相等
)相等
D.升高温度可以提高反应速率和 的平衡产率
的平衡产率
(4)干冰( )的晶胞结构如图所示,若该晶胞边长为a pm,则干冰晶体的密度为
)的晶胞结构如图所示,若该晶胞边长为a pm,则干冰晶体的密度为______ 
(已知: ;
; 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。
化学键 | H―H | C―H | H―O | C―O | C=O |
键能/( | 436 | 413 | 463 | 351 | 745 |
(1)
 的电子式为
的电子式为(2)
 分子结构如图。
分子结构如图。
 分子中O的杂化轨道类型
分子中O的杂化轨道类型②键长a、b、c从长到短的顺序为:
③乙醇的沸点(78℃)高于甲醇(65℃)。解释原因:
(3)在350℃、
 催化下用
催化下用 制备
制备 的反应原理如图。
的反应原理如图。
②下列说法正确的是
A.电负性由大到小的顺序:O>C>H
B.步骤a涉及s-s σ键的断裂和
 σ键的生成
σ键的生成C.步骤d、e的反应热(
 )相等
)相等D.升高温度可以提高反应速率和
 的平衡产率
的平衡产率(4)干冰(
 )的晶胞结构如图所示,若该晶胞边长为a pm,则干冰晶体的密度为
)的晶胞结构如图所示,若该晶胞边长为a pm,则干冰晶体的密度为
(已知:
 ;
; 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。
您最近一年使用:0次
解题方法
8 . 按要求回答下列问题:
(1)根据价层电子对互斥模型,H2S 、SO2 、SO3 的气态分子中,中心原子价层电子对数不同于其他分子的是___________ 。
(2)晶体中H2O 和 中心原子的杂化轨道类型分别为
中心原子的杂化轨道类型分别为___________ ,试判断 H2O 和  的键角大小关系并说明原因:
的键角大小关系并说明原因:___________ 。
(3)成语“信口雌黄 ”中的雌黄分子式为 As2S3,分子结构如图,As 原子的杂化方式为___________ , 雌黄和 SnCl2 在盐酸中反应转化为雄黄(As4S4)和 SnCl4 并放出 H2S 气体。___________ 。
(5)Zn2+的核外电子排布式为___________ ,在元素周期表中,该元素在___________ (填“s”“p”“d”“f”或“ds”)区。。
(6)S8与热的浓NaOH 溶液反应的产物之一为Na2S3,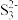 的空间结构为
的空间结构为___________ 。
(7)[H2F]+[SbF6]-(氟酸锑)是一种超强酸,则[H2F]+ 的空间结构为___________ 。
(8)Na3AsO4 中含有的化学键类型包括___________ ; 的空间结构为
的空间结构为 ___________ 。
(1)根据价层电子对互斥模型,H2S 、SO2 、SO3 的气态分子中,中心原子价层电子对数不同于其他分子的是
(2)晶体中H2O 和
 中心原子的杂化轨道类型分别为
中心原子的杂化轨道类型分别为 的键角大小关系并说明原因:
的键角大小关系并说明原因:(3)成语“信口雌黄 ”中的雌黄分子式为 As2S3,分子结构如图,As 原子的杂化方式为

(5)Zn2+的核外电子排布式为
(6)S8与热的浓NaOH 溶液反应的产物之一为Na2S3,
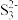 的空间结构为
的空间结构为(7)[H2F]+[SbF6]-(氟酸锑)是一种超强酸,则[H2F]+ 的空间结构为
(8)Na3AsO4 中含有的化学键类型包括
 的空间结构为
的空间结构为
您最近一年使用:0次
名校
解题方法
9 . 研发高效、绿色催化剂是化学科学发展的重要领域。某分子笼状有机化合物的结构如图1所示,其分子笼铜配合物结构及其催化环己烷氧化去饱和化反应的可能机理如图2所示。回答下列问题: 原子价层电子的轨道表示式为
原子价层电子的轨道表示式为_______ ,其位于元素周期表中_______ 区。
(2)平面形有机物 中N原子的杂化轨道类型为
中N原子的杂化轨道类型为_______ ,C、N原子的 轨道重叠形成
轨道重叠形成_______ 电子大π键。
(3)图1有机物中所涉及元素的电负性由大到小的顺序为_______ (用元素符号表示)。
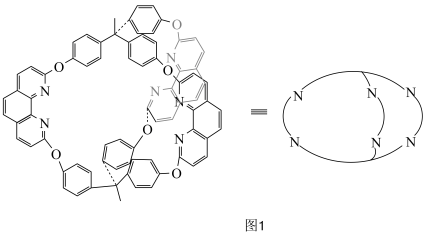
(4)图2化合物④中 的配位数为
的配位数为_______ ,该配合物中键角
_______ (填“>”“<”或“=”) 中
中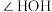 ,其原因为
,其原因为_______ 。
(5)图2中 参与氧化反应的总反应方程式为
参与氧化反应的总反应方程式为_______ 。
(6)已知有机物中N原子的电子云密度越大,其碱性越强。下列四种有机物的碱性由强到弱的顺序为_______ (填字母)。
 原子价层电子的轨道表示式为
原子价层电子的轨道表示式为(2)平面形有机物
 中N原子的杂化轨道类型为
中N原子的杂化轨道类型为 轨道重叠形成
轨道重叠形成(3)图1有机物中所涉及元素的电负性由大到小的顺序为
(4)图2化合物④中
 的配位数为
的配位数为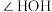
 中
中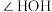 ,其原因为
,其原因为(5)图2中
 参与氧化反应的总反应方程式为
参与氧化反应的总反应方程式为(6)已知有机物中N原子的电子云密度越大,其碱性越强。下列四种有机物的碱性由强到弱的顺序为
a.  b.
b.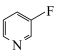 c.
c. 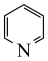 d.
d.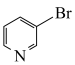
您最近一年使用:0次
2024-06-02更新
|
59次组卷
|
2卷引用:河南省部分示范性高中2023-2024学年高二下学期5月联考 化学试题
名校
解题方法
10 . 关于第ⅣA族的元素——碳(C)、硅(Si)、锗(Ge)、锡(Sn)和铅(Pb),它们可形成许多结构各异的物质。回答下列问题:
(1)基态Si原子的价电子轨道表示式为___________ ,有___________ 种不同运动状态的电子。
(2)CH3COOH中C原子的杂化类型是___________ 。
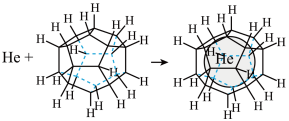
(3)1999年,科学家成功地将一个He原子“装入”了一个C20H20的空腔内,得到了“世界上最小的氦气球”(如图所示,产物记为He@ C20H20)。则He@ C20H20中,He与C20H20之间的作用力为___________ 。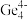 、
、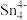 和
和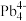 等阴离子,根据等电子体原理判断,
等阴离子,根据等电子体原理判断,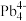 中的键角为
中的键角为___________ 。
(5)科研团队通过皮秒激光照射悬浮在甲醇溶液中的多臂碳纳米管合成T-碳,T-碳的晶体结构可以看成金刚石晶体中每个碳原子被一个由四个碳原子组成的正四面体结构单元取代,T-碳的密度约为金刚石的一半,T-碳晶体的晶胞、金刚石的晶胞如图所示。则T-碳晶胞的棱长是金刚石晶胞棱长的___________ 倍。
①该材料的化学式是___________ 。
②已知晶胞边长为a=1424pm,则该超导材料的理论密度为ρ=___________ g·cm-3(写出表达式)。
(1)基态Si原子的价电子轨道表示式为
(2)CH3COOH中C原子的杂化类型是
(3)1999年,科学家成功地将一个He原子“装入”了一个C20H20的空腔内,得到了“世界上最小的氦气球”(如图所示,产物记为He@ C20H20)。则He@ C20H20中,He与C20H20之间的作用力为
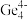 、
、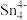 和
和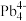 等阴离子,根据等电子体原理判断,
等阴离子,根据等电子体原理判断,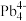 中的键角为
中的键角为(5)科研团队通过皮秒激光照射悬浮在甲醇溶液中的多臂碳纳米管合成T-碳,T-碳的晶体结构可以看成金刚石晶体中每个碳原子被一个由四个碳原子组成的正四面体结构单元取代,T-碳的密度约为金刚石的一半,T-碳晶体的晶胞、金刚石的晶胞如图所示。则T-碳晶胞的棱长是金刚石晶胞棱长的
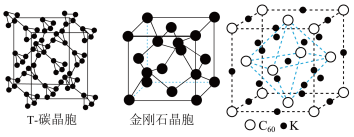
①该材料的化学式是
②已知晶胞边长为a=1424pm,则该超导材料的理论密度为ρ=
您最近一年使用:0次

 )
)

