1 . 砷化镓是一种重要的半导体材料,其晶胞结构如图所示。

(1)①As原子的基态价电子排布式是_______ 。
②Ga在元素周期表中的位置是_______ 。
(2)砷化镓晶体可以通过三甲基化镓与AsH3反应制备: 。
。
①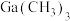 中Ga的杂化类型是
中Ga的杂化类型是_______ 。
②AsH3分子的空间结构为_______ 。
③请从物质结构与性质的角度解释AsH3沸点低于同主族氢化物NH3的事实:_______ 。
(3)通过砷化镓晶胞结构可判断:Ga原子的配位数为_______ 。
(4)已知阿伏加德罗常数为NA,立方体晶胞棱长为anm。试求:
①Ga与As间最短距离为_______ nm。
②晶体的密度为_______  (列出计算式)。
(列出计算式)。
(5)GaN、GaP、GaAs熔点如下表所示,试分析GaN、GaP、GaAs的熔点依次降低的原因:_______ 。

(1)①As原子的基态价电子排布式是
②Ga在元素周期表中的位置是
(2)砷化镓晶体可以通过三甲基化镓与AsH3反应制备:
 。
。①
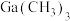 中Ga的杂化类型是
中Ga的杂化类型是②AsH3分子的空间结构为
③请从物质结构与性质的角度解释AsH3沸点低于同主族氢化物NH3的事实:
(3)通过砷化镓晶胞结构可判断:Ga原子的配位数为
(4)已知阿伏加德罗常数为NA,立方体晶胞棱长为anm。试求:
①Ga与As间最短距离为
②晶体的密度为
 (列出计算式)。
(列出计算式)。(5)GaN、GaP、GaAs熔点如下表所示,试分析GaN、GaP、GaAs的熔点依次降低的原因:
| 物质 | GaN | GaP | GaAs |
| 熔点/℃ | 1700 | 1480 | 1238 |
您最近一年使用:0次
解题方法
2 . 磷酸铁锂(LiFePO4)电池是绿色环保型电池,该电池以磷酸铁锂为正极材料,嵌有石墨的锂为负极材料,溶有LiPF6的碳酸酯作电解质。回答下列问题:
(1)基态P原子的成对与未成对电子数之比为___________ ;最高能级的电子云轮廓图为___________ 。
(2)H3PO4中 空间构型为
空间构型为___________ ;Li、F、P三种元素电负性由大到小的顺序为___________ 。元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1),第三周期部分元素的E1(均为正值)的大小顺序为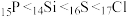 ,第一电子亲和能
,第一电子亲和能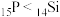 的原因为
的原因为___________ 。
(3)实验数据表明沸点NH3>PH3,分析原因是___________ 。
(4)天门冬氨酸锌是一种补锌剂,可以用Zn(NO3)2・6H2O、天门冬氨酸为原料制备。
①天门冬氨酸[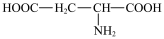 ]分子中碳原子的轨道杂化类型为
]分子中碳原子的轨道杂化类型为___________ ;
②与H2O互为等电子体的一种阳离子的化学式为___________ 。
(1)基态P原子的成对与未成对电子数之比为
(2)H3PO4中
 空间构型为
空间构型为 ,第一电子亲和能
,第一电子亲和能 的原因为
的原因为(3)实验数据表明沸点NH3>PH3,分析原因是
(4)天门冬氨酸锌是一种补锌剂,可以用Zn(NO3)2・6H2O、天门冬氨酸为原料制备。
①天门冬氨酸[
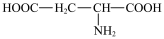 ]分子中碳原子的轨道杂化类型为
]分子中碳原子的轨道杂化类型为②与H2O互为等电子体的一种阳离子的化学式为
您最近一年使用:0次
解题方法
3 . 硒(Se)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(AIE)效应以来,AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子Ⅳ的合成路线如下:
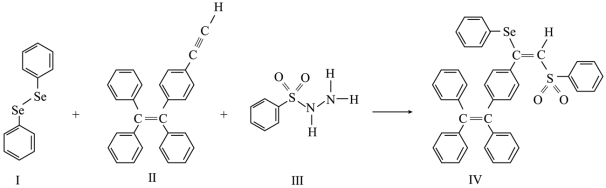
(1)硒原子价电子数目为________ 。
(2)H2Se的沸点低于H2O,其原因是________ 。
(3)关于Ⅰ、Ⅱ、Ⅲ三种反应物,下列说法正确的有________ 。
A.Ⅰ中仅有σ键 B.I中的Se-Se键为非极性共价键 C.Ⅱ易溶于水
D.Ⅱ中原子的杂化轨道类型只有sp与sp2 E.Ⅰ~Ⅲ含有的元素中,O电负性最大
(4)MnS晶胞与NaCl晶胞属于同种类型,如图所示。
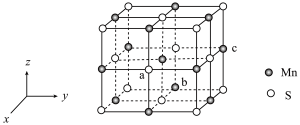
①前者的熔点明显高于后者,其主要原因是________________________ 。
②以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在晶胞坐标系中,a点硫原子坐标为 ,b点锰原子坐标为
,b点锰原子坐标为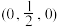 ,则c点锰原子坐标为
,则c点锰原子坐标为________ 。
(5)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。
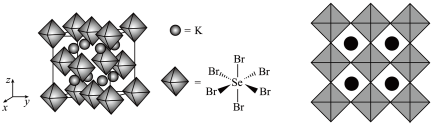
①X的化学式为________ 。
②设X的最简式的式量为Mr,晶体密度为 ,则晶体X中相邻K之间的最短距离为
,则晶体X中相邻K之间的最短距离为________ cm(列出计算式,NA为阿伏加德罗常数的值)。

(1)硒原子价电子数目为
(2)H2Se的沸点低于H2O,其原因是
(3)关于Ⅰ、Ⅱ、Ⅲ三种反应物,下列说法正确的有
A.Ⅰ中仅有σ键 B.I中的Se-Se键为非极性共价键 C.Ⅱ易溶于水
D.Ⅱ中原子的杂化轨道类型只有sp与sp2 E.Ⅰ~Ⅲ含有的元素中,O电负性最大
(4)MnS晶胞与NaCl晶胞属于同种类型,如图所示。

①前者的熔点明显高于后者,其主要原因是
②以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在晶胞坐标系中,a点硫原子坐标为
 ,b点锰原子坐标为
,b点锰原子坐标为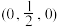 ,则c点锰原子坐标为
,则c点锰原子坐标为(5)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。

①X的化学式为
②设X的最简式的式量为Mr,晶体密度为
 ,则晶体X中相邻K之间的最短距离为
,则晶体X中相邻K之间的最短距离为
您最近一年使用:0次
解题方法
4 . 我国部分城市灰霾天占全年一半,引起灰霾的PM2.5微细粒子包含 、
、 ,有机颗粒物及扬尘等。通过测定灰中锌等重金属的含量,可知目前造成我国灰霾天气主要是交通污染。
,有机颗粒物及扬尘等。通过测定灰中锌等重金属的含量,可知目前造成我国灰霾天气主要是交通污染。
(1) 在基态时核外电子排布式为
在基态时核外电子排布式为_______ 。
(2) 的空间构型是
的空间构型是_______ (用文字描述)。
(3)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有 、
、 ,
,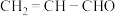 ,
, ,
,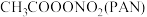 等二次污染物。
等二次污染物。
①下列说法正确的是_______ (不定项选择)。
a. 结构式可表示为
结构式可表示为
b. 分子呈直线形
分子呈直线形
c.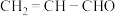 分子中碳原子均采用
分子中碳原子均采用 杂化
杂化
d.相同压强下, 沸点比
沸点比 高,说明前者是极性分子,后者是非极性分子
高,说明前者是极性分子,后者是非极性分子
②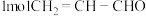 中含
中含 键数目为
键数目为_______  。
。
③ 能被
能被 溶液吸收生成配合物
溶液吸收生成配合物 ,该配合物中心离子的配位数为
,该配合物中心离子的配位数为_______ (填数字)。
(4)下列分子或离子中,能提供孤对电子与某些金属离子形成配位键的是_______ 。
① ②
② ③
③ ④
④
(5)测定大气中PM2.5的浓度方法之一是β—射线吸收法,β—射线放射源可用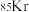 ,已知
,已知 晶体的晶胞结构如图所示,设晶体中与每个
晶体的晶胞结构如图所示,设晶体中与每个 原子相紧邻的
原子相紧邻的 原子有m个,晶胞中含
原子有m个,晶胞中含 原子为n个,则
原子为n个,则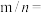
_______ (填数字)。

 、
、 ,有机颗粒物及扬尘等。通过测定灰中锌等重金属的含量,可知目前造成我国灰霾天气主要是交通污染。
,有机颗粒物及扬尘等。通过测定灰中锌等重金属的含量,可知目前造成我国灰霾天气主要是交通污染。(1)
 在基态时核外电子排布式为
在基态时核外电子排布式为(2)
 的空间构型是
的空间构型是(3)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有
 、
、 ,
,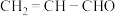 ,
, ,
,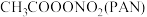 等二次污染物。
等二次污染物。①下列说法正确的是
a.
 结构式可表示为
结构式可表示为
b.
 分子呈直线形
分子呈直线形c.
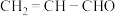 分子中碳原子均采用
分子中碳原子均采用 杂化
杂化d.相同压强下,
 沸点比
沸点比 高,说明前者是极性分子,后者是非极性分子
高,说明前者是极性分子,后者是非极性分子②
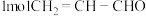 中含
中含 键数目为
键数目为 。
。③
 能被
能被 溶液吸收生成配合物
溶液吸收生成配合物 ,该配合物中心离子的配位数为
,该配合物中心离子的配位数为(4)下列分子或离子中,能提供孤对电子与某些金属离子形成配位键的是
①
 ②
② ③
③ ④
④
(5)测定大气中PM2.5的浓度方法之一是β—射线吸收法,β—射线放射源可用
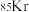 ,已知
,已知 晶体的晶胞结构如图所示,设晶体中与每个
晶体的晶胞结构如图所示,设晶体中与每个 原子相紧邻的
原子相紧邻的 原子有m个,晶胞中含
原子有m个,晶胞中含 原子为n个,则
原子为n个,则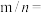

您最近一年使用:0次
名校
解题方法
5 . 铁(Fe)、钴(Co)、镍(Ni)是第四周期第Ⅶ族的元素,其化合物在生产生活中应用广泛。
(1)基态Fe的价层电子排布式为_____ 。
(2)以甲醇为溶剂,Co2+可与色胺酮分子配位结合,形成对DNA具有切割作用的色胺酮钴配合物(合成过程如图所示)。_____ 。
②色胺酮分子中N原子的杂化类型为_____ 。
③X射线衍射分析显示色胺酮钴配合物晶胞中还含有一个CH3OH分子,CH3OH是通过_____ 作用与色胺酮钴配合物相结合。
(3)超导材料在电力、交通、医学等方面有着广泛的应用,某含Ni、Mg和C三种元素的晶体具有超导性,该晶体的晶胞结构如图所示:_____ 个。
②已知该晶胞的边长为anm,阿伏加德罗常数为NA,该晶体的密度为_____ g•cm-3。(1nm=10-9m)
(1)基态Fe的价层电子排布式为
(2)以甲醇为溶剂,Co2+可与色胺酮分子配位结合,形成对DNA具有切割作用的色胺酮钴配合物(合成过程如图所示)。

②色胺酮分子中N原子的杂化类型为
③X射线衍射分析显示色胺酮钴配合物晶胞中还含有一个CH3OH分子,CH3OH是通过
(3)超导材料在电力、交通、医学等方面有着广泛的应用,某含Ni、Mg和C三种元素的晶体具有超导性,该晶体的晶胞结构如图所示:

②已知该晶胞的边长为anm,阿伏加德罗常数为NA,该晶体的密度为
您最近一年使用:0次
2023-04-12更新
|
389次组卷
|
3卷引用:北京市顺义区2023届高三下学期第二次化学统练题
解题方法
6 . 氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,质地软,可作润滑剂。立方相氮化硼与金刚石相似,是超硬材料,有优异的耐磨性。它们的晶体结构及晶胞如图所示。

(1)教材中介绍的金刚石的碳原子呈_______ (填“sp”、“ ”或“
”或“ ”)杂化,而石墨的碳原子呈
”)杂化,而石墨的碳原子呈_______ (填“sp”、“ ”或“
”或“ ”)杂化。石墨能导电,六方相氮化硼结构与石墨相似却不导电,原因是
”)杂化。石墨能导电,六方相氮化硼结构与石墨相似却不导电,原因是_______ 。
(2)关于这两种晶体的说法,正确的是_______(填选项字母)。
(3)立方相氮化硼晶体内一个硼原子与相邻氮原子构成的空间结构为_______ 形,立方相氮化硼晶体中,一个B与最近N之间有4个键,而B原子最外层中只有3个电子,推测其中可能有一个键为_______ 键。
(4) (氟硼酸铵)是合成氮化硼纳米管的原料之一、1mol
(氟硼酸铵)是合成氮化硼纳米管的原料之一、1mol  含有
含有_______ mol配位键。
(5)如上图所示,立方相BN晶体晶胞结构与金刚石相似,该晶胞中含有_______ 个N原子、_______ 个B原子。晶胞参数为a pm,则晶体的密度为_______  (用含
(用含 和a的式子表示,已知:
和a的式子表示,已知: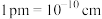 )。
)。

(1)教材中介绍的金刚石的碳原子呈
 ”或“
”或“ ”)杂化,而石墨的碳原子呈
”)杂化,而石墨的碳原子呈 ”或“
”或“ ”)杂化。石墨能导电,六方相氮化硼结构与石墨相似却不导电,原因是
”)杂化。石墨能导电,六方相氮化硼结构与石墨相似却不导电,原因是(2)关于这两种晶体的说法,正确的是_______(填选项字母)。
| A.立方相氮化硼含有σ键和π键,所以硬度大 |
| B.六方相氮化硼层间作用力小,所以质地软 |
| C.两种晶体中均不含有离子键 |
| D.两种晶体均为分子晶体 |
(3)立方相氮化硼晶体内一个硼原子与相邻氮原子构成的空间结构为
(4)
 (氟硼酸铵)是合成氮化硼纳米管的原料之一、1mol
(氟硼酸铵)是合成氮化硼纳米管的原料之一、1mol  含有
含有(5)如上图所示,立方相BN晶体晶胞结构与金刚石相似,该晶胞中含有
 (用含
(用含 和a的式子表示,已知:
和a的式子表示,已知: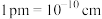 )。
)。
您最近一年使用:0次
名校
解题方法
7 . I.研究笼形包合物结构和性质具有重要意义。化学式为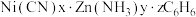 的笼形包物四方晶胞结构如图所示(H原子未画出),每个苯环只有一半属于该晶胞。晶胞参数为
的笼形包物四方晶胞结构如图所示(H原子未画出),每个苯环只有一半属于该晶胞。晶胞参数为 ,
, 回答下列问题:
回答下列问题:

(1)晶胞中N原于均参与形成配位键, 与
与 的配位数之比为
的配位数之比为___________ 。
(2)吡啶( )替代苯也可形成类似的笼形包合物。已知吡啶中含有与苯类似的大
)替代苯也可形成类似的笼形包合物。已知吡啶中含有与苯类似的大 大
大 键、则吡啶中N原子的价层孤电子对占据___________(填标号)。
键、则吡啶中N原子的价层孤电子对占据___________(填标号)。
(3)在水中的溶解度,吡啶远大于苯,主要原因是①___________ ,②___________ 。
(4) 、
、 、
、 的碱性随
的碱性随 原子电子云密度的增大而增强,其中碱性最弱的是
原子电子云密度的增大而增强,其中碱性最弱的是___________ 。
Ⅱ.Cu2-xSe是一种钠离子电池正极材料,充放电过程中正极材料立方晶胞(示意图)的组成变化如图所示,晶胞内未标出因放电产生的0价原子。

(5)每个 晶胞中
晶胞中 个数为
个数为___________ (以含 的代数式表示),每个
的代数式表示),每个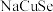 晶胞中0价
晶胞中0价 原子个数为
原子个数为___________ (以含 的代数式表示)。
的代数式表示)。
(6)每个 晶胞完全转化为
晶胞完全转化为 晶胞,转移电子数为
晶胞,转移电子数为___________ 。
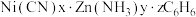 的笼形包物四方晶胞结构如图所示(H原子未画出),每个苯环只有一半属于该晶胞。晶胞参数为
的笼形包物四方晶胞结构如图所示(H原子未画出),每个苯环只有一半属于该晶胞。晶胞参数为 ,
, 回答下列问题:
回答下列问题:
(1)晶胞中N原于均参与形成配位键,
 与
与 的配位数之比为
的配位数之比为(2)吡啶(
 )替代苯也可形成类似的笼形包合物。已知吡啶中含有与苯类似的大
)替代苯也可形成类似的笼形包合物。已知吡啶中含有与苯类似的大 大
大 键、则吡啶中N原子的价层孤电子对占据___________(填标号)。
键、则吡啶中N原子的价层孤电子对占据___________(填标号)。A. 轨道 轨道 | B. 轨道 轨道 | C. 杂化轨道 杂化轨道 | D. 杂化轨道 杂化轨道 |
(4)
 、
、 、
、 的碱性随
的碱性随 原子电子云密度的增大而增强,其中碱性最弱的是
原子电子云密度的增大而增强,其中碱性最弱的是Ⅱ.Cu2-xSe是一种钠离子电池正极材料,充放电过程中正极材料立方晶胞(示意图)的组成变化如图所示,晶胞内未标出因放电产生的0价原子。

(5)每个
 晶胞中
晶胞中 个数为
个数为 的代数式表示),每个
的代数式表示),每个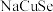 晶胞中0价
晶胞中0价 原子个数为
原子个数为 的代数式表示)。
的代数式表示)。(6)每个
 晶胞完全转化为
晶胞完全转化为 晶胞,转移电子数为
晶胞,转移电子数为
您最近一年使用:0次
名校
解题方法
8 . 回答下列问题:
(1)根据价层电子对互斥理论,H2S、SO2、SO3的气态分中,中心原子价层电子对数不同于其他分子的是___________ 。气态三氧化硫以单分子形式存在,其分子的空间结构为___________ 形;固体三氧化硫中存在如图所示的三聚分子,该分子中S原子的杂化轨道类型为___________ 。

(2)分子中的大π键可用符号 表示,其中m代表参与形成大键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),已知SO2分子中含有5对孤电子对,则SO2中的大π键应表示为
),已知SO2分子中含有5对孤电子对,则SO2中的大π键应表示为___________ 。SO2分子中键角∠OSO___________  中键角∠ONO(填“>”、“<”、“=”)。
中键角∠ONO(填“>”、“<”、“=”)。
(3)乙烯酮在室温下可聚合成二聚乙烯酮(结构简式为 ),二聚乙烯酮分子中含有的π键与σ键的数目之比为
),二聚乙烯酮分子中含有的π键与σ键的数目之比为___________ 。下图中表示的碳原子能量最高的是___________ (填字母)。
A. B.
B.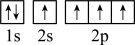
C. D.
D.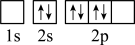
(4)三甲胺 和乙二胺
和乙二胺 均属于胺,但三甲胺比乙二胺的沸点低得多,原因是
均属于胺,但三甲胺比乙二胺的沸点低得多,原因是___________ 。C60的熔点比金刚石、石墨熔点低的原因是___________ 。
(5)在冰晶体中除氢键外,还存在范德华力 。已知冰的升华热是
。已知冰的升华热是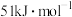 ,请估算冰中氢键的作用能为多少
,请估算冰中氢键的作用能为多少___________  。
。
(1)根据价层电子对互斥理论,H2S、SO2、SO3的气态分中,中心原子价层电子对数不同于其他分子的是

(2)分子中的大π键可用符号
 表示,其中m代表参与形成大键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),已知SO2分子中含有5对孤电子对,则SO2中的大π键应表示为
),已知SO2分子中含有5对孤电子对,则SO2中的大π键应表示为 中键角∠ONO(填“>”、“<”、“=”)。
中键角∠ONO(填“>”、“<”、“=”)。(3)乙烯酮在室温下可聚合成二聚乙烯酮(结构简式为
 ),二聚乙烯酮分子中含有的π键与σ键的数目之比为
),二聚乙烯酮分子中含有的π键与σ键的数目之比为A.
 B.
B.
C.
 D.
D.
(4)三甲胺
 和乙二胺
和乙二胺 均属于胺,但三甲胺比乙二胺的沸点低得多,原因是
均属于胺,但三甲胺比乙二胺的沸点低得多,原因是(5)在冰晶体中除氢键外,还存在范德华力
 。已知冰的升华热是
。已知冰的升华热是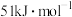 ,请估算冰中氢键的作用能为多少
,请估算冰中氢键的作用能为多少 。
。
您最近一年使用:0次
名校
9 . I、吡啶(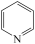 )是类似于苯的芳香化合物,工业上用作合成药品、消毒剂、染料等的原料。2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如图路线合成。
)是类似于苯的芳香化合物,工业上用作合成药品、消毒剂、染料等的原料。2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如图路线合成。
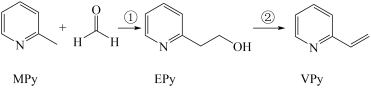
请回答下列问题:
(1)MPy分子中碳原子的杂化方式为_______
(2)EPy晶体中微粒间的作用力类型有_______ (填标号)。
a.离子键b.金属键c.极性键d.非极性键e.配位键f.氢键
(3)反应①中每生成1molEPy,断裂_______ 个π键,形成_______ 个σ键。
(4)吡啶、 与
与 形成二氯二吡啶合铂配合物,有顺式和反式两种同分异构体。科学研究表明,顺式分子具有抗癌活性。
形成二氯二吡啶合铂配合物,有顺式和反式两种同分异构体。科学研究表明,顺式分子具有抗癌活性。
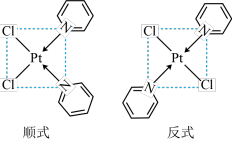
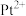 的配位数为
的配位数为_______ 。顺式二氯二吡啶合铂分子能否溶于水_______ (填“能”或“否”),
Ⅱ、有下列实验:
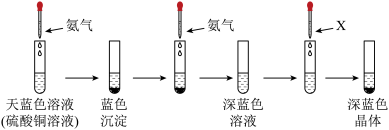
(5)该深蓝色晶体的化学式为_______ ,溶剂X可以是_______ (填名称),继续添加氨水,沉淀溶解,写出沉淀溶解的离子方程式为_______ 。
(6)该实验能说明 、
、 与
与 结合能力的强到弱的顺序是
结合能力的强到弱的顺序是_______ 。
(7)下列有关化学实验“操作→现象→解释”均正确的是_______ 。
 )是类似于苯的芳香化合物,工业上用作合成药品、消毒剂、染料等的原料。2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如图路线合成。
)是类似于苯的芳香化合物,工业上用作合成药品、消毒剂、染料等的原料。2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如图路线合成。
请回答下列问题:
(1)MPy分子中碳原子的杂化方式为
(2)EPy晶体中微粒间的作用力类型有
a.离子键b.金属键c.极性键d.非极性键e.配位键f.氢键
(3)反应①中每生成1molEPy,断裂
(4)吡啶、
 与
与 形成二氯二吡啶合铂配合物,有顺式和反式两种同分异构体。科学研究表明,顺式分子具有抗癌活性。
形成二氯二吡啶合铂配合物,有顺式和反式两种同分异构体。科学研究表明,顺式分子具有抗癌活性。
 的配位数为
的配位数为Ⅱ、有下列实验:

(5)该深蓝色晶体的化学式为
(6)该实验能说明
 、
、 与
与 结合能力的强到弱的顺序是
结合能力的强到弱的顺序是(7)下列有关化学实验“操作→现象→解释”均正确的是
| 选项 | 操作 | 现象 | 解释 |
| A | 向某溶液中滴加KSCN溶液 | 产生红色沉淀 | 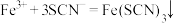 |
| B | 向由0.1molCrCl3·6H2O配成的溶液加入足量AgNO3溶液 | 产生0.2mol沉淀 | 已知 的配位数为6.则CrCl3·6H2O的化学式可表示为 的配位数为6.则CrCl3·6H2O的化学式可表示为 |
| C | 向K2Cr2O7溶液中先滴加3滴浓硫酸,再改加l0滴浓NaOH | 溶液先橙色加深,后变为黄色 | 溶液中存在: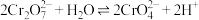 |
| D | 向AgCl悬浊液中滴加氨水 | 沉淀溶解 | AgCl不溶于水,但溶于氨水,重新电离成Ag+和Cl- |
您最近一年使用:0次
名校
解题方法
10 . I.Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)写出基态Р原子的电子排布式_______ ,有_______ 种空间运动状态,占据最高能级的电子云轮廓图为_______ 形。
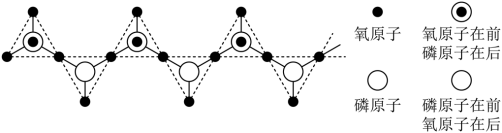
(2)多聚磷酸由磷酸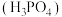 加热脱水缩合而成。链状多聚磷酸是多个磷酸通过脱水后共有部分氧原子连接起来的,多聚磷酸根离子的部分结构投影图如图所示(由于P、O原子的半径大小不同,投影图中P与O之间存在部分或全部遮掩关系),则其化学式为
加热脱水缩合而成。链状多聚磷酸是多个磷酸通过脱水后共有部分氧原子连接起来的,多聚磷酸根离子的部分结构投影图如图所示(由于P、O原子的半径大小不同,投影图中P与O之间存在部分或全部遮掩关系),则其化学式为_______ 。
Ⅱ.阿散酸(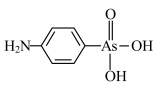 )是一种饲料添加剂,能溶于NaOH溶液中,常含有H3AsO3、NaCl等杂质。回答下列问题:
)是一种饲料添加剂,能溶于NaOH溶液中,常含有H3AsO3、NaCl等杂质。回答下列问题:
(3)As与Se第一电离能大小关系_______ ; 原因为_______ 。
(4) 的中心原子的杂化方式为
的中心原子的杂化方式为_______ , 的空间构型为
的空间构型为_______ ,键角:
_______ 
(5)与 互为等电子体的分子为
互为等电子体的分子为_______ (填化学式,任写两种即可)。
(6)As的卤化物的熔点如下,表中卤化物熔点差异的原因是_______ 。
(1)写出基态Р原子的电子排布式
(2)多聚磷酸由磷酸
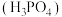 加热脱水缩合而成。链状多聚磷酸是多个磷酸通过脱水后共有部分氧原子连接起来的,多聚磷酸根离子的部分结构投影图如图所示(由于P、O原子的半径大小不同,投影图中P与O之间存在部分或全部遮掩关系),则其化学式为
加热脱水缩合而成。链状多聚磷酸是多个磷酸通过脱水后共有部分氧原子连接起来的,多聚磷酸根离子的部分结构投影图如图所示(由于P、O原子的半径大小不同,投影图中P与O之间存在部分或全部遮掩关系),则其化学式为
Ⅱ.阿散酸(
 )是一种饲料添加剂,能溶于NaOH溶液中,常含有H3AsO3、NaCl等杂质。回答下列问题:
)是一种饲料添加剂,能溶于NaOH溶液中,常含有H3AsO3、NaCl等杂质。回答下列问题:(3)As与Se第一电离能大小关系
(4)
 的中心原子的杂化方式为
的中心原子的杂化方式为 的空间构型为
的空间构型为

(5)与
 互为等电子体的分子为
互为等电子体的分子为(6)As的卤化物的熔点如下,表中卤化物熔点差异的原因是
| 物质 |  | 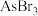 | 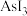 |
| 熔点/K | 256.8 | 304 | 413 |
您最近一年使用:0次



