解题方法
1 . 非金属氟化物在生产、生活和科研中应用广泛。回答下列问题:
(1)常温下 为无色气体,冷冻后成为淡黄色液体,
为无色气体,冷冻后成为淡黄色液体, 固体的晶体类型为
固体的晶体类型为___________ ;与 分子相比,
分子相比, 分子的键角更
分子的键角更___________ (填“大”或“小”),极性更___________ (填“强”或“弱”)。
(2)石墨与 在
在 反应,得到层状结构化合物
反应,得到层状结构化合物 ,其单层局部结构如图所示。与石墨相比,
,其单层局部结构如图所示。与石墨相比, 的导电性
的导电性___________ (填“增强”或“减弱”), 的
的 键的键长比石墨中
键的键长比石墨中 键的
键的___________ (填“长”或“短”)。 、
、 等离子,画出
等离子,画出 的结构式
的结构式___________ 。
(4) (第五周期稀有气体元素)与
(第五周期稀有气体元素)与 形成的
形成的 室温下易升华。
室温下易升华。 中心原子的价层电子对数为
中心原子的价层电子对数为___________ ,下列对 中心原子杂化方式推断合理的是
中心原子杂化方式推断合理的是___________ (填序号)。
A. B.
B. C.
C. D.
D.
(5) 晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为
晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为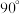 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如
。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如 点原子的分数坐标为
点原子的分数坐标为 ,已知
,已知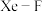 键的键长为
键的键长为 ,则
,则 点原子的分数坐标为
点原子的分数坐标为___________ ;晶胞中 、
、 间的距离
间的距离
___________  (用含
(用含 、
、 、
、 的计算式表示)。
的计算式表示)。
由晶胞结构可知B点分数坐标为: ;
;
(1)常温下
 为无色气体,冷冻后成为淡黄色液体,
为无色气体,冷冻后成为淡黄色液体, 固体的晶体类型为
固体的晶体类型为 分子相比,
分子相比, 分子的键角更
分子的键角更(2)石墨与
 在
在 反应,得到层状结构化合物
反应,得到层状结构化合物 ,其单层局部结构如图所示。与石墨相比,
,其单层局部结构如图所示。与石墨相比, 的导电性
的导电性 的
的 键的键长比石墨中
键的键长比石墨中 键的
键的
 、
、 等离子,画出
等离子,画出 的结构式
的结构式(4)
 (第五周期稀有气体元素)与
(第五周期稀有气体元素)与 形成的
形成的 室温下易升华。
室温下易升华。 中心原子的价层电子对数为
中心原子的价层电子对数为 中心原子杂化方式推断合理的是
中心原子杂化方式推断合理的是A.
 B.
B. C.
C. D.
D.
(5)
 晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为
晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为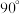 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如
。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如 点原子的分数坐标为
点原子的分数坐标为 ,已知
,已知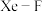 键的键长为
键的键长为 ,则
,则 点原子的分数坐标为
点原子的分数坐标为 、
、 间的距离
间的距离
 (用含
(用含 、
、 、
、 的计算式表示)。
的计算式表示)。由晶胞结构可知B点分数坐标为:
 ;
;
您最近一年使用:0次
解题方法
2 . 钛金属重量轻、强度高、有良好的抗腐蚀能力,其单质及其化合物在航空航天、武器装备、能源、化工、冶金建筑和交通等领域应用前景广阔。回答下列问题:
(1)三氟化钛可用于制取钛氟玻璃,基态F原子核外有_____ 个未成对电子,Ti原子形成Ti3+时价层电子层排布式为_____ 。
(2)TiO2的熔点为1800℃,TiCl4的熔点为-25℃,则TiO2的晶体类型为_____ ,TiCl4熔点低的原因为_____ 。
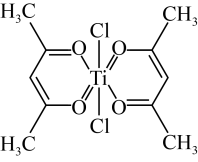
(3)钛某配合物可用于催化环烯烃聚合,其结构如图所示:_____ ,该化合物中电负性最大元素是_____ (填元素符号)。
②该配合物中不含有的化学键有_____ (填标号)。
a.离子键 b.σ键 c.金属键 d.π键
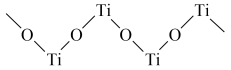
(4)已知TiO2与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示。该阳离子化学式为_____ ,阳离子中O的杂化方式为_____ ,阴离子的空间构型为_____ 。
(1)三氟化钛可用于制取钛氟玻璃,基态F原子核外有
(2)TiO2的熔点为1800℃,TiCl4的熔点为-25℃,则TiO2的晶体类型为
(3)钛某配合物可用于催化环烯烃聚合,其结构如图所示:
②该配合物中不含有的化学键有
a.离子键 b.σ键 c.金属键 d.π键
(4)已知TiO2与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示。该阳离子化学式为
您最近一年使用:0次
解题方法
3 . 钛由于其稳定的化学性质,良好的耐高温、耐低温、抗强酸、抗强碱以及高强度、低密度等特性,被美誉为“未来钢铁”“战略金属”。
(1)基态 原子的价层电子排布图为
原子的价层电子排布图为_______ 。
(2)区分晶态 和非晶态
和非晶态 最可靠的科学方法是
最可靠的科学方法是_______ , 与光气
与光气 反应可用于制取四氯化钛,
反应可用于制取四氯化钛, 的空间构型为
的空间构型为_______ 。
(3)Ti的一种配合物丁二酮缩邻氨基酚钛,是高性能的聚烯烃催化剂,其结构如图。______ ,其中碳原子的杂化方式为_______ 。
②该配合物中心离子是_______ ,0.5mol配合物中含 键的数目为
键的数目为_______ 。
(4)某钙钛矿型太阳能光伏电池的有机半导材料的结构如下图所示,其中A为正离子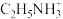 ,另两种离子为
,另两种离子为 和
和 。
。_______ 。
②与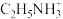 紧邻等距的
紧邻等距的 数为
数为_______ 。
③晶胞中两个最近的 之间的距离为a pm,晶胞的密度为
之间的距离为a pm,晶胞的密度为_______  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
(1)基态
 原子的价层电子排布图为
原子的价层电子排布图为(2)区分晶态
 和非晶态
和非晶态 最可靠的科学方法是
最可靠的科学方法是 与光气
与光气 反应可用于制取四氯化钛,
反应可用于制取四氯化钛, 的空间构型为
的空间构型为(3)Ti的一种配合物丁二酮缩邻氨基酚钛,是高性能的聚烯烃催化剂,其结构如图。
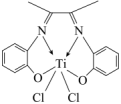
②该配合物中心离子是
 键的数目为
键的数目为(4)某钙钛矿型太阳能光伏电池的有机半导材料的结构如下图所示,其中A为正离子
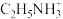 ,另两种离子为
,另两种离子为 和
和 。
。
②与
 紧邻等距的
紧邻等距的 数为
数为③晶胞中两个最近的
 之间的距离为a pm,晶胞的密度为
之间的距离为a pm,晶胞的密度为 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
解题方法
4 . 卤族元素是形成化合物的常见元素。请回答:
(1)含Na、Cl、Al三种元素的某化合物,其晶体部分结构如图所示。其化学式是___________ ,晶体类型是___________ 。错误 的是___________。
(3)一种比率光生探针M与铜离子配位,可用于小鼠脑内Cu(Ⅱ)的高时空分辨率动态成像。反应如下所示:___________ 。
②M中键角∠F-B-F___________ BF3中键角∠F-B-F(填“>”、“<”、“=”),请说明理由___________ 。
(4)在水中,氟化氢是一种弱酸,但氟化氢却是酸性很强的溶剂,其酸度与无水硫酸相当,能够给予氟化氢质子的化合物是很少的。如HNO3在HF溶剂中存在如下反应: 。则HNO3在HF溶剂中呈
。则HNO3在HF溶剂中呈___________ (填“酸性”、“中性”、“碱性”)
(1)含Na、Cl、Al三种元素的某化合物,其晶体部分结构如图所示。其化学式是

A.电负性: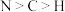 | B.第一电离能: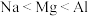 |
C.离子半径: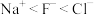 | D. 的简化电子排布式: 的简化电子排布式: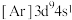 |
(3)一种比率光生探针M与铜离子配位,可用于小鼠脑内Cu(Ⅱ)的高时空分辨率动态成像。反应如下所示:
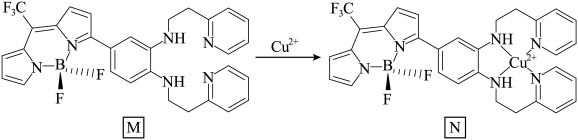
②M中键角∠F-B-F
(4)在水中,氟化氢是一种弱酸,但氟化氢却是酸性很强的溶剂,其酸度与无水硫酸相当,能够给予氟化氢质子的化合物是很少的。如HNO3在HF溶剂中存在如下反应:
 。则HNO3在HF溶剂中呈
。则HNO3在HF溶剂中呈
您最近一年使用:0次
解题方法
5 . 铜是重要的过渡金属元素,铜被广泛应用于电子工业和航天领域中。回答下列问题:
(1) 的价电子排布式为
的价电子排布式为________ 。
(2) 可以与乙二胺
可以与乙二胺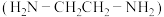 形成配离子,结构如图所示。
形成配离子,结构如图所示。________ 。
② 、
、 、
、 三种分子中,它们的键角由大到小的顺序为
三种分子中,它们的键角由大到小的顺序为________ (用分子式表示)。
(3)我国科学家制备了一种铜的配合物,结构如图所示,该配合物中四种非金属元素中第一电离能最大的是________ (填元素符号),配合物中 杂化的碳原子与
杂化的碳原子与 杂化的碳原子个数比为
杂化的碳原子个数比为________ 。________ 。
(1)
 的价电子排布式为
的价电子排布式为(2)
 可以与乙二胺
可以与乙二胺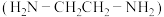 形成配离子,结构如图所示。
形成配离子,结构如图所示。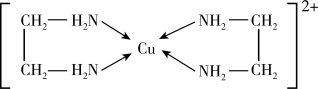
②
 、
、 、
、 三种分子中,它们的键角由大到小的顺序为
三种分子中,它们的键角由大到小的顺序为(3)我国科学家制备了一种铜的配合物,结构如图所示,该配合物中四种非金属元素中第一电离能最大的是
 杂化的碳原子与
杂化的碳原子与 杂化的碳原子个数比为
杂化的碳原子个数比为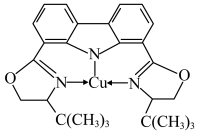
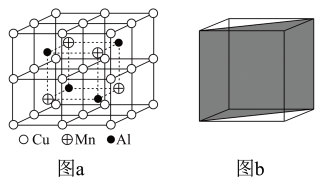
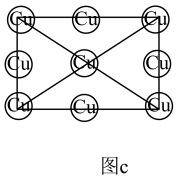
②在图c中画出Al和Mn的相对位置 表示,不考虑各原子的大小)。
表示,不考虑各原子的大小)。
您最近一年使用:0次
名校
解题方法
6 . Ⅰ.X、Y、Z、W、M、N是原子序数依次增大的前四周期元素,X的核外电子总数与其电子层数相同;Z和M同主族,W的原子序数为Y原子价电子数的3倍;基态N原子d轨道中成对电子与单电子的数目比为4∶3。由上述元素中的四种组成的两种化合物常用于合成阻燃材料,其结构简式如图所示。______ ,元素N在周期表的位置______ ,基态W原子的电子排布式为______ ,基中电子占据最高能级的电子云轮廓图为______ 形,第三周期中第一电离能均大于同周期相邻元素的是______ (填元素符号)
(2)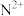 能形成配离子为八面体的配合物
能形成配离子为八面体的配合物 ,在该配合物中,
,在该配合物中,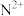 位于八面体的中心。若含0.5mol该配合物的溶液与足量
位于八面体的中心。若含0.5mol该配合物的溶液与足量 溶液反应可生成71.75g白色沉淀,则该配合物的化学式为
溶液反应可生成71.75g白色沉淀,则该配合物的化学式为______ 。
Ⅱ.芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。______ 种。有______ 个手性碳原子。
(4)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇( ,7.6℃)之间,其原因是
,7.6℃)之间,其原因是______ 。
(5)哈勃-韦斯(Haber-Weiss)原理表明,某些金属离子可以催化双氧水分解的原因是:其次外层未排满的d轨道可以存取电子,降低活化能,使分解反应容易发生。根据以上原理,下列金属离子不能催化双氧水分解的是______ 。
A. B.
B. C.
C. D.
D. E.
E.
(6)金属镍粉在CO气流中轻微加热,生成无色挥发性液体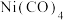 ,呈正四面体构型,易溶于下列物质中的______(填序号)。
,呈正四面体构型,易溶于下列物质中的______(填序号)。
(7) 的晶胞形状为长方体,边长分别为a nm、b nm、c nm,结构如图所示。
的晶胞形状为长方体,边长分别为a nm、b nm、c nm,结构如图所示。 个数为
个数为______ 。已知 的摩尔质量是
的摩尔质量是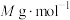 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,该晶体的密度为
,该晶体的密度为______  。(
。(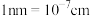 )
)

(2)
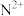 能形成配离子为八面体的配合物
能形成配离子为八面体的配合物 ,在该配合物中,
,在该配合物中,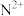 位于八面体的中心。若含0.5mol该配合物的溶液与足量
位于八面体的中心。若含0.5mol该配合物的溶液与足量 溶液反应可生成71.75g白色沉淀,则该配合物的化学式为
溶液反应可生成71.75g白色沉淀,则该配合物的化学式为Ⅱ.芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。

(4)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(
 ,7.6℃)之间,其原因是
,7.6℃)之间,其原因是(5)哈勃-韦斯(Haber-Weiss)原理表明,某些金属离子可以催化双氧水分解的原因是:其次外层未排满的d轨道可以存取电子,降低活化能,使分解反应容易发生。根据以上原理,下列金属离子不能催化双氧水分解的是
A.
 B.
B. C.
C. D.
D. E.
E.
(6)金属镍粉在CO气流中轻微加热,生成无色挥发性液体
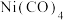 ,呈正四面体构型,易溶于下列物质中的______(填序号)。
,呈正四面体构型,易溶于下列物质中的______(填序号)。| A.水 | B. | C.NaOH溶液 | D. 溶液 溶液 |
(7)
 的晶胞形状为长方体,边长分别为a nm、b nm、c nm,结构如图所示。
的晶胞形状为长方体,边长分别为a nm、b nm、c nm,结构如图所示。
 个数为
个数为 的摩尔质量是
的摩尔质量是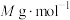 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,该晶体的密度为
,该晶体的密度为 。(
。( )
)
您最近一年使用:0次
23-24高三下·陕西西安·阶段练习
解题方法
7 . CdS、ZnS等硫化物与TiO2、SnO2、ZnO等进行复合,可以得到性能很好的复合半导体光催化剂。回答下列问题:
(1)Sn与C同主族,基态Sn原子的价层电子排布式为_______ ,基态Ti原子核外电子有_______ 种空间运动状态, 核外未成对电子数为
核外未成对电子数为_______ ,ZnS、ZnO中各元素的电负性由大到小的顺序为_______ 。
(2)许多具有—C═N—结构的分子及其硼配合物是较好的荧光材料,在光学探针、有机发光二极管等领域受到广泛关注,某两种含这种结构的分子如图1、图2所示。_______ ;图2中N原子会和B原子形成配位键,成键时_______ (填元素符号)原子提供空轨道。
(3)N、O、F三种元素的第一电离能由大到小的顺序为_______ (填元素符号),解释其原因:_______ 。
(4)钾冰晶石型晶体是一类新型的无机闪烁体,在核安全以及国土安全检查方面有重要的应用。如图是一种钾冰晶石型闪烁体的晶胞结构,属于立方晶系,其中A位是 、B位是
、B位是 、R位是正三价的Y(钇),X位是
、R位是正三价的Y(钇),X位是 。
。_______ 。
②若晶胞参数为anm,该晶体的密度为_______ g (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
(1)Sn与C同主族,基态Sn原子的价层电子排布式为
 核外未成对电子数为
核外未成对电子数为(2)许多具有—C═N—结构的分子及其硼配合物是较好的荧光材料,在光学探针、有机发光二极管等领域受到广泛关注,某两种含这种结构的分子如图1、图2所示。

(3)N、O、F三种元素的第一电离能由大到小的顺序为
(4)钾冰晶石型晶体是一类新型的无机闪烁体,在核安全以及国土安全检查方面有重要的应用。如图是一种钾冰晶石型闪烁体的晶胞结构,属于立方晶系,其中A位是
 、B位是
、B位是 、R位是正三价的Y(钇),X位是
、R位是正三价的Y(钇),X位是 。
。
②若晶胞参数为anm,该晶体的密度为
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
名校
解题方法
8 . X、Y、Z、R、W为前四周期元素,且原子序数依次增大。YZ2是红棕色气体,X、Y形成YX3,基态R原子M层与K层电子数相等,W2+的3d轨道中有9个电子,上述元素中仅有Y、Z位于同一周期。回答下列问题;
(1)基态R原子的价层轨道表示式为___________ ,
(2) 的空间结构为
的空间结构为___________ ,其中心原子的杂化方式为___________ 。
(3)稳定性:Y2___________ (填“>”、“<”或“=”)Z2,原因为___________ 。
(4)仅由X、Y两种元素可形成18电子的分子,该分子为___________ (填化学式)。
(5)仅由X、Y、Z三种元素可形成一种离子化合物,该化合物所含共价键的类型有___________ 。
(6)将W单质的粉末加入YX3的浓溶液,通入Z2,充分反应后溶液呈深蓝色,该反应的离子方程式为___________ ,从结构的角度,解释该反应可以发生的原因:___________ 。
(1)基态R原子的价层轨道表示式为
(2)
 的空间结构为
的空间结构为(3)稳定性:Y2
(4)仅由X、Y两种元素可形成18电子的分子,该分子为
(5)仅由X、Y、Z三种元素可形成一种离子化合物,该化合物所含共价键的类型有
(6)将W单质的粉末加入YX3的浓溶液,通入Z2,充分反应后溶液呈深蓝色,该反应的离子方程式为
您最近一年使用:0次
名校
解题方法
9 .  是一种常见催化剂,能催化臭氧(
是一种常见催化剂,能催化臭氧( )与烟气(
)与烟气( 、
、 )的反应。回答下列问题:
)的反应。回答下列问题:
(1)写出 和
和 原子基态价电子排布式:
原子基态价电子排布式:___________ 、___________ 。
(2) 和
和 的中心原子轨道的杂化类型为
的中心原子轨道的杂化类型为___________ 、___________ 。
(3) 和
和 中所含元素的第一电离能由大到小的顺序是
中所含元素的第一电离能由大到小的顺序是___________ 。两种微粒的空间构型分别为___________ 、___________ 。
(4) 与
与 生成的
生成的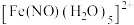 ,画出生成的
,画出生成的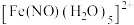 的结构简式,并用“
的结构简式,并用“ ”标出所有配位键:
”标出所有配位键:___________ 。
(5)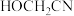 分子中含有的
分子中含有的 键和
键和 键的数目之比为
键的数目之比为___________ 。
(6)一种可吸收甲醛材料,其化学式为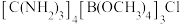 ,部分晶体结构如下图所示:
,部分晶体结构如下图所示: 为平面结构。
为平面结构。
①该材料包含的化学键类型有___________ 。
②组成该材料的 三元素的电负性由大到小的顺序是
三元素的电负性由大到小的顺序是___________ 。
(7)某高温超导材料,其晶胞结构如图所示,该立方晶胞参数为apm。阿伏加德罗常数的值为 。
。___________ 。
②该晶体的密度为___________ 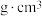 。
。
 是一种常见催化剂,能催化臭氧(
是一种常见催化剂,能催化臭氧( )与烟气(
)与烟气( 、
、 )的反应。回答下列问题:
)的反应。回答下列问题:(1)写出
 和
和 原子基态价电子排布式:
原子基态价电子排布式:(2)
 和
和 的中心原子轨道的杂化类型为
的中心原子轨道的杂化类型为(3)
 和
和 中所含元素的第一电离能由大到小的顺序是
中所含元素的第一电离能由大到小的顺序是(4)
 与
与 生成的
生成的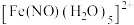 ,画出生成的
,画出生成的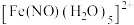 的结构简式,并用“
的结构简式,并用“ ”标出所有配位键:
”标出所有配位键:(5)
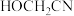 分子中含有的
分子中含有的 键和
键和 键的数目之比为
键的数目之比为(6)一种可吸收甲醛材料,其化学式为
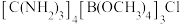 ,部分晶体结构如下图所示:
,部分晶体结构如下图所示: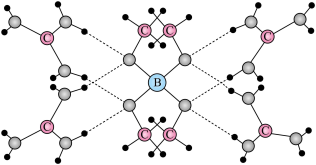
 为平面结构。
为平面结构。①该材料包含的化学键类型有
②组成该材料的
 三元素的电负性由大到小的顺序是
三元素的电负性由大到小的顺序是(7)某高温超导材料,其晶胞结构如图所示,该立方晶胞参数为apm。阿伏加德罗常数的值为
 。
。
②该晶体的密度为
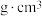 。
。
您最近一年使用:0次
10 . 结构决定性质是化学的基本原理,结构的细微差异会导致物质化学性质变化。回答下列问题:
(1) 是一种离子晶体,其中Au的化合价为
是一种离子晶体,其中Au的化合价为 ,晶体中的阳离子的离子符号为
,晶体中的阳离子的离子符号为______ ; 低温时生成一种暗红色粉末和两种气体,其中氧化性较强的气体的化学式为
低温时生成一种暗红色粉末和两种气体,其中氧化性较强的气体的化学式为______ 。金元素形成的部分离子氧化性很强,与“6s惰性电子对”效应有关,即失去6s电子对的离子会具有很强的氧化性。下列选项中具有此效应的离子是______ (填序号)。
A. B.
B. C.
C. D.
D.
(2)吡咯( )具有芳香性,分子中存在大
)具有芳香性,分子中存在大 键,1 mol吡咯分子中
键,1 mol吡咯分子中 键数目为
键数目为______ 。用氧原子(或硫原子)替代吡咯中的氮原子可以得到呋喃(或噻吩分子),则呋喃分子的键线式为______ ;分子结构中的大 键电子云分布越均匀,物质的芳香性越强,请比较噻吩和呋喃的芳香性并解释原因
键电子云分布越均匀,物质的芳香性越强,请比较噻吩和呋喃的芳香性并解释原因______ 。
(3)将钴氧化物和 按适量的比例混合,将混合物高温煅烧可得到钴蓝(过程中无化学变化),钴蓝可用于青花瓷的颜料。钴蓝晶体是由图甲所示的结构构成。图甲包含Ⅰ型和Ⅱ型两种小立方体。图乙是钴蓝的晶胞,已知该晶胞的顶点和面心为钴原子。
按适量的比例混合,将混合物高温煅烧可得到钴蓝(过程中无化学变化),钴蓝可用于青花瓷的颜料。钴蓝晶体是由图甲所示的结构构成。图甲包含Ⅰ型和Ⅱ型两种小立方体。图乙是钴蓝的晶胞,已知该晶胞的顶点和面心为钴原子。 的比例为
的比例为______ ;
②图乙所示字母中,Ⅰ型小立方体分别是a、______ (填字母符号)。
(1)
 是一种离子晶体,其中Au的化合价为
是一种离子晶体,其中Au的化合价为 ,晶体中的阳离子的离子符号为
,晶体中的阳离子的离子符号为 低温时生成一种暗红色粉末和两种气体,其中氧化性较强的气体的化学式为
低温时生成一种暗红色粉末和两种气体,其中氧化性较强的气体的化学式为A.
 B.
B. C.
C. D.
D.
(2)吡咯(
 )具有芳香性,分子中存在大
)具有芳香性,分子中存在大 键,1 mol吡咯分子中
键,1 mol吡咯分子中 键数目为
键数目为 键电子云分布越均匀,物质的芳香性越强,请比较噻吩和呋喃的芳香性并解释原因
键电子云分布越均匀,物质的芳香性越强,请比较噻吩和呋喃的芳香性并解释原因(3)将钴氧化物和
 按适量的比例混合,将混合物高温煅烧可得到钴蓝(过程中无化学变化),钴蓝可用于青花瓷的颜料。钴蓝晶体是由图甲所示的结构构成。图甲包含Ⅰ型和Ⅱ型两种小立方体。图乙是钴蓝的晶胞,已知该晶胞的顶点和面心为钴原子。
按适量的比例混合,将混合物高温煅烧可得到钴蓝(过程中无化学变化),钴蓝可用于青花瓷的颜料。钴蓝晶体是由图甲所示的结构构成。图甲包含Ⅰ型和Ⅱ型两种小立方体。图乙是钴蓝的晶胞,已知该晶胞的顶点和面心为钴原子。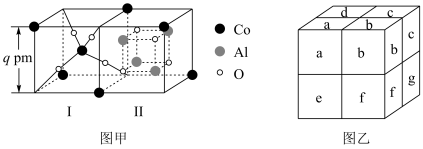
 的比例为
的比例为②图乙所示字母中,Ⅰ型小立方体分别是a、
您最近一年使用:0次



