名校
解题方法
1 . 铁及其化合物在生产生活中应用非常广泛.回答下列问题:
(1)铁元素位于周期表第四周期第____________ 族;下列状态的铁中,电离最外层一个电子所需能量最大的是____________ (填标号). 的含量,适宜
的含量,适宜 范围为2~9,反应原理为
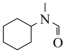
范围为2~9,反应原理为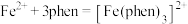 .邻二氮菲(平面形)与琥珀酸亚铁结构简式如图.下列说法正确的是____________.
.邻二氮菲(平面形)与琥珀酸亚铁结构简式如图.下列说法正确的是____________.
(3)铁的一种配合物的化学式为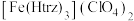 ,配体
,配体 为三氮唑(
为三氮唑(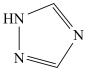 ).
).
① 的键角
的键角____________ (填“等于”、“大于”或“小于”) 的键角.
的键角. 的VSEPR模型为
的VSEPR模型为____________ .
②Htrz分子为平面结构, 原子的杂化轨道类型为
原子的杂化轨道类型为____________ ,连接氢原子的氮原子在形成Htrz分子中的大 键时提供的电子数是
键时提供的电子数是____________ .
(1)铁元素位于周期表第四周期第
A.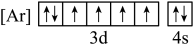 B.
B.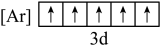
C. 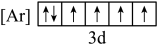 D.
D.
 的含量,适宜
的含量,适宜 范围为2~9,反应原理为
范围为2~9,反应原理为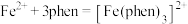 .邻二氮菲(平面形)与琥珀酸亚铁结构简式如图.下列说法正确的是____________.
.邻二氮菲(平面形)与琥珀酸亚铁结构简式如图.下列说法正确的是____________.
| A.琥珀酸不具有旋光性 |
B. 中, 中, 的配位数为3 的配位数为3 |
C.当 时,邻二氮菲中的 时,邻二氮菲中的 会优先与 会优先与 形成配位键 形成配位键 |
D.邻二氮菲中 原子的孤电子对占据 原子的孤电子对占据 轨道 轨道 |
(3)铁的一种配合物的化学式为
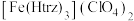 ,配体
,配体 为三氮唑(
为三氮唑( ).
).①
 的键角
的键角 的键角.
的键角. 的VSEPR模型为
的VSEPR模型为②Htrz分子为平面结构,
 原子的杂化轨道类型为
原子的杂化轨道类型为 键时提供的电子数是
键时提供的电子数是
您最近一年使用:0次
名校
解题方法
2 . 治疗心力衰竭药物沙库巴曲的合成路线如下:_______ 。
(2)A→B的反应中,已知NaClO被还原为NaCl,理论上反应 物质A,至少需要NaClO的物质的量为
物质A,至少需要NaClO的物质的量为_______ 。
(3)B的结构简式是_______ 。
(4)D→E中步骤i反应的化学方程式是_______ 。
(5)E→F反应类型是_______ ,F→G反应类型是_______ 。
(6)G与H生成沙库巴曲的反应原子利用率为100%,H分子中只有一种化学环境的氢。
①下列关于H的说法正确的是_______ (填字母序号)。
a.分子式为C4H4O3
b.分子中所有碳原子的杂化类型均相同
c.官能团为酯基和酮羰基
d.存在同时含有碳碳三键、羧基和羟基的同分异构体
已知i.
ⅱ.C2H2与甲醛反应和苯酚与甲醛反应类型相同,且产物中包含相同种类官能团。
请参照题干合成路线的表示方法,设计以C2H2、HCHO为有机原料(无机原料任选)合成H的路线_______ 。
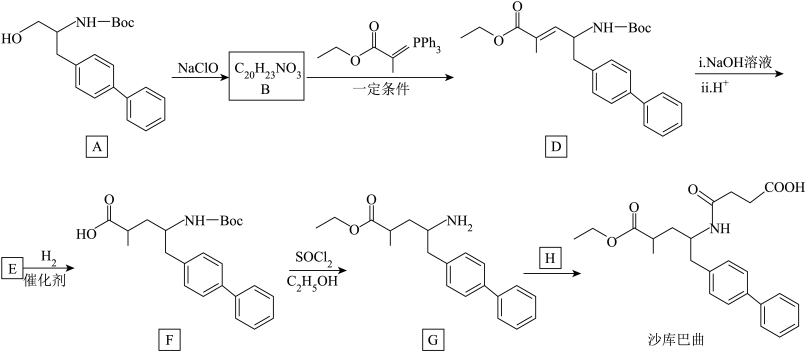
已知:-Boc结构简式为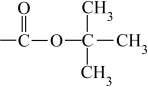
(2)A→B的反应中,已知NaClO被还原为NaCl,理论上反应
 物质A,至少需要NaClO的物质的量为
物质A,至少需要NaClO的物质的量为(3)B的结构简式是
(4)D→E中步骤i反应的化学方程式是
(5)E→F反应类型是
(6)G与H生成沙库巴曲的反应原子利用率为100%,H分子中只有一种化学环境的氢。
①下列关于H的说法正确的是
a.分子式为C4H4O3
b.分子中所有碳原子的杂化类型均相同
c.官能团为酯基和酮羰基
d.存在同时含有碳碳三键、羧基和羟基的同分异构体
②H与另一有机物I在一定条件下可以反应生成聚合物PBS(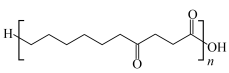 ),写出该反应的化学方程式
),写出该反应的化学方程式
已知i.

ⅱ.C2H2与甲醛反应和苯酚与甲醛反应类型相同,且产物中包含相同种类官能团。
请参照题干合成路线的表示方法,设计以C2H2、HCHO为有机原料(无机原料任选)合成H的路线

您最近一年使用:0次
解题方法
3 . 短周期主族元素X、Y、Z、G、T、W的原子序数依次增大,X基态原子S能级上的电子数是P能级上电子数的2倍,Y的基态原子有两个未成对的电子,Z在同周期主族元素中原子半径最大,T的原子序数是Y的两倍,G的基态原子有7种空间运动状态不同的电子。回答下列问题:
(1)W元素在周期表中的位置是______ ,属于______ 区。
(2)Y、Z、G的简单离子半径由大到小的顺序是______ (填离子符号)。
(3)X的一种氢化物相对分子质量为26,请写出实验室制备它的化学方程式______ 。
(4) 分子是
分子是______ (填“极性”或“非极性”)分子。 分子中T的杂化形式为
分子中T的杂化形式为______ 。
(5)Y和Z能形成既含离子键,又含共价键的化合物,其电子式为______ 。
(6)V是由Y、Z、T组成的常见化合物,V的水溶液呈中性。则V的阴离子的空间构型为______ 。
(7)T的单质有多种同素异形体,其中一种的结构如图所示, ,这种单质易溶于X与W形成的一种常见溶剂
,这种单质易溶于X与W形成的一种常见溶剂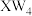 中,其原因是
中,其原因是______ 。
(1)W元素在周期表中的位置是
(2)Y、Z、G的简单离子半径由大到小的顺序是
(3)X的一种氢化物相对分子质量为26,请写出实验室制备它的化学方程式
(4)
 分子是
分子是 分子中T的杂化形式为
分子中T的杂化形式为(5)Y和Z能形成既含离子键,又含共价键的化合物,其电子式为
(6)V是由Y、Z、T组成的常见化合物,V的水溶液呈中性。则V的阴离子的空间构型为
(7)T的单质有多种同素异形体,其中一种的结构如图所示,
 ,这种单质易溶于X与W形成的一种常见溶剂
,这种单质易溶于X与W形成的一种常见溶剂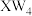 中,其原因是
中,其原因是
您最近一年使用:0次
名校
解题方法
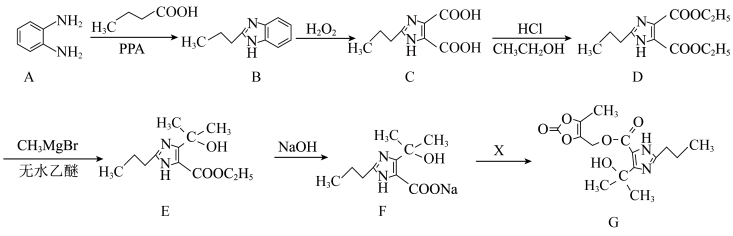
4 . 葡萄糖酸锌是一种常见的补锌药物,常用葡萄糖酸和ZnSO4反应制备。
(1)Zn2+基态核外电子排布式为_______ 。
(2)SO2的空间构型为_______ (用文字描述),键角:
_______  (填“>”“<”或“=”),理由:
(填“>”“<”或“=”),理由:_______ 。
(3)Zn2+与NH3能形成[Zn(NH3)4]2+,1mol[Zn(NH3)4]2+中含有的σ键的数目为_______ 。
(4)葡萄糖酸的分子结构如下图所示,推测葡萄糖酸在水中的溶解性:_______ (填“难溶于水”或“易溶于水”)。_______ 。最近的两个Zn2+的距离为apm,阿伏加德罗常数为NA,则ZnS晶体的密度为_______ 。(列计算式)
(1)Zn2+基态核外电子排布式为
(2)SO2的空间构型为

 (填“>”“<”或“=”),理由:
(填“>”“<”或“=”),理由:(3)Zn2+与NH3能形成[Zn(NH3)4]2+,1mol[Zn(NH3)4]2+中含有的σ键的数目为
(4)葡萄糖酸的分子结构如下图所示,推测葡萄糖酸在水中的溶解性:
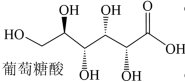

您最近一年使用:0次
名校
5 . 随着科学的发展,氟及其化合物的用途日益广泛。
I.离子液体具有电导率高、化学稳定性高等优点,在电化学领域用途广泛。某离子液体的结构简式如图。 是制备此离子液体的原料。
是制备此离子液体的原料。
(1)微粒中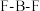 键角:
键角:
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2) 可以与
可以与 反应生成
反应生成 的原因是
的原因是___________ 。
Ⅱ.氟化镁钾( )是一种具有优良光学性能的材料,其晶胞结构如下。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。
)是一种具有优良光学性能的材料,其晶胞结构如下。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。 晶体中,每个
晶体中,每个 周围有
周围有___________ 个距离最近的F。
(4) 半径与
半径与 接近,将
接近,将 部分由
部分由 取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。
取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。
①基态 价电子的轨道表示式为
价电子的轨道表示式为___________ 。
②某实验室合成新型催化剂材料 (
( 是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。已知晶胞棱长为
是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。已知晶胞棱长为 。若要合成厚度为
。若要合成厚度为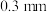 、面积为
、面积为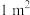 的催化剂材料,理论上需要掺杂的
的催化剂材料,理论上需要掺杂的 约为
约为___________  (
(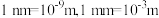 ,阿伏加德罗常数约为
,阿伏加德罗常数约为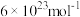 )。
)。
(5)我国科研工作者以 晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的
晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的 晶体。其框架中的
晶体。其框架中的 由
由 取代,
取代, 位置嵌入有机阳离子
位置嵌入有机阳离子 ,
, 位置沿棱方向嵌入直线型
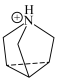
位置沿棱方向嵌入直线型 。已知
。已知 与
与 的结构简式如下:
的结构简式如下: 中N原子的杂化方式为
中N原子的杂化方式为___________ , 中心N原子的杂化方式为
中心N原子的杂化方式为___________ 。
② 的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在着其他相互作用。如邻近的
的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在着其他相互作用。如邻近的 与
与 还存在着
还存在着___________ ,上述相互作用不会随 的转动改变。
的转动改变。
I.离子液体具有电导率高、化学稳定性高等优点,在电化学领域用途广泛。某离子液体的结构简式如图。
 是制备此离子液体的原料。
是制备此离子液体的原料。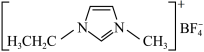
(1)微粒中
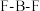 键角:
键角:
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(2)
 可以与
可以与 反应生成
反应生成 的原因是
的原因是Ⅱ.氟化镁钾(
 )是一种具有优良光学性能的材料,其晶胞结构如下。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。
)是一种具有优良光学性能的材料,其晶胞结构如下。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。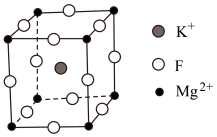
 晶体中,每个
晶体中,每个 周围有
周围有(4)
 半径与
半径与 接近,将
接近,将 部分由
部分由 取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。
取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。①基态
 价电子的轨道表示式为
价电子的轨道表示式为②某实验室合成新型催化剂材料
 (
( 是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。已知晶胞棱长为
是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。已知晶胞棱长为 。若要合成厚度为
。若要合成厚度为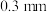 、面积为
、面积为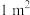 的催化剂材料,理论上需要掺杂的
的催化剂材料,理论上需要掺杂的 约为
约为 (
(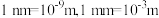 ,阿伏加德罗常数约为
,阿伏加德罗常数约为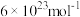 )。
)。(5)我国科研工作者以
 晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的
晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的 晶体。其框架中的
晶体。其框架中的 由
由 取代,
取代, 位置嵌入有机阳离子
位置嵌入有机阳离子 ,
, 位置沿棱方向嵌入直线型
位置沿棱方向嵌入直线型 。已知
。已知 与
与 的结构简式如下:
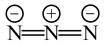
的结构简式如下: :
:
 :
:
 中N原子的杂化方式为
中N原子的杂化方式为 中心N原子的杂化方式为
中心N原子的杂化方式为②
 的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在着其他相互作用。如邻近的
的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在着其他相互作用。如邻近的 与
与 还存在着
还存在着 的转动改变。
的转动改变。
您最近一年使用:0次
6 . 化合物G是合成治疗降压药奥美沙坦酯的一种中间体,其合成路线如下: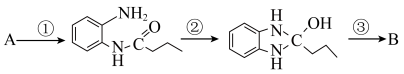
步骤③的反应类型为________ 。
(2)化合物B中 、
、 杂化的碳原子数目之比为
杂化的碳原子数目之比为________ 。
(3)X的分子式为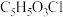 ,写出X的结构简式:
,写出X的结构简式:________ 。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:________ 。能与 溶液发生显色反应,分子中含有3种不同化学环境的氢原子。
溶液发生显色反应,分子中含有3种不同化学环境的氢原子。
(5)已知:① ;②
;②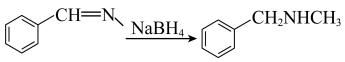

步骤③的反应类型为
(2)化合物B中
 、
、 杂化的碳原子数目之比为
杂化的碳原子数目之比为(3)X的分子式为
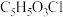 ,写出X的结构简式:
,写出X的结构简式:(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:
 溶液发生显色反应,分子中含有3种不同化学环境的氢原子。
溶液发生显色反应,分子中含有3种不同化学环境的氢原子。(5)已知:①
 ;②
;②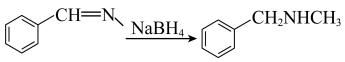
写出以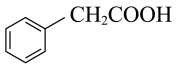 、和
、和 为原料制备
为原料制备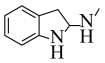 的合成路线流程图
的合成路线流程图
您最近一年使用:0次
名校
解题方法
7 . 局部麻醉药普鲁卡因的一种合成路线如图:
(1)A的结构简式是_______ ,化合物B中氮原子的杂化轨道类型是______ 。
(2)反应①~⑥中,属于取代反应的是_______ 。
(3)第③步反应的化学方程式是_______ 。
(4)第⑤步反应的化学方程式是________ 。
(5)与 含碳量相同,相对分子质量为56的物质,分子式为
含碳量相同,相对分子质量为56的物质,分子式为 _______ ,该物质可能有_____ 种结构(不考虑立体异构)。
分别写出满足下列条件的结构:
①能使溴水褪色,且有一条支链的分子,其名称为______ (系统命名法)。
②具有顺反异构体的分子,写出其顺式结构______ 。
(6)已知除醛基外,HCOOR的结构也能发生银镜反应,则 的同分异构体中含有硝基、苯环且能发生银镜反应的有
的同分异构体中含有硝基、苯环且能发生银镜反应的有______ 种,其中核磁共振氢谱显示3组峰,峰面积之比为  的同分异构体结构简式是
的同分异构体结构简式是_______ 。

已知: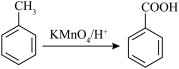
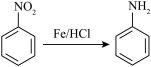
(1)A的结构简式是
(2)反应①~⑥中,属于取代反应的是
(3)第③步反应的化学方程式是
(4)第⑤步反应的化学方程式是
(5)与
 含碳量相同,相对分子质量为56的物质,分子式为
含碳量相同,相对分子质量为56的物质,分子式为 分别写出满足下列条件的结构:
①能使溴水褪色,且有一条支链的分子,其名称为
②具有顺反异构体的分子,写出其顺式结构
(6)已知除醛基外,HCOOR的结构也能发生银镜反应,则
 的同分异构体中含有硝基、苯环且能发生银镜反应的有
的同分异构体中含有硝基、苯环且能发生银镜反应的有 的同分异构体结构简式是
的同分异构体结构简式是
您最近一年使用:0次
名校
解题方法
8 . 钴及其化合物在工业生产中具有广泛的用途,特别是作为工业生产的催化剂,钴及其化合物发挥了重要的作用。请回答下列问题:
(1)钴及其化合物广泛用作催化剂,说明钴元素在元素周期表中的位置为_______(填字母)。
(2)中国科学院院士、大连化学物理研究所研究员张涛及其团队开发出新型双原子催化剂(DACs),在丙烷脱氢性能上,该新型双原子催化剂优于单原子催化剂,其催化原理如图所示:_______ ,N原子为 杂化,未杂化的p轨道中容纳的电子数为
杂化,未杂化的p轨道中容纳的电子数为_______ 个;Zn或Co与N原子形成配位键时,提供孤电子对的原子是_______ (填元素符号);丙烷分解为丙烯的过程中,形成的化学键有_______ (填字母)。
A. 键 B.σ键 C.π键
键 B.σ键 C.π键
(3)CoO是石油化工中的一种催化剂,一种CoO的晶胞结构如图所示,该立方晶胞边长为a pm,设阿伏加德罗常数的值为 。
。 的分数坐标为
的分数坐标为_______ ;每个 周围与其距离最近且相等的
周围与其距离最近且相等的 共有
共有_______ 个;该CoO晶体的密度是_______ g⋅cm (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
(1)钴及其化合物广泛用作催化剂,说明钴元素在元素周期表中的位置为_______(填字母)。
| A.主族元素 | B.金属与非金属分界线 |
| C.稀土元素 | D.过渡金属元素 |
(2)中国科学院院士、大连化学物理研究所研究员张涛及其团队开发出新型双原子催化剂(DACs),在丙烷脱氢性能上,该新型双原子催化剂优于单原子催化剂,其催化原理如图所示:

 杂化,未杂化的p轨道中容纳的电子数为
杂化,未杂化的p轨道中容纳的电子数为A.
 键 B.σ键 C.π键
键 B.σ键 C.π键(3)CoO是石油化工中的一种催化剂,一种CoO的晶胞结构如图所示,该立方晶胞边长为a pm,设阿伏加德罗常数的值为
 。
。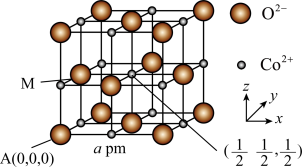
 的分数坐标为
的分数坐标为 周围与其距离最近且相等的
周围与其距离最近且相等的 共有
共有 (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2024-05-07更新
|
102次组卷
|
2卷引用:2024届海南省琼海市嘉积中学高三下学期模拟预测化学试题
名校
9 . 碳中和、碳循环是科学家们研究的热门课题,一种以CO2为碳源和胺类化合物合成甲基红(化合物ⅷ)的路线如图所示(加料顺序、反应条件略): 结构)与胺类或酚类发生偶合反应,偶合位置优先选择氨基或酚羟基的对位。
结构)与胺类或酚类发生偶合反应,偶合位置优先选择氨基或酚羟基的对位。
回答下列问题:
(1)化合物ⅰ的分子式为______ ;芳香族化合物x为化合物ⅰ的同分异构体,其核磁共振氢谱有4组峰,则x的结构简式为______ ,其化学名称为______ 。
(2)反应①中,除了生成化合物ⅱ外,还有另外一种产物y为______ (填化学式)。
(3)根据化合物ⅱ的结构特征,分析预测其可能的化学性质,完成下表。
(4)下列关于反应⑤的说法正确的有______(填选项字母)。
(5)以苯为含碳原料,利用上述有机合成路线的原理,合成化合物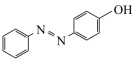 ,基于你设计的合成路线,回答下列问题:
,基于你设计的合成路线,回答下列问题:
①最后一步反应的化学方程式为______ .
②相关步骤涉及卤代烃制酚的反应,写出该反应第一步的化学方程式:______ .
③从苯出发制重氮盐,经过第一步反应得到的产物为______ (填结构简式)。

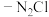 结构)与胺类或酚类发生偶合反应,偶合位置优先选择氨基或酚羟基的对位。
结构)与胺类或酚类发生偶合反应,偶合位置优先选择氨基或酚羟基的对位。回答下列问题:
(1)化合物ⅰ的分子式为
(2)反应①中,除了生成化合物ⅱ外,还有另外一种产物y为
(3)根据化合物ⅱ的结构特征,分析预测其可能的化学性质,完成下表。
| 序号 | 反应试剂、条件 | 反应形成的新结构 | 反应类型 |
| a |
| ||
| b | 水解反应 |
A.反应⑤中,有 键和 键和 键的断裂 键的断裂 |
| B.反应物ⅵ中,C原子和N原子的杂化方式完全相同 |
| C.产物ⅶ中,不存在手性碳原子 |
D.反应⑤的另一种产物z属于极性分子,存在仅由p轨道“头碰头”形成的 键 键 |
 ,基于你设计的合成路线,回答下列问题:
,基于你设计的合成路线,回答下列问题:①最后一步反应的化学方程式为
②相关步骤涉及卤代烃制酚的反应,写出该反应第一步的化学方程式:
③从苯出发制重氮盐,经过第一步反应得到的产物为
您最近一年使用:0次
名校
解题方法
10 .  、
、 是新型磁性材料的成分,设
是新型磁性材料的成分,设 为阿伏加德罗常数的值,依据其中有关元素回答问题:
为阿伏加德罗常数的值,依据其中有关元素回答问题:
(1)钕(Nd)属于镧系元素,则其在元素周期表中处于___________ 区, 的价电子排布图为
的价电子排布图为___________ 。
(2) 的立体构型为
的立体构型为___________ ;F原子核外有___________ 种不同空间运动状态的电子。
(3) 是一种还原剂,B原子的杂化方式为
是一种还原剂,B原子的杂化方式为___________ 。该物质中是否存在配位键___________ (填“是”或“否”)。
(4) 的钙钛矿型晶胞结构如图所示,其中Co填充在F形成的正八面体中心。
的钙钛矿型晶胞结构如图所示,其中Co填充在F形成的正八面体中心。___________ 。
②该晶体密度为 ,则K和Co之间的最短距离为
,则K和Co之间的最短距离为___________ pm。
(5) 的制备:称取研细的
的制备:称取研细的 和
和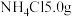 于烧杯中溶解;将溶液转入三颈烧瓶,分液漏斗中分别装有25mL浓氨水、5mL30%的
于烧杯中溶解;将溶液转入三颈烧瓶,分液漏斗中分别装有25mL浓氨水、5mL30%的 溶液,控制反应温度为60℃,打开分液漏斗,反应一段时间后,得
溶液,控制反应温度为60℃,打开分液漏斗,反应一段时间后,得 溶液。写出该反应的离子方程式
溶液。写出该反应的离子方程式___________ 。若上述实验过程中得到 ,则其中所含的
,则其中所含的 键数目为
键数目为___________ 。
(6)已知某温度下 的电离平衡常数:
的电离平衡常数: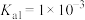 、
、 ,
,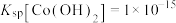 、
、 。写出该温度时向
。写出该温度时向 碳酸钠溶液中逐滴加入
碳酸钠溶液中逐滴加入 溶液,生成沉淀的离子方程式:
溶液,生成沉淀的离子方程式:___________ 。
 、
、 是新型磁性材料的成分,设
是新型磁性材料的成分,设 为阿伏加德罗常数的值,依据其中有关元素回答问题:
为阿伏加德罗常数的值,依据其中有关元素回答问题:(1)钕(Nd)属于镧系元素,则其在元素周期表中处于
 的价电子排布图为
的价电子排布图为(2)
 的立体构型为
的立体构型为(3)
 是一种还原剂,B原子的杂化方式为
是一种还原剂,B原子的杂化方式为(4)
 的钙钛矿型晶胞结构如图所示,其中Co填充在F形成的正八面体中心。
的钙钛矿型晶胞结构如图所示,其中Co填充在F形成的正八面体中心。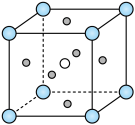
②该晶体密度为
 ,则K和Co之间的最短距离为
,则K和Co之间的最短距离为(5)
 的制备:称取研细的
的制备:称取研细的 和
和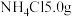 于烧杯中溶解;将溶液转入三颈烧瓶,分液漏斗中分别装有25mL浓氨水、5mL30%的
于烧杯中溶解;将溶液转入三颈烧瓶,分液漏斗中分别装有25mL浓氨水、5mL30%的 溶液,控制反应温度为60℃,打开分液漏斗,反应一段时间后,得
溶液,控制反应温度为60℃,打开分液漏斗,反应一段时间后,得 溶液。写出该反应的离子方程式
溶液。写出该反应的离子方程式 ,则其中所含的
,则其中所含的 键数目为
键数目为(6)已知某温度下
 的电离平衡常数:
的电离平衡常数: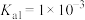 、
、 ,
,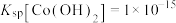 、
、 。写出该温度时向
。写出该温度时向 碳酸钠溶液中逐滴加入
碳酸钠溶液中逐滴加入 溶液,生成沉淀的离子方程式:
溶液,生成沉淀的离子方程式:
您最近一年使用:0次