名校
1 . 苯、甲苯,乙苯、二甲苯等均是重要的芳香族化合物。回答下列问题:
(1)苯的实验式为___________ 。
(2)1mol苯与3molH2发生加成反应,碳的杂化类型由___________ ,转化为___________ 。
(3)甲苯的一氯代物有___________ 种,由甲苯制备2,4,6-三硝基甲苯(TNT)的化学方程式为___________ 。
(4)向对二甲苯中加入足量酸性高锰酸钾溶液,生成的有机物中的官能团名称___________ 。
(5)如图是某同学设计的制取少量溴苯(熔点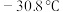 ,沸点
,沸点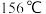 )的装置。实验时,打开K,向圆底烧瓶中滴加苯和溴的混合液,发现a中有微沸现象,b中的液体逐渐变为浅红色,c中有少量气泡产生,反应结束后,对a中的液体进行后续处理即可获得溴苯。
)的装置。实验时,打开K,向圆底烧瓶中滴加苯和溴的混合液,发现a中有微沸现象,b中的液体逐渐变为浅红色,c中有少量气泡产生,反应结束后,对a中的液体进行后续处理即可获得溴苯。___________ 。
②该实验___________ (填“放热”或“吸热”)。
③c中看到的现象证明___________ 。
④得到粗溴苯后,用如下操作进行精制:
①水洗 ②蒸馏 ③用干燥剂干燥 ④10%NaOH溶液洗
正确的操作顺序是___________ (填序号)。
A.①②③④② B.②④②③① C.④①③①② D.①④①③②
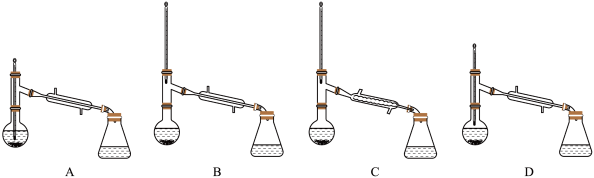
⑤进行蒸馏操作中,仪器选择及安装(夹持及加热装置已省略)均正确的是___________ (填字母)。
(1)苯的实验式为
(2)1mol苯与3molH2发生加成反应,碳的杂化类型由
(3)甲苯的一氯代物有
(4)向对二甲苯中加入足量酸性高锰酸钾溶液,生成的有机物中的官能团名称
(5)如图是某同学设计的制取少量溴苯(熔点
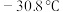 ,沸点
,沸点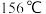 )的装置。实验时,打开K,向圆底烧瓶中滴加苯和溴的混合液,发现a中有微沸现象,b中的液体逐渐变为浅红色,c中有少量气泡产生,反应结束后,对a中的液体进行后续处理即可获得溴苯。
)的装置。实验时,打开K,向圆底烧瓶中滴加苯和溴的混合液,发现a中有微沸现象,b中的液体逐渐变为浅红色,c中有少量气泡产生,反应结束后,对a中的液体进行后续处理即可获得溴苯。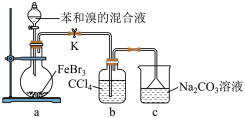
②该实验
③c中看到的现象证明
④得到粗溴苯后,用如下操作进行精制:
①水洗 ②蒸馏 ③用干燥剂干燥 ④10%NaOH溶液洗
正确的操作顺序是
A.①②③④② B.②④②③① C.④①③①② D.①④①③②
⑤进行蒸馏操作中,仪器选择及安装(夹持及加热装置已省略)均正确的是
您最近一年使用:0次
2024-05-21更新
|
207次组卷
|
2卷引用:山西省运城市三晋卓越联盟2023-2024学年高二下学期期中考试化学试题
解题方法
2 . 铜是重要的过渡金属元素,铜被广泛应用于电子工业和航天领域中。回答下列问题:
(1) 的价电子排布式为
的价电子排布式为________ 。
(2) 可以与乙二胺
可以与乙二胺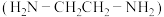 形成配离子,结构如图所示。
形成配离子,结构如图所示。________ 。
② 、
、 、
、 三种分子中,它们的键角由大到小的顺序为
三种分子中,它们的键角由大到小的顺序为________ (用分子式表示)。
(3)我国科学家制备了一种铜的配合物,结构如图所示,该配合物中四种非金属元素中第一电离能最大的是________ (填元素符号),配合物中 杂化的碳原子与
杂化的碳原子与 杂化的碳原子个数比为
杂化的碳原子个数比为________ 。________ 。
(1)
 的价电子排布式为
的价电子排布式为(2)
 可以与乙二胺
可以与乙二胺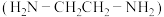 形成配离子,结构如图所示。
形成配离子,结构如图所示。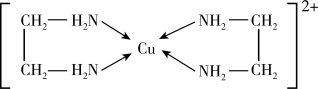
②
 、
、 、
、 三种分子中,它们的键角由大到小的顺序为
三种分子中,它们的键角由大到小的顺序为(3)我国科学家制备了一种铜的配合物,结构如图所示,该配合物中四种非金属元素中第一电离能最大的是
 杂化的碳原子与
杂化的碳原子与 杂化的碳原子个数比为
杂化的碳原子个数比为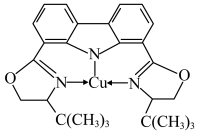
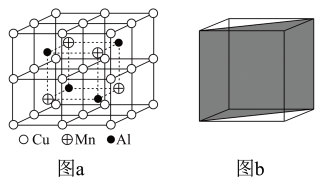
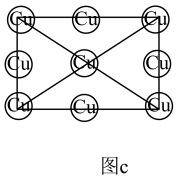
②在图c中画出Al和Mn的相对位置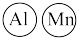 表示,不考虑各原子的大小)。
表示,不考虑各原子的大小)。
您最近一年使用:0次
名校
解题方法
3 . Ⅰ.X、Y、Z、W、M、N是原子序数依次增大的前四周期元素,X的核外电子总数与其电子层数相同;Z和M同主族,W的原子序数为Y原子价电子数的3倍;基态N原子d轨道中成对电子与单电子的数目比为4∶3。由上述元素中的四种组成的两种化合物常用于合成阻燃材料,其结构简式如图所示。______ ,元素N在周期表的位置______ ,基态W原子的电子排布式为______ ,基中电子占据最高能级的电子云轮廓图为______ 形,第三周期中第一电离能均大于同周期相邻元素的是______ (填元素符号)
(2)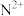 能形成配离子为八面体的配合物
能形成配离子为八面体的配合物 ,在该配合物中,
,在该配合物中,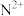 位于八面体的中心。若含0.5mol该配合物的溶液与足量
位于八面体的中心。若含0.5mol该配合物的溶液与足量 溶液反应可生成71.75g白色沉淀,则该配合物的化学式为
溶液反应可生成71.75g白色沉淀,则该配合物的化学式为______ 。
Ⅱ.芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。______ 种。有______ 个手性碳原子。
(4)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇( ,7.6℃)之间,其原因是
,7.6℃)之间,其原因是______ 。
(5)哈勃-韦斯(Haber-Weiss)原理表明,某些金属离子可以催化双氧水分解的原因是:其次外层未排满的d轨道可以存取电子,降低活化能,使分解反应容易发生。根据以上原理,下列金属离子不能催化双氧水分解的是______ 。
A. B.
B. C.
C. D.
D. E.
E.
(6)金属镍粉在CO气流中轻微加热,生成无色挥发性液体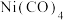 ,呈正四面体构型,易溶于下列物质中的______(填序号)。
,呈正四面体构型,易溶于下列物质中的______(填序号)。
(7) 的晶胞形状为长方体,边长分别为a nm、b nm、c nm,结构如图所示。
的晶胞形状为长方体,边长分别为a nm、b nm、c nm,结构如图所示。 个数为
个数为______ 。已知 的摩尔质量是
的摩尔质量是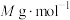 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,该晶体的密度为
,该晶体的密度为______  。(
。( )
)

(2)
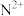 能形成配离子为八面体的配合物
能形成配离子为八面体的配合物 ,在该配合物中,
,在该配合物中,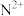 位于八面体的中心。若含0.5mol该配合物的溶液与足量
位于八面体的中心。若含0.5mol该配合物的溶液与足量 溶液反应可生成71.75g白色沉淀,则该配合物的化学式为
溶液反应可生成71.75g白色沉淀,则该配合物的化学式为Ⅱ.芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。

(4)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(
 ,7.6℃)之间,其原因是
,7.6℃)之间,其原因是(5)哈勃-韦斯(Haber-Weiss)原理表明,某些金属离子可以催化双氧水分解的原因是:其次外层未排满的d轨道可以存取电子,降低活化能,使分解反应容易发生。根据以上原理,下列金属离子不能催化双氧水分解的是
A.
 B.
B. C.
C. D.
D. E.
E.
(6)金属镍粉在CO气流中轻微加热,生成无色挥发性液体
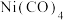 ,呈正四面体构型,易溶于下列物质中的______(填序号)。
,呈正四面体构型,易溶于下列物质中的______(填序号)。| A.水 | B. | C.NaOH溶液 | D. 溶液 溶液 |
(7)
 的晶胞形状为长方体,边长分别为a nm、b nm、c nm,结构如图所示。
的晶胞形状为长方体,边长分别为a nm、b nm、c nm,结构如图所示。
 个数为
个数为 的摩尔质量是
的摩尔质量是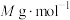 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,该晶体的密度为
,该晶体的密度为 。(
。(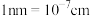 )
)
您最近一年使用:0次
4 . 依托度酸是非甾体抗炎药,可以缓解类风湿性关节炎的症状和体征。依托度酸的一种合成路线如图所示:
(1)A的化学名称为___________ 。
(2)若D能发生银镜反应和酯化反应,且分子中没有手性碳原子,写出D的结构简式:___________ ,写出D发生银镜反应的化学方程式:___________ 。
(3) 分子中含氧官能团的名称为
分子中含氧官能团的名称为___________ ,其氮原子的杂化方式为___________ 。
(4)已知相对分子质量: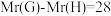 ,写出
,写出 反应的化学方程式:
反应的化学方程式:___________ ,该反应类型是___________ 。
(5)写出 反应中另一种产物的化学式:
反应中另一种产物的化学式:___________ 。
(6)写出核磁共振氢谱有4组峰,且峰面积比为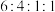 的F的同分异构体的结构简式:
的F的同分异构体的结构简式:___________ (任写一种)。
(7)请依据依托度酸的合成路线,写出以有机物 为原料合成有机物
为原料合成有机物 的合成路线;
的合成路线;___________ 。
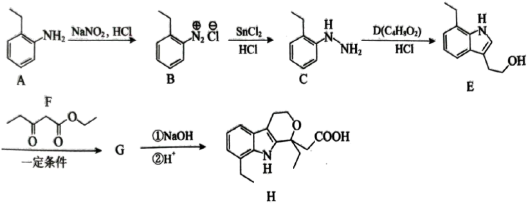
(1)A的化学名称为
(2)若D能发生银镜反应和酯化反应,且分子中没有手性碳原子,写出D的结构简式:
(3)
 分子中含氧官能团的名称为
分子中含氧官能团的名称为(4)已知相对分子质量:
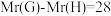 ,写出
,写出 反应的化学方程式:
反应的化学方程式:(5)写出
 反应中另一种产物的化学式:
反应中另一种产物的化学式:(6)写出核磁共振氢谱有4组峰,且峰面积比为
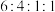 的F的同分异构体的结构简式:
的F的同分异构体的结构简式:(7)请依据依托度酸的合成路线,写出以有机物
 为原料合成有机物
为原料合成有机物 的合成路线;
的合成路线;
您最近一年使用:0次
名校
解题方法
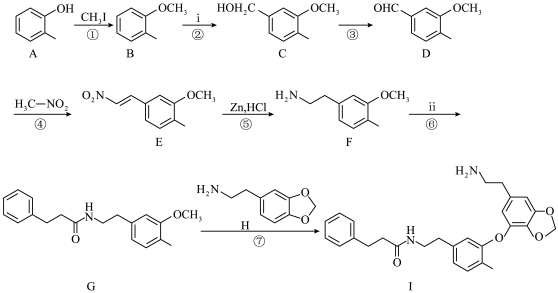
5 . 氯霉素(H)的一种合成路线如下:
(1)A→B反应中,碳原子的杂化轨道类型的变化为___________ 。
(2)B→C的反应类型为___________ 。
(3)D的分子式为C10H11BrO2,其结构简式为___________ 。
(4)E的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式___________ 。
能与FeCl3溶液发生显色反应;
核磁共振氢谱有5个峰;
能发生水解反应;苯环上的一溴代物只有一种。
(5)物质E在水中的溶解度比F___________ (填“大”、“小”或“无差别”)。
(6)写出以乙烯为主要原料制备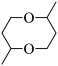 的合成路线流程图
的合成路线流程图___________ (无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。

(1)A→B反应中,碳原子的杂化轨道类型的变化为
(2)B→C的反应类型为
(3)D的分子式为C10H11BrO2,其结构简式为
(4)E的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式
能与FeCl3溶液发生显色反应;
核磁共振氢谱有5个峰;
能发生水解反应;苯环上的一溴代物只有一种。
(5)物质E在水中的溶解度比F
(6)写出以乙烯为主要原料制备
 的合成路线流程图
的合成路线流程图
您最近一年使用:0次
23-24高三下·陕西西安·阶段练习
解题方法
6 . CdS、ZnS等硫化物与TiO2、SnO2、ZnO等进行复合,可以得到性能很好的复合半导体光催化剂。回答下列问题:
(1)Sn与C同主族,基态Sn原子的价层电子排布式为_______ ,基态Ti原子核外电子有_______ 种空间运动状态, 核外未成对电子数为
核外未成对电子数为_______ ,ZnS、ZnO中各元素的电负性由大到小的顺序为_______ 。
(2)许多具有—C═N—结构的分子及其硼配合物是较好的荧光材料,在光学探针、有机发光二极管等领域受到广泛关注,某两种含这种结构的分子如图1、图2所示。_______ ;图2中N原子会和B原子形成配位键,成键时_______ (填元素符号)原子提供空轨道。
(3)N、O、F三种元素的第一电离能由大到小的顺序为_______ (填元素符号),解释其原因:_______ 。
(4)钾冰晶石型晶体是一类新型的无机闪烁体,在核安全以及国土安全检查方面有重要的应用。如图是一种钾冰晶石型闪烁体的晶胞结构,属于立方晶系,其中A位是 、B位是
、B位是 、R位是正三价的Y(钇),X位是
、R位是正三价的Y(钇),X位是 。
。_______ 。
②若晶胞参数为anm,该晶体的密度为_______ g (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
(1)Sn与C同主族,基态Sn原子的价层电子排布式为
 核外未成对电子数为
核外未成对电子数为(2)许多具有—C═N—结构的分子及其硼配合物是较好的荧光材料,在光学探针、有机发光二极管等领域受到广泛关注,某两种含这种结构的分子如图1、图2所示。

(3)N、O、F三种元素的第一电离能由大到小的顺序为
(4)钾冰晶石型晶体是一类新型的无机闪烁体,在核安全以及国土安全检查方面有重要的应用。如图是一种钾冰晶石型闪烁体的晶胞结构,属于立方晶系,其中A位是
 、B位是
、B位是 、R位是正三价的Y(钇),X位是
、R位是正三价的Y(钇),X位是 。
。
②若晶胞参数为anm,该晶体的密度为
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
解题方法
7 . 冶炼金属产生的酸泥属于有价值危险物。从某酸泥(含 单质,
单质, 及
及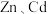 的化合物等)中回收汞和硒的一种工艺如图:
的化合物等)中回收汞和硒的一种工艺如图: 如下表所示:
如下表所示:
回答下列问题:
(1)“氧化浸出”时,酸泥中硒、汞、锌、镉分别以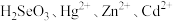 形式进入溶液。
形式进入溶液。
①基态 原子核外电子的运动状态有
原子核外电子的运动状态有_______ 种, 中
中 原子杂化类型为
原子杂化类型为_______ 。
②不溶于水的 被氧化的离子方程式为
被氧化的离子方程式为_______ 。
(2)沉汞后液中磷以最高价形式存在。“还原沉汞”的主要反应中,氧化剂和还原剂的物质的量之比为_____ , 加入量对沉汞效果的影响如下表所示,则其最适宜加入量是汞量的
加入量对沉汞效果的影响如下表所示,则其最适宜加入量是汞量的_____ 倍。
(3)①“沉硒”时“气液逆流”的目的是_______ 。
②已知: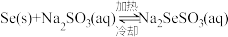 ,粗硒中的杂质不溶于
,粗硒中的杂质不溶于 溶液。利用该原理对粗硒进行提纯:将粗硒投入
溶液。利用该原理对粗硒进行提纯:将粗硒投入______ 中,待硒充分溶解后_____ ,冷却析出硒,再过滤、洗涤、干燥。
(4)为使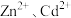 完全沉淀,“中和”时需调节溶液的
完全沉淀,“中和”时需调节溶液的 范围为
范围为____ ,所得“中和液”中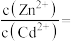
_______ 。
 单质,
单质, 及
及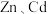 的化合物等)中回收汞和硒的一种工艺如图:
的化合物等)中回收汞和硒的一种工艺如图: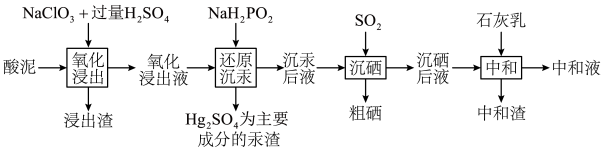
 如下表所示:
如下表所示:| 氢氧化物 |  | |||
开始沉淀 | 完全沉淀 | 沉淀 开始溶解 | 沉淀 完全溶解 | |
 | 8.2 | 9.7 | — | — |
 | 6.5 | 8.0 | 10.5 | 12~13 |
(1)“氧化浸出”时,酸泥中硒、汞、锌、镉分别以
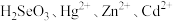 形式进入溶液。
形式进入溶液。①基态
 原子核外电子的运动状态有
原子核外电子的运动状态有 中
中 原子杂化类型为
原子杂化类型为②不溶于水的
 被氧化的离子方程式为
被氧化的离子方程式为(2)沉汞后液中磷以最高价形式存在。“还原沉汞”的主要反应中,氧化剂和还原剂的物质的量之比为
 加入量对沉汞效果的影响如下表所示,则其最适宜加入量是汞量的
加入量对沉汞效果的影响如下表所示,则其最适宜加入量是汞量的 加入量 加入量 | 沉汞率 | 汞渣含 | 沉硒率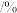 |
| 汞量的1.0倍 | 68.42 | 57.80 | 1.23 |
| 汞量的1.25倍 | 85.93 | 66.30 | 1.77 |
| 汞量的1.5倍 | 99.53 | 78.84 | 2.95 |
| 汞量的1.75倍 | 99.70 | 70.80 | 5.23 |
| 汞量的2.0倍 | 99.72 | 60.84 | 6.59 |
(3)①“沉硒”时“气液逆流”的目的是
②已知:
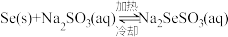 ,粗硒中的杂质不溶于
,粗硒中的杂质不溶于 溶液。利用该原理对粗硒进行提纯:将粗硒投入
溶液。利用该原理对粗硒进行提纯:将粗硒投入(4)为使
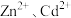 完全沉淀,“中和”时需调节溶液的
完全沉淀,“中和”时需调节溶液的 范围为
范围为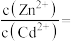
您最近一年使用:0次
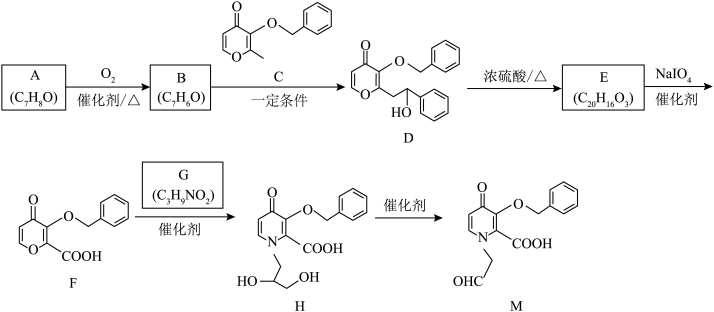
8 . 千金藤素常用于防治肿瘤病患者白细胞减少症、抗疟疾、调节免疫功能等,制备其关键中间体(I)的一种合成路线如下:
(1)化合物A的名称为______ ;化合物C中含有的官能团名称为___________ 。
(2)反应②是原子利用率100%的反应,写出化合物ⅰ的一种用途________________ 。
(3)芳香化合物x为ⅱ的同分异构体,能发生水解反应,且核磁共振氢谱中4组峰的面积之比为6∶2∶1∶1。x的结构简式为_____________________ (写出一种)。
(4)根据化合物D的结构特征,分析预测其主要的化学性质,完成下表。
(5)下列说法正确的是
(6)参照上述路线,以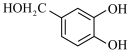 、ⅲ(一种二溴代烃)为主要原料合成流程中的物质H,基于你的设计,回答下列问题:
、ⅲ(一种二溴代烃)为主要原料合成流程中的物质H,基于你的设计,回答下列问题:
①原料ⅲ为_____________ (写结构简式)。
②相关步骤涉及芳香醇转化为芳香醛的反应,对应的化学方程式为_____________________ 。
③最后一步反应类型为____________ 。
(1)化合物A的名称为
(2)反应②是原子利用率100%的反应,写出化合物ⅰ的一种用途
(3)芳香化合物x为ⅱ的同分异构体,能发生水解反应,且核磁共振氢谱中4组峰的面积之比为6∶2∶1∶1。x的结构简式为
(4)根据化合物D的结构特征,分析预测其主要的化学性质,完成下表。
序号 | 可反应的试剂 | 反应形成的新结构 | 消耗反应物的物质的量之比 |
① | 新制 |  | |
② |
|
|
(5)下列说法正确的是
A.有机物A碳原子杂化方式有 、 、 | B.反应①,有C-I键和H-O键断裂 |
C.1mol化合物B中,含 键16 键16 个 个 | D.产品I属于极性分子,易溶于水和酒精 |
(6)参照上述路线,以
 、ⅲ(一种二溴代烃)为主要原料合成流程中的物质H,基于你的设计,回答下列问题:
、ⅲ(一种二溴代烃)为主要原料合成流程中的物质H,基于你的设计,回答下列问题:①原料ⅲ为
②相关步骤涉及芳香醇转化为芳香醛的反应,对应的化学方程式为
③最后一步反应类型为
您最近一年使用:0次
解题方法
9 . 有机物M是合成治疗汉坦病毒药物的中间体。某实验室由芳香化合物A制备M的一种合成路线如下:
(1)A的化学名称为_______ ;B+C→D的反应类型为_______ ;E的结构简式为_______ 。
(2)F+G→H的化学方程式为_______ ;G中所含官能团的名称为_______ 。
(3)M中碳原子的杂化方式为_______ 。
(4)Q为F的同分异构体,同时满足下列条件的Q的结构有_______ 种(不考虑立体异构)。
③核磁共振氢谱中有6组吸收峰
①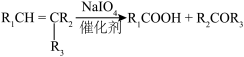 ;
;
②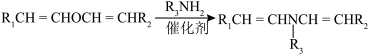 。
。
(1)A的化学名称为
(2)F+G→H的化学方程式为
(3)M中碳原子的杂化方式为
(4)Q为F的同分异构体,同时满足下列条件的Q的结构有
①含有 结构
结构
③核磁共振氢谱中有6组吸收峰
您最近一年使用:0次
名校
解题方法
10 . X、Y、Z、R、W为前四周期元素,且原子序数依次增大。YZ2是红棕色气体,X、Y形成YX3,基态R原子M层与K层电子数相等,W2+的3d轨道中有9个电子,上述元素中仅有Y、Z位于同一周期。回答下列问题;
(1)基态R原子的价层轨道表示式为___________ ,
(2) 的空间结构为
的空间结构为___________ ,其中心原子的杂化方式为___________ 。
(3)稳定性:Y2___________ (填“>”、“<”或“=”)Z2,原因为___________ 。
(4)仅由X、Y两种元素可形成18电子的分子,该分子为___________ (填化学式)。
(5)仅由X、Y、Z三种元素可形成一种离子化合物,该化合物所含共价键的类型有___________ 。
(6)将W单质的粉末加入YX3的浓溶液,通入Z2,充分反应后溶液呈深蓝色,该反应的离子方程式为___________ ,从结构的角度,解释该反应可以发生的原因:___________ 。
(1)基态R原子的价层轨道表示式为
(2)
 的空间结构为
的空间结构为(3)稳定性:Y2
(4)仅由X、Y两种元素可形成18电子的分子,该分子为
(5)仅由X、Y、Z三种元素可形成一种离子化合物,该化合物所含共价键的类型有
(6)将W单质的粉末加入YX3的浓溶液,通入Z2,充分反应后溶液呈深蓝色,该反应的离子方程式为
您最近一年使用:0次