名校
解题方法
1 . Ⅰ.硅材料在生活中古有重要地位。请回答:
(1) 分子的空间结构(以Si为中心)为
分子的空间结构(以Si为中心)为______ ,分子中氮原子的杂化轨道类型是______ 。
(2)由硅原子核形成的三种微粒,电子排布式分别为:①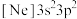 、②
、②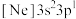 、③
、③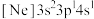 ,有关这些微粒的叙述,正确的是______。
,有关这些微粒的叙述,正确的是______。
(3)Si与P形成的某化合物晶体的晶胞如图。该化合物的化学式为______ 。 和硫铁矿(
和硫铁矿( )联合制备铁精粉(
)联合制备铁精粉( )和硫酸,实现能源及资源的有效利用。
)和硫酸,实现能源及资源的有效利用。
(4) 结构示意图如图1。
结构示意图如图1。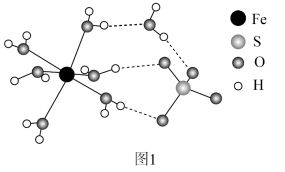
① 的价层电子排布式为
的价层电子排布式为______ 。
② 中O和
中O和 中S均为
中S均为 杂化,比较
杂化,比较 中
中 键角和
键角和 中
中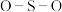 键角的大小并解释原因
键角的大小并解释原因______ 。
③ 中
中 与
与 、
、 与
与 的作用力类型分别是
的作用力类型分别是______ 。
(5) 晶体的晶胞形状为立方体,边长为a nm,结构如图2。
晶体的晶胞形状为立方体,边长为a nm,结构如图2。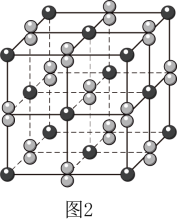
 的摩尔质量为
的摩尔质量为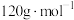 ,阿伏加德罗常数为
,阿伏加德罗常数为 。该晶体的密度为
。该晶体的密度为______  。(
。(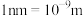 )
)
(1)
 分子的空间结构(以Si为中心)为
分子的空间结构(以Si为中心)为(2)由硅原子核形成的三种微粒,电子排布式分别为:①
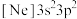 、②
、②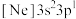 、③
、③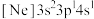 ,有关这些微粒的叙述,正确的是______。
,有关这些微粒的叙述,正确的是______。| A.微粒半径:③>①>② |
| B.电子排布属于基态原子(或离子)的是:①② |
| C.电离一个电子所需最低能量:①>②>③ |
| D.得电子能力:①>② |
(3)Si与P形成的某化合物晶体的晶胞如图。该化合物的化学式为

 和硫铁矿(
和硫铁矿( )联合制备铁精粉(
)联合制备铁精粉( )和硫酸,实现能源及资源的有效利用。
)和硫酸,实现能源及资源的有效利用。(4)
 结构示意图如图1。
结构示意图如图1。
①
 的价层电子排布式为
的价层电子排布式为②
 中O和
中O和 中S均为
中S均为 杂化,比较
杂化,比较 中
中 键角和
键角和 中
中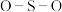 键角的大小并解释原因
键角的大小并解释原因③
 中
中 与
与 、
、 与
与 的作用力类型分别是
的作用力类型分别是(5)
 晶体的晶胞形状为立方体,边长为a nm,结构如图2。
晶体的晶胞形状为立方体,边长为a nm,结构如图2。
 的摩尔质量为
的摩尔质量为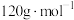 ,阿伏加德罗常数为
,阿伏加德罗常数为 。该晶体的密度为
。该晶体的密度为 。(
。(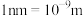 )
)
您最近一年使用:0次
2 . 最近Bill Morandi课题组报告了一种Rh催化实现C—C键断裂的反应。其反应通式如下:

利用该反应可合成物质G,请回答相关问题。
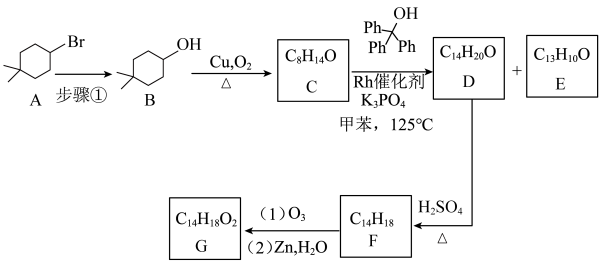
已知:
Ⅰ.Ph-代表
Ⅱ.
(1)步骤①的试剂和条件为___________ ,B→C的反应类型为___________ 。
(2)化合物E具有高度对称的结构,核磁共振氢谱显示有3组峰,则E的结构简式为___________ ,其中碳原子的杂化方式为___________ 。
(3)D→F的化学方程式为___________ 。
(4)化合物H是G的同分异构体,同时满足以下条件的共有___________ 种(不考虑立体异构)。
a.分子中有两个不共边的六元碳环; b.能水解,不能发生银镜反应;
c.苯环上只有两个取代基。
在稀硫酸条件下水解,其产物中遇 溶液显紫色的结构简式为
溶液显紫色的结构简式为___________ (写出一种即可)。
(5)参照上述反应路线,以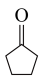 和
和 为原料,设计合
为原料,设计合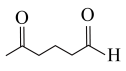 的路线
的路线___________ (无机试剂和有机溶剂任选)。

利用该反应可合成物质G,请回答相关问题。

已知:
Ⅰ.Ph-代表

Ⅱ.

(1)步骤①的试剂和条件为
(2)化合物E具有高度对称的结构,核磁共振氢谱显示有3组峰,则E的结构简式为
(3)D→F的化学方程式为
(4)化合物H是G的同分异构体,同时满足以下条件的共有
a.分子中有两个不共边的六元碳环; b.能水解,不能发生银镜反应;
c.苯环上只有两个取代基。
在稀硫酸条件下水解,其产物中遇
 溶液显紫色的结构简式为
溶液显紫色的结构简式为(5)参照上述反应路线,以
 和
和 为原料,设计合
为原料,设计合 的路线
的路线
您最近一年使用:0次
名校
3 . 吲哚美辛M是一种可减少发热、疼痛的非甾体类抗炎药,其合成路线(部分试剂及反应条件略)如下图所示。
(1)A中官能团名称为___________ 。
(2)反应G+H→I的目的是_______________ 。
(3)J→K的反应类型为___________ 。
(4)M(吲哚美辛)的结构简式为___________ ,其中的吲哚片段(含氮杂环)为平面结构,其中氮原子的孤对电子位于___________ (填序号)。
A.sp3杂化轨道 B.sp2杂化轨道 C.2s轨道 D.2p轨道
(5)C+D→E的化学方程式为____________ 。
(6)G经碱性水解、酸化后的产物的同分异构体中满足能与 溶液反应的环状化合物有
溶液反应的环状化合物有________ 个(不考虑立体异构)。其中核磁共振氢谱有三组峰(峰面积之比为1:1:4的化合物结构简式为____________ (任写一种)。

已知:① 
②
③
(1)A中官能团名称为
(2)反应G+H→I的目的是
(3)J→K的反应类型为
(4)M(吲哚美辛)的结构简式为
A.sp3杂化轨道 B.sp2杂化轨道 C.2s轨道 D.2p轨道
(5)C+D→E的化学方程式为
(6)G经碱性水解、酸化后的产物的同分异构体中满足能与
 溶液反应的环状化合物有
溶液反应的环状化合物有
您最近一年使用:0次
4 . 金属有机骨架化合物 因高孔隙率等优良特性成为吸附材料的研究热点。采用不同金属中心离子,可合成不同的
因高孔隙率等优良特性成为吸附材料的研究热点。采用不同金属中心离子,可合成不同的 吸附材料。回答下列问题:
吸附材料。回答下列问题:
(1)金属硝酸盐是合成 的常见试剂。硝酸根离子的空间构型为
的常见试剂。硝酸根离子的空间构型为___________ ;
(2)功能化 可吸附
可吸附 并将其催化转化为甲醇,甲醇易溶于水的原因是
并将其催化转化为甲醇,甲醇易溶于水的原因是___________ ;
(3) (制备
(制备 所需催化剂的原料)的结构是
所需催化剂的原料)的结构是 ,
,  与
与 键的数目比是
键的数目比是___________ ;
(4)基态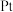 原子的电子排布式为
原子的电子排布式为 ,则
,则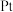 位于元素周期表第
位于元素周期表第___________ 周期第___________ 族,处于___________ 区。  的价层电子对互斥模型如图所示,该离子是平面正方形结构,键角是90°,则中心原子采用的杂化类型可能是
的价层电子对互斥模型如图所示,该离子是平面正方形结构,键角是90°,则中心原子采用的杂化类型可能是___________ (填“ ”“
”“ 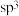 ”或“
”或“ 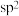 ”)。
”)。 多孔材料孔径大小和形状恰好将
多孔材料孔径大小和形状恰好将 “固定”,能高选择性吸附
“固定”,能高选择性吸附 。废气中的
。废气中的 被吸附后,经处理能全部转化为
被吸附后,经处理能全部转化为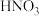 。原理示意图如图。
。原理示意图如图。 。下列说法正确的是___________。
。下列说法正确的是___________。
(6)图示中转化为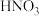 的反应,化学方程式为
的反应,化学方程式为___________ 。
 因高孔隙率等优良特性成为吸附材料的研究热点。采用不同金属中心离子,可合成不同的
因高孔隙率等优良特性成为吸附材料的研究热点。采用不同金属中心离子,可合成不同的 吸附材料。回答下列问题:
吸附材料。回答下列问题:(1)金属硝酸盐是合成
 的常见试剂。硝酸根离子的空间构型为
的常见试剂。硝酸根离子的空间构型为(2)功能化
 可吸附
可吸附 并将其催化转化为甲醇,甲醇易溶于水的原因是
并将其催化转化为甲醇,甲醇易溶于水的原因是(3)
 (制备
(制备 所需催化剂的原料)的结构是
所需催化剂的原料)的结构是 ,
,  与
与 键的数目比是
键的数目比是(4)基态
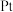 原子的电子排布式为
原子的电子排布式为 ,则
,则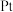 位于元素周期表第
位于元素周期表第 的价层电子对互斥模型如图所示,该离子是平面正方形结构,键角是90°,则中心原子采用的杂化类型可能是
的价层电子对互斥模型如图所示,该离子是平面正方形结构,键角是90°,则中心原子采用的杂化类型可能是 ”“
”“ 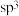 ”或“
”或“ 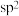 ”)。
”)。
 多孔材料孔径大小和形状恰好将
多孔材料孔径大小和形状恰好将 “固定”,能高选择性吸附
“固定”,能高选择性吸附 。废气中的
。废气中的 被吸附后,经处理能全部转化为
被吸附后,经处理能全部转化为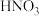 。原理示意图如图。
。原理示意图如图。
 。下列说法正确的是___________。
。下列说法正确的是___________。A. 是一种超分子,图示吸附过程属于氮的固定 是一种超分子,图示吸附过程属于氮的固定 |
B.温度升高时不利于 被 被 固定 固定 |
C.多孔材料“固定”  ,降低 ,降低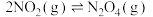 反应的活化能,促进平衡正向移动 反应的活化能,促进平衡正向移动 |
D.该 材料也可用于“固定”其他小分子,如 材料也可用于“固定”其他小分子,如 、 、 等 等 |
(6)图示中转化为
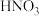 的反应,化学方程式为
的反应,化学方程式为
您最近一年使用:0次
解题方法
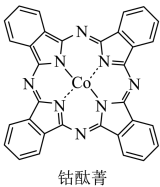
5 . 将钴酞菁和三氯化铝复合嵌接在碳纳米管上,可制得一种高效催化剂。
(1)碳的几种单质如图所示。___________ 。
②下列说法正确的是_____ 。
a.金刚石中碳碳原子间是σ键
b.C60熔化时破坏的作用力是共价键
c.以上四种单质均能导电
(2)钴酞菁是配位化合物,其分子结构如图所示。____________ 。
(3)气态AlCl3通常以二聚体Al2Cl6的形式存在,其空间结构如图1所示。AlF3结构属立方晶系,晶胞如图2所示。________ 。
②AlCl3的熔点为192℃,远低于AlF3的熔点1090℃的原因是_____________ 。
③AlF3晶体距离F最近的阳离子有_____ 个。
④AlF3的晶胞形状为正方体,边长为anm,该晶体密度为_____________ g•cm﹣3。(列出计算式,阿伏加德罗常数用NA表示,1nm=10﹣7cm)
(1)碳的几种单质如图所示。
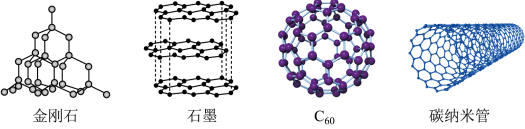
②下列说法正确的是
a.金刚石中碳碳原子间是σ键
b.C60熔化时破坏的作用力是共价键
c.以上四种单质均能导电
(2)钴酞菁是配位化合物,其分子结构如图所示。
(3)气态AlCl3通常以二聚体Al2Cl6的形式存在,其空间结构如图1所示。AlF3结构属立方晶系,晶胞如图2所示。
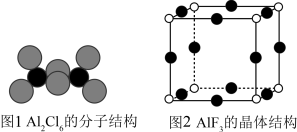
②AlCl3的熔点为192℃,远低于AlF3的熔点1090℃的原因是
③AlF3晶体距离F最近的阳离子有
④AlF3的晶胞形状为正方体,边长为anm,该晶体密度为
您最近一年使用:0次
解题方法
6 . 非金属氟化物在生产、生活和科研中应用广泛。回答下列问题:
(1)常温下 为无色气体,冷冻后成为淡黄色液体,
为无色气体,冷冻后成为淡黄色液体, 固体的晶体类型为
固体的晶体类型为___________ ;与 分子相比,
分子相比, 分子的键角更
分子的键角更___________ (填“大”或“小”),极性更___________ (填“强”或“弱”)。
(2)石墨与 在
在 反应,得到层状结构化合物
反应,得到层状结构化合物 ,其单层局部结构如图所示。与石墨相比,
,其单层局部结构如图所示。与石墨相比, 的导电性
的导电性___________ (填“增强”或“减弱”), 的
的 键的键长比石墨中
键的键长比石墨中 键的
键的___________ (填“长”或“短”)。 、
、 等离子,画出
等离子,画出 的结构式
的结构式___________ 。
(4) (第五周期稀有气体元素)与
(第五周期稀有气体元素)与 形成的
形成的 室温下易升华。
室温下易升华。 中心原子的价层电子对数为
中心原子的价层电子对数为___________ ,下列对 中心原子杂化方式推断合理的是
中心原子杂化方式推断合理的是___________ (填序号)。
A. B.
B. C.
C. D.
D.
(5) 晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为
晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为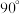 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如
。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如 点原子的分数坐标为
点原子的分数坐标为 ,已知
,已知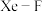 键的键长为
键的键长为 ,则
,则 点原子的分数坐标为
点原子的分数坐标为___________ ;晶胞中 、
、 间的距离
间的距离
___________  (用含
(用含 、
、 、
、 的计算式表示)。
的计算式表示)。
由晶胞结构可知B点分数坐标为: ;
;
(1)常温下
 为无色气体,冷冻后成为淡黄色液体,
为无色气体,冷冻后成为淡黄色液体, 固体的晶体类型为
固体的晶体类型为 分子相比,
分子相比, 分子的键角更
分子的键角更(2)石墨与
 在
在 反应,得到层状结构化合物
反应,得到层状结构化合物 ,其单层局部结构如图所示。与石墨相比,
,其单层局部结构如图所示。与石墨相比, 的导电性
的导电性 的
的 键的键长比石墨中
键的键长比石墨中 键的
键的
 、
、 等离子,画出
等离子,画出 的结构式
的结构式(4)
 (第五周期稀有气体元素)与
(第五周期稀有气体元素)与 形成的
形成的 室温下易升华。
室温下易升华。 中心原子的价层电子对数为
中心原子的价层电子对数为 中心原子杂化方式推断合理的是
中心原子杂化方式推断合理的是A.
 B.
B. C.
C. D.
D.
(5)
 晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为
晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如
。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如 点原子的分数坐标为
点原子的分数坐标为 ,已知
,已知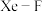 键的键长为
键的键长为 ,则
,则 点原子的分数坐标为
点原子的分数坐标为 、
、 间的距离
间的距离
 (用含
(用含 、
、 、
、 的计算式表示)。
的计算式表示)。由晶胞结构可知B点分数坐标为:
 ;
;
您最近一年使用:0次
解题方法
7 . 钛金属重量轻、强度高、有良好的抗腐蚀能力,其单质及其化合物在航空航天、武器装备、能源、化工、冶金建筑和交通等领域应用前景广阔。回答下列问题:
(1)三氟化钛可用于制取钛氟玻璃,基态F原子核外有_____ 个未成对电子,Ti原子形成Ti3+时价层电子层排布式为_____ 。
(2)TiO2的熔点为1800℃,TiCl4的熔点为-25℃,则TiO2的晶体类型为_____ ,TiCl4熔点低的原因为_____ 。
(3)钛某配合物可用于催化环烯烃聚合,其结构如图所示:_____ ,该化合物中电负性最大元素是_____ (填元素符号)。
②该配合物中不含有的化学键有_____ (填标号)。
a.离子键 b.σ键 c.金属键 d.π键
(4)已知TiO2与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示。该阳离子化学式为_____ ,阳离子中O的杂化方式为_____ ,阴离子的空间构型为_____ 。
(1)三氟化钛可用于制取钛氟玻璃,基态F原子核外有
(2)TiO2的熔点为1800℃,TiCl4的熔点为-25℃,则TiO2的晶体类型为
(3)钛某配合物可用于催化环烯烃聚合,其结构如图所示:
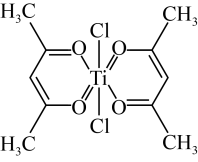
②该配合物中不含有的化学键有
a.离子键 b.σ键 c.金属键 d.π键
(4)已知TiO2与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示。该阳离子化学式为
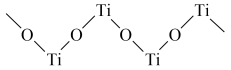
您最近一年使用:0次
解题方法
8 . 钛由于其稳定的化学性质,良好的耐高温、耐低温、抗强酸、抗强碱以及高强度、低密度等特性,被美誉为“未来钢铁”“战略金属”。
(1)基态 原子的价层电子排布图为
原子的价层电子排布图为_______ 。
(2)区分晶态 和非晶态
和非晶态 最可靠的科学方法是
最可靠的科学方法是_______ , 与光气
与光气 反应可用于制取四氯化钛,
反应可用于制取四氯化钛, 的空间构型为
的空间构型为_______ 。
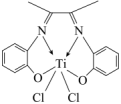
(3)Ti的一种配合物丁二酮缩邻氨基酚钛,是高性能的聚烯烃催化剂,其结构如图。______ ,其中碳原子的杂化方式为_______ 。
②该配合物中心离子是_______ ,0.5mol配合物中含 键的数目为
键的数目为_______ 。
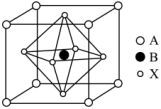
(4)某钙钛矿型太阳能光伏电池的有机半导材料的结构如下图所示,其中A为正离子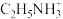 ,另两种离子为
,另两种离子为 和
和 。
。_______ 。
②与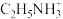 紧邻等距的
紧邻等距的 数为
数为_______ 。
③晶胞中两个最近的 之间的距离为a pm,晶胞的密度为
之间的距离为a pm,晶胞的密度为_______  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
(1)基态
 原子的价层电子排布图为
原子的价层电子排布图为(2)区分晶态
 和非晶态
和非晶态 最可靠的科学方法是
最可靠的科学方法是 与光气
与光气 反应可用于制取四氯化钛,
反应可用于制取四氯化钛, 的空间构型为
的空间构型为(3)Ti的一种配合物丁二酮缩邻氨基酚钛,是高性能的聚烯烃催化剂,其结构如图。
②该配合物中心离子是
 键的数目为
键的数目为(4)某钙钛矿型太阳能光伏电池的有机半导材料的结构如下图所示,其中A为正离子
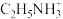 ,另两种离子为
,另两种离子为 和
和 。
。
②与
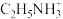 紧邻等距的
紧邻等距的 数为
数为③晶胞中两个最近的
 之间的距离为a pm,晶胞的密度为
之间的距离为a pm,晶胞的密度为 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
解题方法
9 . 卤族元素是形成化合物的常见元素。请回答:
(1)含Na、Cl、Al三种元素的某化合物,其晶体部分结构如图所示。其化学式是___________ ,晶体类型是___________ 。错误 的是___________。
(3)一种比率光生探针M与铜离子配位,可用于小鼠脑内Cu(Ⅱ)的高时空分辨率动态成像。反应如下所示:___________ 。
②M中键角∠F-B-F___________ BF3中键角∠F-B-F(填“>”、“<”、“=”),请说明理由___________ 。
(4)在水中,氟化氢是一种弱酸,但氟化氢却是酸性很强的溶剂,其酸度与无水硫酸相当,能够给予氟化氢质子的化合物是很少的。如HNO3在HF溶剂中存在如下反应: 。则HNO3在HF溶剂中呈
。则HNO3在HF溶剂中呈___________ (填“酸性”、“中性”、“碱性”)
(1)含Na、Cl、Al三种元素的某化合物,其晶体部分结构如图所示。其化学式是

A.电负性: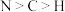 | B.第一电离能: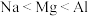 |
C.离子半径: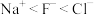 | D. 的简化电子排布式: 的简化电子排布式: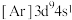 |
(3)一种比率光生探针M与铜离子配位,可用于小鼠脑内Cu(Ⅱ)的高时空分辨率动态成像。反应如下所示:
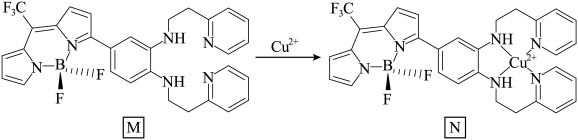
②M中键角∠F-B-F
(4)在水中,氟化氢是一种弱酸,但氟化氢却是酸性很强的溶剂,其酸度与无水硫酸相当,能够给予氟化氢质子的化合物是很少的。如HNO3在HF溶剂中存在如下反应:
 。则HNO3在HF溶剂中呈
。则HNO3在HF溶剂中呈
您最近一年使用:0次
10 . 有机物F是合成抗真菌药物泊沙康唑的重要中间体,其合成路线如图:_______ (不考虑苯环)。
(2) 中涉及官能团转化的碳原子杂化方式由
中涉及官能团转化的碳原子杂化方式由_______ 变为_______ 。
(3) 中有一种分子式为C13H14O3F2的副产物生成,其结构简式为
中有一种分子式为C13H14O3F2的副产物生成,其结构简式为_______ 。
(4)写出同时满足下列条件的F的一种同分异构体的结构简式:_______ 。
①既能与 溶液发生显色反应,又能与银氨溶液发生银镜反应。
溶液发生显色反应,又能与银氨溶液发生银镜反应。
②分子中有4种不同化学环境的氢原子。
(5)化合物 (
( )是合成缓解神经痛药物普瑞巴林的重要中间体。写出以
)是合成缓解神经痛药物普瑞巴林的重要中间体。写出以 和CH2(COOCH3)2为原料制备化合物
和CH2(COOCH3)2为原料制备化合物 的合成路线流程图
的合成路线流程图_______ (须用 和AlBN,无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
和AlBN,无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。

(2)
 中涉及官能团转化的碳原子杂化方式由
中涉及官能团转化的碳原子杂化方式由(3)
 中有一种分子式为C13H14O3F2的副产物生成,其结构简式为
中有一种分子式为C13H14O3F2的副产物生成,其结构简式为(4)写出同时满足下列条件的F的一种同分异构体的结构简式:
①既能与
 溶液发生显色反应,又能与银氨溶液发生银镜反应。
溶液发生显色反应,又能与银氨溶液发生银镜反应。②分子中有4种不同化学环境的氢原子。
(5)化合物
 (
( )是合成缓解神经痛药物普瑞巴林的重要中间体。写出以
)是合成缓解神经痛药物普瑞巴林的重要中间体。写出以 和CH2(COOCH3)2为原料制备化合物
和CH2(COOCH3)2为原料制备化合物 的合成路线流程图
的合成路线流程图 和AlBN,无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
和AlBN,无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
您最近一年使用:0次



