名校
1 . 按要求回答下列问题:
(1)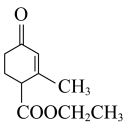 中含有的含氧官能团的名称为
中含有的含氧官能团的名称为___________ 。
(2)某有机物结构如图所示,下列说法正确的是___________ (填序号)。
③分子中C原子的杂化方式为 杂化 ④该分子是非极性分子
杂化 ④该分子是非极性分子
(3)TiO2是环境友好材料,能光催化降解有机物。纳米TiO2催化处理污水的一个实例如图所示。___________ ;化合物乙中有___________ 个手性碳原子。
(4)有A、B两种烃,已知:
( )B完全燃烧的产物
)B完全燃烧的产物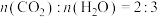 。
。
( )A是B分子中的氢原子全部被甲基取代后的产物;A遇
)A是B分子中的氢原子全部被甲基取代后的产物;A遇 的
的 溶液不褪色,其一氯代物只有一种。
溶液不褪色,其一氯代物只有一种。
①写出B与溴在光照下的反应方程式___________ (只写一取代)。
②A的结构简式为___________ ,系统命名为___________ 。
(1)
 中含有的含氧官能团的名称为
中含有的含氧官能团的名称为(2)某有机物结构如图所示,下列说法正确的是
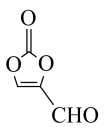
③分子中C原子的杂化方式为
 杂化 ④该分子是非极性分子
杂化 ④该分子是非极性分子(3)TiO2是环境友好材料,能光催化降解有机物。纳米TiO2催化处理污水的一个实例如图所示。

(4)有A、B两种烃,已知:
(
 )B完全燃烧的产物
)B完全燃烧的产物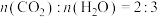 。
。(
 )A是B分子中的氢原子全部被甲基取代后的产物;A遇
)A是B分子中的氢原子全部被甲基取代后的产物;A遇 的
的 溶液不褪色,其一氯代物只有一种。
溶液不褪色,其一氯代物只有一种。①写出B与溴在光照下的反应方程式
②A的结构简式为
您最近一年使用:0次
名校
解题方法
2 . 回答下列问题。
(1)基态B原子核外电子有___________ 种运动状态。
(2)基态铜原子的电子排布式是___________ ;高温超导材料镧钡铜氧化物中含有Cu3+。基态时Cu3+ 的电子排布式为[Ar]___________ 。
(3)Fe4[Fe(CN)6]3是较早发现的CN- 配合物,其中铁元素呈现两种不同的价态。配离子的中心原子核外电子排布式为___________ 。
(4)[B(OH)4]-中氧原子的杂化轨道类型为___________ ,[B(OH)4]-的空间构型为___________ 。
(5)基态氧原子的价层电子排布式不能表示为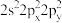 ,因为这违背了
,因为这违背了___________ (填选项)。
A.泡利原理 B.洪特规则 C.能量最低原理
(1)基态B原子核外电子有
(2)基态铜原子的电子排布式是
(3)Fe4[Fe(CN)6]3是较早发现的CN- 配合物,其中铁元素呈现两种不同的价态。配离子的中心原子核外电子排布式为
(4)[B(OH)4]-中氧原子的杂化轨道类型为
(5)基态氧原子的价层电子排布式不能表示为
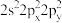 ,因为这违背了
,因为这违背了A.泡利原理 B.洪特规则 C.能量最低原理
您最近一年使用:0次
名校
3 . 硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物。
(1)基态硒原子的价层电子排布式为___________ ;As的第一电离能比Se的第一电离能大的原因为___________ 。
(2) 中心原子的杂化类型是:
中心原子的杂化类型是:___________ , 的立体构型是
的立体构型是___________ 。
(3) 属于
属于___________ (填“极性”或“非极性”)分子;比较 与
与 沸点高低,并说明原因:
沸点高低,并说明原因:___________ 。
(4)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为___________ ;若该晶胞密度为ρg⋅cm ,硒化锌的摩尔质量为Mg⋅mol
,硒化锌的摩尔质量为Mg⋅mol ,
, 代表阿伏加德罗常数的值,则晶胞参数(边长)a为
代表阿伏加德罗常数的值,则晶胞参数(边长)a为___________ 。
(1)基态硒原子的价层电子排布式为
(2)
 中心原子的杂化类型是:
中心原子的杂化类型是: 的立体构型是
的立体构型是(3)
 属于
属于 与
与 沸点高低,并说明原因:
沸点高低,并说明原因:(4)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为
 ,硒化锌的摩尔质量为Mg⋅mol
,硒化锌的摩尔质量为Mg⋅mol ,
, 代表阿伏加德罗常数的值,则晶胞参数(边长)a为
代表阿伏加德罗常数的值,则晶胞参数(边长)a为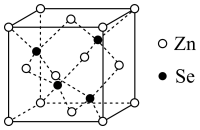
您最近一年使用:0次
2024-05-03更新
|
354次组卷
|
2卷引用:广东省茂名市高州中学2023-2024学年高二下学期期中考试化学试题
解题方法
4 . 硅及其化合物在工业中有很多用处,一些硅的卤化物的熔点如表所示:
完成下列填空:
(1)硅原子核外电子共有______ 种形状不同的电子云,画出基态硅原子最外层电子的轨道表示式______ 。
(2)表中四种卤化物分子的空间结构均为______ ,由此推断 的键角为
的键角为______ , 属于
属于______ (填“极性”或“非极性”)分子。
(3)已知 (熔点为-56.6℃)和
(熔点为-56.6℃)和 (熔点为1713℃)熔点相差较大;原因是
(熔点为1713℃)熔点相差较大;原因是______ ,表中四种卤化硅熔点存在差异的原因是______ 。
完成下列填空:
卤化物 |
|
|
|
|
熔点/℃ | -90.2 | 70.4 | 5.2 | 120.5 |
(1)硅原子核外电子共有
(2)表中四种卤化物分子的空间结构均为
 的键角为
的键角为 属于
属于(3)已知
 (熔点为-56.6℃)和
(熔点为-56.6℃)和 (熔点为1713℃)熔点相差较大;原因是
(熔点为1713℃)熔点相差较大;原因是
您最近一年使用:0次
解题方法
5 . 已知W、X、Y、Z、N是周期表中前四周期元素,它们的核电荷数依次增大。
回答下列问题:
(1)写出X的元素符号:X______ 。
(2)基态Y原子价电子的电子排布式:______ 。
(3)W、X、Z三种元素的电负性由大到小的顺序是______ (填元素符号)。
(4)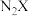 和
和 的熔点更高的是
的熔点更高的是______ (填化学式),原因是:______ 。
(5)根据价层电子对互斥理论, 的空间构型为
的空间构型为______ , 中心原子的杂化方式为
中心原子的杂化方式为______ , 和
和 中键角较小的是
中键角较小的是______ (用离子符号表示)。
元素 | 元素性质或原子结构或离子结构 |
W | 原子核内无中子 |
X | 基态原子核外s能级上的电子总数与p能级上的电子总数相等 |
Y | 元素的原子半径在同周期中最大 |
Z | 基态原子核外有9种不同空间运动状态的电子,且有两个未成对电子 |
N |
|
(1)写出X的元素符号:X
(2)基态Y原子价电子的电子排布式:
(3)W、X、Z三种元素的电负性由大到小的顺序是
(4)
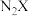 和
和 的熔点更高的是
的熔点更高的是(5)根据价层电子对互斥理论,
 的空间构型为
的空间构型为 中心原子的杂化方式为
中心原子的杂化方式为 和
和 中键角较小的是
中键角较小的是
您最近一年使用:0次
名校
6 . 请回答下列问题:
(1)由磷原子核形成的三种微粒:①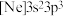 、②
、② 、③
、③ ,半径由大到小的顺序为
,半径由大到小的顺序为_______ (填标号,下同);再失去一个电子所需最低能量由大到小的顺序为_______ 。
(2)比较H-O-H键角大小;H3O+_______ H2O(填“>”、“<”或“=”)。
(3)胍(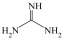 )分子中所有原子共平面,胍中N杂化方式为
)分子中所有原子共平面,胍中N杂化方式为_______ 。
(4)干冰晶体中,每个CO2周围等距离且紧邻的CO2有_______ 个;在冰晶体结构中,每个水分子最多与相邻的_______ 个水分子相连接。同为分子晶体,但干冰中CO2的配位数大于冰中水分子的配位数,其原因是_______ 。
(1)由磷原子核形成的三种微粒:①
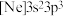 、②
、② 、③
、③ ,半径由大到小的顺序为
,半径由大到小的顺序为(2)比较H-O-H键角大小;H3O+
(3)胍(
 )分子中所有原子共平面,胍中N杂化方式为
)分子中所有原子共平面,胍中N杂化方式为(4)干冰晶体中,每个CO2周围等距离且紧邻的CO2有
您最近一年使用:0次
名校
7 . 按下列要求填空
(1)基态某原子的最外层电子排布式是 ,推断该元素位于第
,推断该元素位于第_____ 周期第____ 族,在元素周期表中属于____ 区。
(2)基态某原子的价层电子排布式为 ,在元素周期表中属于
,在元素周期表中属于_______ 区。
(3) 杂化类型为
杂化类型为_______ ,VSEPR模型为_______ ,离子空间构型为_______ 。
(1)基态某原子的最外层电子排布式是
 ,推断该元素位于第
,推断该元素位于第(2)基态某原子的价层电子排布式为
 ,在元素周期表中属于
,在元素周期表中属于(3)
 杂化类型为
杂化类型为
您最近一年使用:0次
名校
解题方法
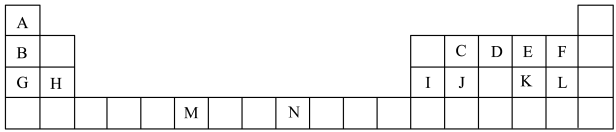
8 . 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
(1)表中元素,电负性最强的是___________ (填元素符号),J的元素名称为___________ 。N基态原子核外能级上有___________ 未成对电子。
(2)D元素原子的价电子排布图为___________ ,核外有___________ 种不同运动状态的电子。
(3)ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是___________ (填“极性”或“非极性”)分子。
(4)C元素是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是___________ (填字母)。
(1)表中元素,电负性最强的是
(2)D元素原子的价电子排布图为
(3)ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是
(4)C元素是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是
a.  b. CH4 c.CH2=CHCH3 d. CH3CH2C≡CH
b. CH4 c.CH2=CHCH3 d. CH3CH2C≡CH
您最近一年使用:0次
9 . 回答下列问题。
(1)①比较键长大小:C-H___________ N-H___________ H-O(用“>”或“<”填空)。
②比较键能大小:C-H___________ N-H___________ H-O(用“>”或“<”填空)。
(2)乙烯分子中的碳原子均采取___________ 杂化,碳原子与氢原子形成σ键,两碳原子之间形成双键(1个___________ 键和1个___________ 键)。
(3)乙烯分子中的所有原子都位于___________ ,相邻两个键之间的夹角约为___________ 。
(4)铁原子的价层电子排布式为:___________ 。
(1)①比较键长大小:C-H
②比较键能大小:C-H
(2)乙烯分子中的碳原子均采取
(3)乙烯分子中的所有原子都位于
(4)铁原子的价层电子排布式为:
您最近一年使用:0次
解题方法
10 . 回答下列问题。
(1)基态N原子的电子排布式为___________ 。基态P原子中,电子占据的最高能级原子轨道形状为___________ 。
(2)H2O中心原子杂化轨道类型为___________ ,说明H2O沸点大于H2S的原因___________ 。
(3)基态Ca原子价层电子由4s2状态变化为4s14p1状态所得原子光谱为___________ (填“发射”或“吸收”)光谱。
(4)下列氧原子电子排布图表示的状态中,能量最高的是___________ (填标号,下同),能量最低的是___________ 。
A.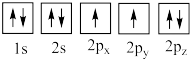 B.
B.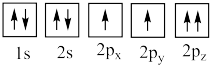
C. D.
D.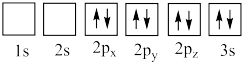
(1)基态N原子的电子排布式为
(2)H2O中心原子杂化轨道类型为
(3)基态Ca原子价层电子由4s2状态变化为4s14p1状态所得原子光谱为
(4)下列氧原子电子排布图表示的状态中,能量最高的是
A.
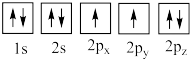 B.
B.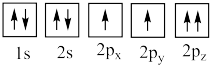
C.
 D.
D.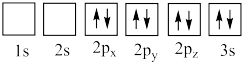
您最近一年使用:0次
2024-03-22更新
|
465次组卷
|
2卷引用:广东省普宁市勤建学校2023-2024学年高二下学期第一次月考化学试题




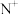 的M层全充满
的M层全充满

