解题方法
1 . 按要求回答下面问题。
(1)键的极性对物质化学性质有影响,据此比较:① 、②
、② 、③
、③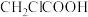 、④
、④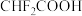 酸性由强到弱顺序是
酸性由强到弱顺序是_______ (用序号表示)。
(2) 分子内①
分子内① 键、②分子间的范德华力和③氢键从弱到强依次为
键、②分子间的范德华力和③氢键从弱到强依次为_______ (用序号表示)。 可与
可与 形成
形成 ,
, 是三角锥空间构型。
是三角锥空间构型。 中O原子采用的杂化方式为
中O原子采用的杂化方式为_______ 。
(3) 是一种无色液体,其结构如图1所示。根据“相似相溶规则”
是一种无色液体,其结构如图1所示。根据“相似相溶规则” 在水中的溶解度
在水中的溶解度_______ (填“>、<、=”)其在 中的溶解度。
中的溶解度。 是一种强氧化剂,与硫酸酸化的
是一种强氧化剂,与硫酸酸化的 溶液反应放出气体,氧化性强弱关系:
溶液反应放出气体,氧化性强弱关系:
_______  (填“>、<、=”)。
(填“>、<、=”)。

(4) 是一种极弱的二元酸,
是一种极弱的二元酸, 与过量的
与过量的 反应的化学方程式是
反应的化学方程式是_______ 。
(5)在图2中A、B、C、D四条曲线分别表示ⅣA、ⅤA、ⅥA、ⅦA族元素的气态氢化物的沸点,其中表示ⅥA族元素氢化物沸点的是曲线_______ ,同一族中第三、四、五周期元素的氢化物沸点依次升高,其原因是_______ 。

(1)键的极性对物质化学性质有影响,据此比较:①
 、②
、② 、③
、③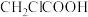 、④
、④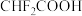 酸性由强到弱顺序是
酸性由强到弱顺序是(2)
 分子内①
分子内① 键、②分子间的范德华力和③氢键从弱到强依次为
键、②分子间的范德华力和③氢键从弱到强依次为 可与
可与 形成
形成 ,
, 是三角锥空间构型。
是三角锥空间构型。 中O原子采用的杂化方式为
中O原子采用的杂化方式为(3)
 是一种无色液体,其结构如图1所示。根据“相似相溶规则”
是一种无色液体,其结构如图1所示。根据“相似相溶规则” 在水中的溶解度
在水中的溶解度 中的溶解度。
中的溶解度。 是一种强氧化剂,与硫酸酸化的
是一种强氧化剂,与硫酸酸化的 溶液反应放出气体,氧化性强弱关系:
溶液反应放出气体,氧化性强弱关系:
 (填“>、<、=”)。
(填“>、<、=”)。
(4)
 是一种极弱的二元酸,
是一种极弱的二元酸, 与过量的
与过量的 反应的化学方程式是
反应的化学方程式是(5)在图2中A、B、C、D四条曲线分别表示ⅣA、ⅤA、ⅥA、ⅦA族元素的气态氢化物的沸点,其中表示ⅥA族元素氢化物沸点的是曲线

您最近一年使用:0次
2 . 臭氧有强氧化性能在一定条件下将烟气中的 、
、 分别氧化为
分别氧化为 和
和 。臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂。
。臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂。
(1) 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为_______ ; 的空间构型为
的空间构型为_______ (用文字描述)。
(2) 基态核外外层电子排布式为
基态核外外层电子排布式为_______ 。
(3)臭氧可用于含 碱性电镀废水的处理。第ⅰ步:
碱性电镀废水的处理。第ⅰ步: 转化为
转化为 ;第ⅱ步:
;第ⅱ步: 继续转化为
继续转化为 及两种单质气体。若第ⅱ步转化时,
及两种单质气体。若第ⅱ步转化时, 与
与 物质的量之比为3:2,该步反应的离子方程式为
物质的量之比为3:2,该步反应的离子方程式为_______ 。
(4)为测定大气中臭氧( )含量,将0℃、
)含量,将0℃、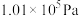 的空气V L慢慢通过足量KI溶液,使臭氧完全反应:然后将所得溶液用a mL的c mol/L
的空气V L慢慢通过足量KI溶液,使臭氧完全反应:然后将所得溶液用a mL的c mol/L 溶液进行滴定恰好到达终点。(已知:
溶液进行滴定恰好到达终点。(已知: )
)
① 与KI溶液反应生成两种单质,则反应的化学方程式
与KI溶液反应生成两种单质,则反应的化学方程式_______ 。
②该滴定实验中除烧杯、锥形瓶外,还需要的玻璃仪器是_______ ;
③该实验中可选用_______ (填物质名称)作指示剂。空气中臭氧的体积分数为_______ 。
④甲同学认为在滴定前应微热溶液、以排除溶液中溶解的 和
和 ,不然会使滴定结果偏
,不然会使滴定结果偏_______ (填“低”或“高”)。
 、
、 分别氧化为
分别氧化为 和
和 。臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂。
。臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂。(1)
 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为 的空间构型为
的空间构型为(2)
 基态核外外层电子排布式为
基态核外外层电子排布式为(3)臭氧可用于含
 碱性电镀废水的处理。第ⅰ步:
碱性电镀废水的处理。第ⅰ步: 转化为
转化为 ;第ⅱ步:
;第ⅱ步: 继续转化为
继续转化为 及两种单质气体。若第ⅱ步转化时,
及两种单质气体。若第ⅱ步转化时, 与
与 物质的量之比为3:2,该步反应的离子方程式为
物质的量之比为3:2,该步反应的离子方程式为(4)为测定大气中臭氧(
 )含量,将0℃、
)含量,将0℃、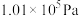 的空气V L慢慢通过足量KI溶液,使臭氧完全反应:然后将所得溶液用a mL的c mol/L
的空气V L慢慢通过足量KI溶液,使臭氧完全反应:然后将所得溶液用a mL的c mol/L 溶液进行滴定恰好到达终点。(已知:
溶液进行滴定恰好到达终点。(已知: )
)①
 与KI溶液反应生成两种单质,则反应的化学方程式
与KI溶液反应生成两种单质,则反应的化学方程式②该滴定实验中除烧杯、锥形瓶外,还需要的玻璃仪器是
③该实验中可选用
④甲同学认为在滴定前应微热溶液、以排除溶液中溶解的
 和
和 ,不然会使滴定结果偏
,不然会使滴定结果偏
您最近一年使用:0次
2023-06-10更新
|
64次组卷
|
2卷引用:广东省韶关实验中学2021-2022学年高二下学期第一次月考化学试题
3 . 维生素C是一种水溶性维生素,水果和蔬菜中含量丰富,该物质结构简式如图所示。请回答下列问题:

(1)以下关于维生素C的说法正确的是_______ (填字母)。
a.分子中既含有极性键又含有非极性键
b.1 mol分子中含有2 mol π键和20 mol σ键
c.该物质的熔点可能高于NaCl
d.分子中碳原子的杂化方式有sp2和sp3两种
e.维生素C晶体溶于水的过程中要克服的微粒间作用力只有范德华力
(2)以下关于维生素C的说法正确的是_______ (填字母)。
A.维生素C能使溴水或酸性高锰酸钾溶液褪色,且原理相同
B.维生素C在碱性溶液中能稳定存在
C.维生素C的分子式C6H8O6
D.1 mol维生素C与足量的钠反应能产生2 mol H2
E.分子中手性碳原子数目是2
(3)维生素C分子中含氧官能团的名称为_______ 。
(4)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,其中“亚铁”是关键成分,K3[Fe(CN)6]溶液是检验Fe2+的试剂,K3[Fe(CN)6]中Fe3+的配体是_______ ,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+易被氧化成Fe3+的原因是_______ 。
(5)维生素C是一种易溶于水的有机物,主要原因是_______ 。

(1)以下关于维生素C的说法正确的是
a.分子中既含有极性键又含有非极性键
b.1 mol分子中含有2 mol π键和20 mol σ键
c.该物质的熔点可能高于NaCl
d.分子中碳原子的杂化方式有sp2和sp3两种
e.维生素C晶体溶于水的过程中要克服的微粒间作用力只有范德华力
(2)以下关于维生素C的说法正确的是
A.维生素C能使溴水或酸性高锰酸钾溶液褪色,且原理相同
B.维生素C在碱性溶液中能稳定存在
C.维生素C的分子式C6H8O6
D.1 mol维生素C与足量的钠反应能产生2 mol H2
E.分子中手性碳原子数目是2
(3)维生素C分子中含氧官能团的名称为
(4)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,其中“亚铁”是关键成分,K3[Fe(CN)6]溶液是检验Fe2+的试剂,K3[Fe(CN)6]中Fe3+的配体是
(5)维生素C是一种易溶于水的有机物,主要原因是
您最近一年使用:0次
4 . VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是______ ;_______________ ;
(3)Se原子序数为_______ ,其核外M层电子的排布式为___________________ ;
(4)H2Se的酸性比H2S_________ (填“强”或“弱”)。气态SeO3分子的立体构型为______________ ,SO32-离子的立体构型为___________________ ;
(5)H2SeO3的K1和K2分别为2.7x l0-3和2.5x l0-8,H2SeO4第一步几乎完全电离,K2为1.2X10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:_____________________________________ ;
② H2SeO4比 H2SeO3酸性强的原因:______________________________________________________________
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是
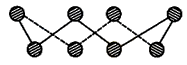
(3)Se原子序数为
(4)H2Se的酸性比H2S
(5)H2SeO3的K1和K2分别为2.7x l0-3和2.5x l0-8,H2SeO4第一步几乎完全电离,K2为1.2X10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:
② H2SeO4比 H2SeO3酸性强的原因:
您最近一年使用:0次
2016-12-09更新
|
587次组卷
|
3卷引用:2015-2016学年广东汕头金山中学高二下第十二周练化学卷



