23-24高二上·广东深圳·期末
名校
1 . 根据所学知识,回答下列问题:
(1)Cu的简化电子排布式为___________ 。Fe2+的价电子轨道表示式为___________ 。
(2)乙炔分子中σ键与π键个数之比为___________ 。
(3)吡啶( )是一种常用的有机溶剂。已知吡啶中所有原子共面,且分子中含有与苯类似的
)是一种常用的有机溶剂。已知吡啶中所有原子共面,且分子中含有与苯类似的 大π键,由此可知,吡啶中N原子的价层孤电子对占据
大π键,由此可知,吡啶中N原子的价层孤电子对占据___________ 轨道。
(4)NH3、PH3、AsH3按照沸点由高到低排序,依次为___________ 。
(5)BF3、SiF4、NF3按照键角由大到小排序,依次为___________ 。
(6)科学家合成了一种新型离子化合物NH5,其所有原子最外层都符合相应稀有气体原子电子层结构,该物质遇水会发生水解,生成一种一元弱碱和一种单质气体。该反应的化学方程式为___________ 。
(1)Cu的简化电子排布式为
(2)乙炔分子中σ键与π键个数之比为
(3)吡啶(
 )是一种常用的有机溶剂。已知吡啶中所有原子共面,且分子中含有与苯类似的
)是一种常用的有机溶剂。已知吡啶中所有原子共面,且分子中含有与苯类似的 大π键,由此可知,吡啶中N原子的价层孤电子对占据
大π键,由此可知,吡啶中N原子的价层孤电子对占据(4)NH3、PH3、AsH3按照沸点由高到低排序,依次为
(5)BF3、SiF4、NF3按照键角由大到小排序,依次为
(6)科学家合成了一种新型离子化合物NH5,其所有原子最外层都符合相应稀有气体原子电子层结构,该物质遇水会发生水解,生成一种一元弱碱和一种单质气体。该反应的化学方程式为
您最近一年使用:0次
名校
解题方法
2 . 氮、氟及其化合物在生产及生活中有着广泛的用途。请回答下列问题:
(1)氟磷灰石可用于制取磷肥,基态P原子有___________ 个未成对电子, 的中心P原子的杂化方式为
的中心P原子的杂化方式为___________ 。
(2)氟气可以用于制取惰性强于 的保护气
的保护气 ,也可以用于制取聚合反应的催化剂
,也可以用于制取聚合反应的催化剂 ,
, 可以作为工业制取硅单质的中间物质(
可以作为工业制取硅单质的中间物质( )的原料。
)的原料。
① 分子的空间结构为
分子的空间结构为___________ 。
②S、P、Si的第一电离能由大到小的顺序为___________ 。
(3)Na与N形成的 可用于汽车的安全气囊中,其中阴离子的空间结构为
可用于汽车的安全气囊中,其中阴离子的空间结构为___________ 。
(4)键角比较:
___________  (填“>”或“<”),其原因为
(填“>”或“<”),其原因为___________ 。
(1)氟磷灰石可用于制取磷肥,基态P原子有
 的中心P原子的杂化方式为
的中心P原子的杂化方式为(2)氟气可以用于制取惰性强于
 的保护气
的保护气 ,也可以用于制取聚合反应的催化剂
,也可以用于制取聚合反应的催化剂 ,
, 可以作为工业制取硅单质的中间物质(
可以作为工业制取硅单质的中间物质( )的原料。
)的原料。①
 分子的空间结构为
分子的空间结构为②S、P、Si的第一电离能由大到小的顺序为
(3)Na与N形成的
 可用于汽车的安全气囊中,其中阴离子的空间结构为
可用于汽车的安全气囊中,其中阴离子的空间结构为(4)键角比较:

 (填“>”或“<”),其原因为
(填“>”或“<”),其原因为
您最近一年使用:0次
名校
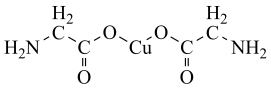
3 . 氨基乙酸铜被广泛应用于染料、涂料、塑料和电池等领域,其化学式为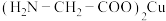 ,结构如图所示。
,结构如图所示。
(1)基态 原子的电子排布式为
原子的电子排布式为_______ , 位于元素周期表中
位于元素周期表中_______ 区元素(填“s、p、d、ds和f”其中一个)。
(2)氨基乙酸铜中碳原子的杂化方式有_______ 、_______ ,该分子中有_______ 个 键。
键。
(3)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态
表示,称为电子的自旋磁量子数。对于基态 原子,其价电子自旋磁量子数的代数和为
原子,其价电子自旋磁量子数的代数和为_______ 。
(4) 原子的第一电离能比
原子的第一电离能比 原子的
原子的_______ (填“大”或“小”),其原因是_______ 。
(5)氨基乙酸铜可由碳酸铜、氯乙酸、乙二胺等制得,碳酸铜中 的VSEPR模型名称为
的VSEPR模型名称为_______ ,氯乙酸的酸性大于乙酸的原因是_______ 。
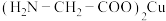 ,结构如图所示。
,结构如图所示。
(1)基态
 原子的电子排布式为
原子的电子排布式为 位于元素周期表中
位于元素周期表中(2)氨基乙酸铜中碳原子的杂化方式有
 键。
键。(3)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用
 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态
表示,称为电子的自旋磁量子数。对于基态 原子,其价电子自旋磁量子数的代数和为
原子,其价电子自旋磁量子数的代数和为(4)
 原子的第一电离能比
原子的第一电离能比 原子的
原子的(5)氨基乙酸铜可由碳酸铜、氯乙酸、乙二胺等制得,碳酸铜中
 的VSEPR模型名称为
的VSEPR模型名称为
您最近一年使用:0次
名校
4 . 过渡金属元素铬 是不锈钢的重要成分。回答下列问题:
是不锈钢的重要成分。回答下列问题:
(1)对于基态Cr原子,下列叙述正确的是___________ (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为
B.4s轨道上电子能量比3d高,且总是在比3d轨道上电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)三价铬离子能形成多种配位化合物。 中提供电子对形成配位键的原子是
中提供电子对形成配位键的原子是___________ ,中心离子的配位数为___________ 。
(3) 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应的键角如图所示。
的空间结构和相应的键角如图所示。
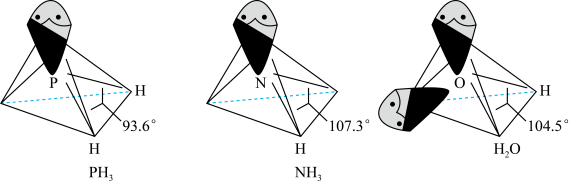
 中P的杂化类型是
中P的杂化类型是___________ 。 的沸点比
的沸点比 的
的___________ , 的键角小于
的键角小于 的,分析原因
的,分析原因___________ 。
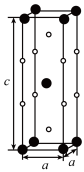
(4)在金属材料中添加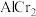 颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。
颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。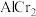 具有体心四方结构,如图所示,处于顶角位置的是
具有体心四方结构,如图所示,处于顶角位置的是___________ 原子。设Cr和Al原子半径分别为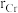 和
和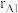 ,则金属原子空间占有率为
,则金属原子空间占有率为___________ %(列出计算表达式)。
 是不锈钢的重要成分。回答下列问题:
是不锈钢的重要成分。回答下列问题:(1)对于基态Cr原子,下列叙述正确的是
A.轨道处于半充满时体系总能量低,核外电子排布应为

B.4s轨道上电子能量比3d高,且总是在比3d轨道上电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)三价铬离子能形成多种配位化合物。
 中提供电子对形成配位键的原子是
中提供电子对形成配位键的原子是(3)
 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应的键角如图所示。
的空间结构和相应的键角如图所示。
 中P的杂化类型是
中P的杂化类型是 的沸点比
的沸点比 的
的 的键角小于
的键角小于 的,分析原因
的,分析原因(4)在金属材料中添加
 颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。
颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。 具有体心四方结构,如图所示,处于顶角位置的是
具有体心四方结构,如图所示,处于顶角位置的是 和
和 ,则金属原子空间占有率为
,则金属原子空间占有率为
您最近一年使用:0次
名校
5 . 三磷酸腺苷(ATP)和活性氧类(如H2O2和O )可在细胞代谢过程中产生。
)可在细胞代谢过程中产生。
(1)ATP的分子式为C10H16N5O13P3,其中电负性最大的元素是___________ ,基态N原子的电子排布图为___________ 。
(2)H2O2分子的氧原子的杂化轨道类型为:___________ ;H2O2和H2O能以任意比例互溶的原因是___________ 。(回答两点原因)
(3)O3分子的立体构型为___________ 。根据表中数据判断氧原子之间的共价键最稳定的粒子是___________ 。
(4)研究发现纳米CeO2可催化O 分解,CeO2晶体属立方CaF2型晶体结构如图所示。
分解,CeO2晶体属立方CaF2型晶体结构如图所示。___________ nm。
②以晶胞参数为单位长度建立的中标系可以表示晶胞中的原子位置,称作原子分数坐标。A离子的坐标为(0, ,
, ),则B离子的坐标为
),则B离子的坐标为___________ 。
 )可在细胞代谢过程中产生。
)可在细胞代谢过程中产生。(1)ATP的分子式为C10H16N5O13P3,其中电负性最大的元素是
(2)H2O2分子的氧原子的杂化轨道类型为:
(3)O3分子的立体构型为
| 粒子 | O2 | O2- | O3 |
| 键长/pm | 121 | 126 | 128 |
 分解,CeO2晶体属立方CaF2型晶体结构如图所示。
分解,CeO2晶体属立方CaF2型晶体结构如图所示。
②以晶胞参数为单位长度建立的中标系可以表示晶胞中的原子位置,称作原子分数坐标。A离子的坐标为(0,
 ,
, ),则B离子的坐标为
),则B离子的坐标为
您最近一年使用:0次
2023-06-07更新
|
305次组卷
|
2卷引用:广东省深圳市观澜中学2022-2023学年高二下学期月考(物质结构)化学试题
名校
6 . 研究表明,利用FeCl2、NH4H2PO4、Li2CO3和苯胺( )制备的磷酸亚铁锂(LiFePO4)可用作电池的正极材料。
)制备的磷酸亚铁锂(LiFePO4)可用作电池的正极材料。
(1)Fe2+基态核外电子排布式为___________ 。
(2)N、P、O三种元素的电负性由大到小的顺序为___________ 。
(3)CO 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为___________ 。
(4)1mol苯胺分子中含有σ键的数目为___________ ;苯胺与甲苯的相对分子质量相近,但苯胺的沸点高于甲苯,其原因是___________ 。
 )制备的磷酸亚铁锂(LiFePO4)可用作电池的正极材料。
)制备的磷酸亚铁锂(LiFePO4)可用作电池的正极材料。(1)Fe2+基态核外电子排布式为
(2)N、P、O三种元素的电负性由大到小的顺序为
(3)CO
 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为(4)1mol苯胺分子中含有σ键的数目为
您最近一年使用:0次
解题方法
7 . 根据杂化轨道理论可以判断分子的空间结构,试根据相关知识填空:
(1)一种有机化合物的结构简式如下:

该分子中有___________ 个sp2杂化碳原子;___________ 个sp3杂化碳原子;
(2)SCN-与NO 的结构相同,微粒呈
的结构相同,微粒呈___________ 形,中心原子都采取___________ 杂化。
(3)CO 、NO
、NO 等微粒具有相同的原子个数,空间结构呈
等微粒具有相同的原子个数,空间结构呈___________ 形,中心原子都采取___________ 杂化。
(4)元素As与N同族。预测As的氢化物分子的立体结构为___________ ,其沸点比NH3的___________ (填“高”或“低”),其判断理由是___________ 。
(5)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因___________ 。
(1)一种有机化合物的结构简式如下:

该分子中有
(2)SCN-与NO
 的结构相同,微粒呈
的结构相同,微粒呈(3)CO
 、NO
、NO 等微粒具有相同的原子个数,空间结构呈
等微粒具有相同的原子个数,空间结构呈(4)元素As与N同族。预测As的氢化物分子的立体结构为
(5)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | -49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
您最近一年使用:0次
8 . 维生素C是一种水溶性维生素,水果和蔬菜中含量丰富,该物质结构简式如图所示。请回答下列问题:

(1)以下关于维生素C的说法正确的是_______ (填字母)。
a.分子中既含有极性键又含有非极性键
b.1 mol分子中含有2 mol π键和20 mol σ键
c.该物质的熔点可能高于NaCl
d.分子中碳原子的杂化方式有sp2和sp3两种
e.维生素C晶体溶于水的过程中要克服的微粒间作用力只有范德华力
(2)以下关于维生素C的说法正确的是_______ (填字母)。
A.维生素C能使溴水或酸性高锰酸钾溶液褪色,且原理相同
B.维生素C在碱性溶液中能稳定存在
C.维生素C的分子式C6H8O6
D.1 mol维生素C与足量的钠反应能产生2 mol H2
E.分子中手性碳原子数目是2
(3)维生素C分子中含氧官能团的名称为_______ 。
(4)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,其中“亚铁”是关键成分,K3[Fe(CN)6]溶液是检验Fe2+的试剂,K3[Fe(CN)6]中Fe3+的配体是_______ ,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+易被氧化成Fe3+的原因是_______ 。
(5)维生素C是一种易溶于水的有机物,主要原因是_______ 。

(1)以下关于维生素C的说法正确的是
a.分子中既含有极性键又含有非极性键
b.1 mol分子中含有2 mol π键和20 mol σ键
c.该物质的熔点可能高于NaCl
d.分子中碳原子的杂化方式有sp2和sp3两种
e.维生素C晶体溶于水的过程中要克服的微粒间作用力只有范德华力
(2)以下关于维生素C的说法正确的是
A.维生素C能使溴水或酸性高锰酸钾溶液褪色,且原理相同
B.维生素C在碱性溶液中能稳定存在
C.维生素C的分子式C6H8O6
D.1 mol维生素C与足量的钠反应能产生2 mol H2
E.分子中手性碳原子数目是2
(3)维生素C分子中含氧官能团的名称为
(4)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,其中“亚铁”是关键成分,K3[Fe(CN)6]溶液是检验Fe2+的试剂,K3[Fe(CN)6]中Fe3+的配体是
(5)维生素C是一种易溶于水的有机物,主要原因是
您最近一年使用:0次
名校
9 . 已知H和O可以形成H2O和H2O2两种化合物,试根据有关信息完成下列问题:
(1)水是维持生命活动所必需的一种物质。
①H2O内的O—H、水分子间的范德华力和氢键,从强到弱依次为____ 。
②用球棍模型表示的水分子结构是____ 。____ 杂化。H3O+中的H—O—H键角比H2O中的____ 。
(2)已知H2O2分子的结构如图所示:H2O2分子不是直线形的,两个氢原子犹如在半展开的书的两面上,两个氧原子在书脊位置上,书页夹角93°52′,而两个O—H键与O—O键的夹角均为96°52′。
①H2O2分子的电子式是___ ,结构式是___ 。
②H2O2分子是含有___ 键和___ 键的___ (填“极性”或“非极性”)分子。
③H2O2能与水混溶,却不溶于CCl4。请予以解释:___ 。
(1)水是维持生命活动所必需的一种物质。
①H2O内的O—H、水分子间的范德华力和氢键,从强到弱依次为
②用球棍模型表示的水分子结构是

(2)已知H2O2分子的结构如图所示:H2O2分子不是直线形的,两个氢原子犹如在半展开的书的两面上,两个氧原子在书脊位置上,书页夹角93°52′,而两个O—H键与O—O键的夹角均为96°52′。

①H2O2分子的电子式是
②H2O2分子是含有
③H2O2能与水混溶,却不溶于CCl4。请予以解释:
您最近一年使用:0次
2022-05-09更新
|
239次组卷
|
2卷引用:广东省深圳市龙岗区龙城高级中学2021-2022学年高二下学期期中考试化学试题
真题
名校
10 . [化学——选修3:物质结构与性质]碳及其化合物广泛存在于自然界中,回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用___________ 形象化描述。在基态原子中,核外存在______ 对自旋相反的电子。
(2)碳在形成化合物时,其键型以共价键为主,原因是_____________ 。
(3)CS2分子中,共价键的类型有_____________ ,C原子的杂化轨道类型是_______ ,写出两个与CS2具有相同空间构型和键合形式的分子或离子_______________ 。
(4)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253K,沸点为376K,其固体属于_____ 晶体。
碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:

①在石墨烯晶体中,每个C原子连接_____ 个六元环,每个六元环占有___ 个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接________ 个六元环,六元环中最多有________ 个C原子在同一平面。
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用
(2)碳在形成化合物时,其键型以共价键为主,原因是
(3)CS2分子中,共价键的类型有
(4)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253K,沸点为376K,其固体属于
碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:

①在石墨烯晶体中,每个C原子连接
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接
您最近一年使用:0次
2016-12-09更新
|
5121次组卷
|
12卷引用:2016届广东省深圳第二外国语学校高三上学期第二次教学质检化学试卷
2016届广东省深圳第二外国语学校高三上学期第二次教学质检化学试卷2015年全国普通高等学校招生统一考试化学(新课标I卷)2016届黑龙江省哈尔滨一中高三上学期12月月考化学试卷重庆市垫江县2018届高三上学期模底考试理综化学试题宁夏石嘴山市第三中学2018届高三9月月考化学试题百所名校联考-物质结构与性质云南省曲靖市第一中学2020届高三化学仿真模拟考试理科综合化学试题云南省曲靖一中2020届高考化学仿真试卷河北省石家庄市第二中学2020届高中毕业班四月份教学质量监测卷理科综合化学部分安徽省马鞍山市2020届高考第二次模拟理综化学试题辽宁省沈阳东北育才中学2020年高中毕业班教学质量监测卷理科综合化学试题四川省宜宾市第四中学2021届高三上学期开学考试理综化学试题



