2016届广东省深圳第二外国语学校高三上学期第二次教学质检化学试卷
广东
高三
阶段练习
2017-07-27
368次
整体难度:
适中
考查范围:
常见无机物及其应用、认识化学科学、化学反应原理、化学实验基础、化学与STSE、物质结构与性质、有机化学基础
2016届广东省深圳第二外国语学校高三上学期第二次教学质检化学试卷
广东
高三
阶段练习
2017-07-27
368次
整体难度:
适中
考查范围:
常见无机物及其应用、认识化学科学、化学反应原理、化学实验基础、化学与STSE、物质结构与性质、有机化学基础
一、单选题 添加题型下试题
单选题
|
适中(0.64)
1. 下列说法正确的是
| A.坩埚主要用于给固体加热,可用瓷坩埚将烧碱加热融化 |
| B.明矾净水原理是吸附,不涉及化学变化 |
| C.合成纤维和光导纤维都是新型无机非金属材料 |
| D.SO2与FeSO4溶液使酸性高锰酸钾的紫色褪去原理相同 |
【知识点】 碳族元素及其化合物
您最近一年使用:0次
单选题
|
适中(0.64)
2. 设NA为阿伏加德罗常数的数值,下列说法正确的是
| A.0.1mol/L NaOH溶液中,Na+个数为0.1NA |
| B.Na2O2与足量的水反应生成1molO2,转移电子数目为2NA |
| C.2 L0.5 mol·L-1亚硫酸溶液中含有的H+离子数为2 NA |
| D.1molO2和O3混合气体中含有氧原子的数目为2.5NA |
【知识点】 化学计量
您最近一年使用:0次
单选题
|
适中(0.64)
3. 常温下,水溶液中能大量共存的一组离子是
| A.与Al反应放出氢气的溶液中:Na+、H+、NH4+、NO3— |
| B.在c(H+)=1.0×10—13mol/L的溶液中:Na+、K+、AlO2—、CO32— |
| C.澄清透明的溶液中:Fe3+、Mg2+、NO3—、S2— |
| D.在pH=1的溶液中:NH4+、K+、ClO—、Cl— |
【知识点】 离子共存
您最近一年使用:0次
单选题
|
适中(0.64)
4. 能正确表示下列反应的离子方程式是
| A.向NaOH溶液中通入过量的CO2:CO2+OH—====HCO3— |
| B.将SO2气体通入Ba(NO3)2溶液:SO2+H2O+Ba2+====BaSO3↓+2H+ |
| C.实验室制氯气:MnO2+4HCl(浓)====Mn2++2Cl2↑+2H2O |
| D.AlCl3溶液与过量氨水混合:Al3++4NH3·H2O====AlO2—+4NH4++2H2O |
【知识点】 离子反应的发生及书写
您最近一年使用:0次
单选题
|
适中(0.65)
5. 下列实验现象对应的结论正确的是( )
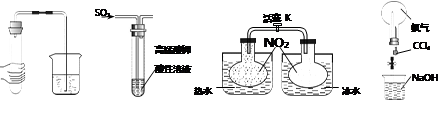
①气密性检查 ②气体性质检验 ③化学平衡的探究 ④喷泉实验
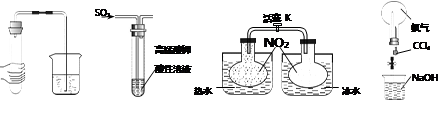
①气密性检查 ②气体性质检验 ③化学平衡的探究 ④喷泉实验
| 选项 | 现象 | 结论 |
| A | ①中导管口冒气泡,手松开无现象 | 气密性良好 |
| B | ②中KMnO4溶液紫红色褪去 | SO2具有漂白性 |
| C | ③中关闭K,气体颜色在热水中比冷水深 | NO2生成N2O4为吸热反应 |
| D | ④中烧瓶中形成喷泉 | Cl2易溶于CCl4 |
| A.A | B.B | C.C | D.D |
【知识点】 氯气 化学平衡的移动及其影响因素 仪器使用与实验安全 综合实验设计与评价解读
您最近一年使用:0次
2014-05-06更新
|
1383次组卷
|
5卷引用:2014届广东省深圳市高三第二次调研考试理综化学试卷
(已下线)2014届广东省深圳市高三第二次调研考试理综化学试卷2015届广东省清远市高三上学期期末理综化学试卷2016届广东省深圳第二外国语学校高三上学期第二次教学质检化学试卷2016届山东省泰安市高三上学期期末考试化学试卷(已下线)2019年3月13日《每日一题》二轮复习 有关气体的制备和性质
单选题
|
适中(0.65)
6. 表中陈述I、II均正确,且两者在反应原理上相似的是
| 选项 | 陈述I | 陈述II |
| A | 向酚酞溶液中加Na2O2,溶液先变红后褪色 | 向石蕊溶液中通入SO2,溶液先变红后褪色 |
| B | 将SO2和Cl2同时通入BaCl2溶液中,产生白色沉淀 | 将CO2和NH3同时通入CaCl2溶液中,产生白色沉淀 |
| C | 向MgCl2溶液中加入NaOH溶液生成白色沉淀 | 向FeCl3溶液中加入NaOH溶液生成红褐色沉淀 |
| D | Na投入水中产生大量气泡 | Na2CO3投入盐酸中产生大量气泡 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2015-11-18更新
|
345次组卷
|
5卷引用:2016届广东省深圳第二外国语学校高三上学期第二次教学质检化学试卷
2016届广东省深圳第二外国语学校高三上学期第二次教学质检化学试卷2017届湖北省松滋市第一中学高三上学期9月月考化学试卷2017届辽宁省瓦房店市高级中学高三上10月月考化学试卷安徽省六安市一中2017届高三上学期第三次月考化学试卷(已下线)河北省石家庄市2023届高中毕业年级教学质量检测(一模)变式题(选择题6-10)
单选题
|
适中(0.65)
名校
解题方法
7. 向30 mL 1 mol·L-1的AlCl3溶液中逐渐加入浓度为4 mol·L-1的NaOH溶液,若产生0.78 g白色沉淀,则加入的NaOH溶液的体积可能为( )
| A.3 mL | B.7.5 mL | C.15 mL | D.17.5 mL |
您最近一年使用:0次
2016-12-09更新
|
637次组卷
|
10卷引用:2016届内蒙古巴彦淖尔市第一中学高三上学期9月月考化学试卷
2016届内蒙古巴彦淖尔市第一中学高三上学期9月月考化学试卷2016届广东省深圳第二外国语学校高三上学期第二次教学质检化学试卷(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第2讲 镁、铝及其重要化合物【教学案】浙江省宁波诺丁汉大学附属中学2019-2020学年高二上学期期中考试化学(实验班)试题黑龙江省哈尔滨市第六中学2019-2020学年高一上学期12月月考化学试题吉林省长春市第五中学2021届高三上学期期中考试化学试题江西省上饶市铅山县第一中学2020-2021学年高一上学期联考(统招班)化学试题(已下线)第08讲 铝、镁及其重要化合物(精讲)-2022年一轮复习讲练测黑龙江省鸡东县第二中学2021-2022学年高三上学期期中考试化学试题(已下线)第4讲 镁、铝及其化合物
二、填空题 添加题型下试题
填空题
|
较难(0.4)
8. FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是___________________ 。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)______________________ 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1, c(Fe3+)=1.0×10-3mol·L-1, c(Cl-)=5.3×10-2mol·L-1,则该溶液的PH约为_____________________ 。
②完成NaClO3氧化FeCl2的离子方程式:
 ClO3-+
ClO3-+ Fe2++
Fe2++
_________ = Cl-+
Cl-+ Fe3++
Fe3++
__________ .
(3)FeCl3在溶液中分三步水解:
Fe3++H2O Fe(OH)2++H+——K1
Fe(OH)2++H+——K1
Fe(OH)2++H2O Fe(OH)2++H+——K2
Fe(OH)2++H+——K2
Fe(OH)2++H2O Fe(OH)3+H+——K3
Fe(OH)3+H+——K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是__________ 。
(4)FeCl3也可以用作SO2尾气的吸收剂,原理上与NaOH吸收SO2有何不同______________________
(5)电解时,微粒的放电顺序遵循微粒得失电子能力的强弱,SO32—具有强的还原性。用NaOH吸收烟气中的SO2,将所得的Na2SO3溶液用碳棒进行电解,写出阳极电极反应_____________________________
(1)FeCl3净水的原理是
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1, c(Fe3+)=1.0×10-3mol·L-1, c(Cl-)=5.3×10-2mol·L-1,则该溶液的PH约为
②完成NaClO3氧化FeCl2的离子方程式:
 ClO3-+
ClO3-+ Fe2++
Fe2++
 Cl-+
Cl-+ Fe3++
Fe3++
(3)FeCl3在溶液中分三步水解:
Fe3++H2O
 Fe(OH)2++H+——K1
Fe(OH)2++H+——K1Fe(OH)2++H2O
 Fe(OH)2++H+——K2
Fe(OH)2++H+——K2Fe(OH)2++H2O
 Fe(OH)3+H+——K3
Fe(OH)3+H+——K3以上水解反应的平衡常数K1、K2、K3由大到小的顺序是
(4)FeCl3也可以用作SO2尾气的吸收剂,原理上与NaOH吸收SO2有何不同
(5)电解时,微粒的放电顺序遵循微粒得失电子能力的强弱,SO32—具有强的还原性。用NaOH吸收烟气中的SO2,将所得的Na2SO3溶液用碳棒进行电解,写出阳极电极反应
您最近一年使用:0次
填空题
|
较难(0.4)
9. 高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,工业上用难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),制备高纯六水氯化锶晶体的过程为:

已知: Ⅰ.SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
(1)操作①加快反应速率的措施有___________ (写一种)。碳酸锶与盐酸反应的离子方程式___________ 。
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为___________ 。
(3)在步骤②-③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为___________ 。
A.氨水 B.氢氧化锶粉末 C. 氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是___________ (填化学式)。
(5)步骤④的操作是___________ 、___________ 。
(6)工业上用热风吹干六水氯化锶,适宜的温度是___________
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上

已知: Ⅰ.SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为
(3)在步骤②-③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为
A.氨水 B.氢氧化锶粉末 C. 氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是
(5)步骤④的操作是
(6)工业上用热风吹干六水氯化锶,适宜的温度是
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上
您最近一年使用:0次
2019-01-30更新
|
146次组卷
|
4卷引用:2015届广东省惠州市高三第一次调研考试化学试卷
(已下线)2015届广东省惠州市高三第一次调研考试化学试卷(已下线)2015届广东省东莞市松山湖中学高三第一次调研考试理科化学试卷2016届广东省深圳第二外国语学校高三上学期第二次教学质检化学试卷2016届四川省雅安市天全中学高三上学期11月月考理综化学试卷
三、解答题 添加题型下试题
解答题-工业流程题
|
较难(0.4)
解题方法
10. 钢铁企业酸洗钢材时产生的废液主要成分为Fe2+、H+、Cl-,可用下述方法处理该废液,回收盐酸和制备氧化铁涂料。

(1)单质X的化学式是___________ 。
(2)氯化亚铁溶液经高温喷雾焙烧转化为HCl气体和氧化铁粉末,有关的化学方程式依次为:_____________________________________________________________________ 。
(3)某铁红涂料中除含有Fe2O3外,还可能添加有CuO或FeO中的一种,请设计实验方案,探究该铁红涂料中添加物的成分。
① 提出合理假设
假设1:添加了CuO
假设2:添加了FeO
② 请设计方案,验证上述假设,写出实验步骤、预期现象和结论。
限选试剂:铁粉、3mol•L-1H2SO4、0.1 mol•L-1酸性KMnO4溶液、10%NaOH溶液、10%H2O2、KSCN溶液
(4)请计算,用635g水完全吸收“高温喷雾焙烧”产生的HCl气体___ 升(标准状况),即可得到36.5%的浓盐酸(相对原子质量 Cl 35.5 H 1)。

(1)单质X的化学式是
(2)氯化亚铁溶液经高温喷雾焙烧转化为HCl气体和氧化铁粉末,有关的化学方程式依次为:
(3)某铁红涂料中除含有Fe2O3外,还可能添加有CuO或FeO中的一种,请设计实验方案,探究该铁红涂料中添加物的成分。
① 提出合理假设
假设1:添加了CuO
假设2:添加了FeO
② 请设计方案,验证上述假设,写出实验步骤、预期现象和结论。
限选试剂:铁粉、3mol•L-1H2SO4、0.1 mol•L-1酸性KMnO4溶液、10%NaOH溶液、10%H2O2、KSCN溶液
| 操作步骤 | 预期现象和结论 |
| 步骤1.取少量样品于试管中, | 样品全部溶解,得到澄清的溶液。 |
| 步骤2. 步骤3. |
(4)请计算,用635g水完全吸收“高温喷雾焙烧”产生的HCl气体
【知识点】 有关铁及其化合物转化的流程题型解读 物质制备的探究解读
您最近一年使用:0次
2016-12-09更新
|
441次组卷
|
3卷引用:2015届广东省惠州市高三第一次调研考试化学试卷
解答题-工业流程题
|
适中(0.65)
真题
名校
11. 氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:

回答下列问题:
(1)步骤①中得到的氧化产物是_________ ,溶解温度应控制在60~70度,原因是__________ 。
(2)写出步骤③中主要反应的离子方程式___________ 。
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_________ (写名称)。
(4)上述工艺中,步骤⑥不能省略,理由是______________________________ 。
(5)步骤②、④、⑤、⑧都要进行固液分离。工业上常用的固液分离设备有__________ (填字母)
(6)准确称取所制备的氯化亚铜样品m g,将其置于若两的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液b mL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为__________ 。

回答下列问题:
(1)步骤①中得到的氧化产物是
(2)写出步骤③中主要反应的离子方程式
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是
(4)上述工艺中,步骤⑥不能省略,理由是
(5)步骤②、④、⑤、⑧都要进行固液分离。工业上常用的固液分离设备有
| A.分馏塔 | B.离心机 | C.反应釜 | D.框式压滤机 |
(6)准确称取所制备的氯化亚铜样品m g,将其置于若两的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液b mL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为
【知识点】 铜的其他化合物 常见无机物的制备解读 化学实验方案的设计与评价
您最近一年使用:0次
2015-06-24更新
|
4988次组卷
|
6卷引用:2015年全国普通高等学校招生统一考试化学(新课标I卷)
四、填空题 添加题型下试题
填空题
|
适中(0.65)
真题
名校
12. [化学——选修3:物质结构与性质]碳及其化合物广泛存在于自然界中,回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用___________ 形象化描述。在基态原子中,核外存在______ 对自旋相反的电子。
(2)碳在形成化合物时,其键型以共价键为主,原因是_____________ 。
(3)CS2分子中,共价键的类型有_____________ ,C原子的杂化轨道类型是_______ ,写出两个与CS2具有相同空间构型和键合形式的分子或离子_______________ 。
(4)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253K,沸点为376K,其固体属于_____ 晶体。
碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:

①在石墨烯晶体中,每个C原子连接_____ 个六元环,每个六元环占有___ 个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接________ 个六元环,六元环中最多有________ 个C原子在同一平面。
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用
(2)碳在形成化合物时,其键型以共价键为主,原因是
(3)CS2分子中,共价键的类型有
(4)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253K,沸点为376K,其固体属于
碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:

①在石墨烯晶体中,每个C原子连接
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接
您最近一年使用:0次
2016-12-09更新
|
5125次组卷
|
12卷引用:2015年全国普通高等学校招生统一考试化学(新课标I卷)
2015年全国普通高等学校招生统一考试化学(新课标I卷)2016届广东省深圳第二外国语学校高三上学期第二次教学质检化学试卷2016届黑龙江省哈尔滨一中高三上学期12月月考化学试卷重庆市垫江县2018届高三上学期模底考试理综化学试题宁夏石嘴山市第三中学2018届高三9月月考化学试题百所名校联考-物质结构与性质云南省曲靖市第一中学2020届高三化学仿真模拟考试理科综合化学试题云南省曲靖一中2020届高考化学仿真试卷河北省石家庄市第二中学2020届高中毕业班四月份教学质量监测卷理科综合化学部分安徽省马鞍山市2020届高考第二次模拟理综化学试题辽宁省沈阳东北育才中学2020年高中毕业班教学质量监测卷理科综合化学试题四川省宜宾市第四中学2021届高三上学期开学考试理综化学试题
五、解答题 添加题型下试题
解答题-有机推断题
|
较难(0.4)
13. A(C2H2)是基本有机化工原料。由A制备聚乙烯醇缩丁醛和顺式异戊二烯的合成路线(部分反应条件略去)如图所示:

注明:题干错误,聚乙烯醇缩丁醛应该是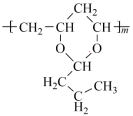
(1)A的名称是______________ ,B含有的官能团是_______________ 。
(2)①的反应类型是____________ ,⑦的反应类型是________________ 。
(3)C、D的结构简式分别为_________________ 。
(4)3-氯-3-甲基-1-丁烯一定条件下,也可以反应得到异戊二烯,请写出反应方程式(注明条件)_________________________
(5)写出与A具有相同官能团的异戊二烯的所有同分异构体_______________ (写结构简式)。

注明:题干错误,聚乙烯醇缩丁醛应该是

(1)A的名称是
(2)①的反应类型是
(3)C、D的结构简式分别为
(4)3-氯-3-甲基-1-丁烯一定条件下,也可以反应得到异戊二烯,请写出反应方程式(注明条件)
(5)写出与A具有相同官能团的异戊二烯的所有同分异构体
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、认识化学科学、化学反应原理、化学实验基础、化学与STSE、物质结构与性质、有机化学基础
试卷题型(共 13题)
题型
数量
单选题
7
填空题
3
解答题
3
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.64 | 碳族元素及其化合物 | |
| 2 | 0.64 | 化学计量 | |
| 3 | 0.64 | 离子共存 | |
| 4 | 0.64 | 离子反应的发生及书写 | |
| 5 | 0.65 | 氯气 化学平衡的移动及其影响因素 仪器使用与实验安全 综合实验设计与评价 | |
| 6 | 0.65 | Fe2+的鉴别及其应用 溶度积常数与溶解度的关系 化学实验方案的设计与评价 | |
| 7 | 0.65 | 氢氧化铝与强碱反应 铝盐与强碱溶液反应 | |
| 二、填空题 | |||
| 8 | 0.4 | 盐类的水解 电解池 | |
| 9 | 0.4 | 化学实验基础 化学与材料的发展 | |
| 12 | 0.65 | 物质结构与性质综合考查 利用杂化轨道理论判断化学键杂化类型 晶胞的有关计算 | |
| 三、解答题 | |||
| 10 | 0.4 | 有关铁及其化合物转化的流程题型 物质制备的探究 | 工业流程题 |
| 11 | 0.65 | 铜的其他化合物 常见无机物的制备 化学实验方案的设计与评价 | 工业流程题 |
| 13 | 0.4 | 有机反应类型 常见官能团名称、组成及结构 根据要求书写同分异构体 有机合成综合考查 | 有机推断题 |



